 成人院外心脏骤停肾上腺素剂量、目标温度管理及神经功能与生存预后的分析
成人院外心脏骤停肾上腺素剂量、目标温度管理及神经功能与生存预后的分析
# 成人院外心脏骤停肾上腺素剂量、目标温度管理及神经功能与生存预后的分析
Yang BY,Bulger N,Chocron R,et al. 院外心脏骤停成人患者的肾上腺素剂量、目标温度管理、神经病学和生存结局分析。*JAMA 网络开放。*2022;5 (8):e2226191。doi:10.1001/jamanetworkopen。2022.26191
# 关键点
问题目标温度管理 (TTM) 是否会改变较高肾上腺素剂量与院外心脏骤停后较差生存结局之间的相关性?
结果该 5253 例院外心脏骤停成人队列研究发现,TTM 与肾上腺素剂量增加之间存在统计学显著的相互作用,对神经功能良好的存活时间产生影响,因此,在院前复苏期间,TTM 的相对有益关联随着肾上腺素剂量每增加 1 mg 而增加。
意义目标温度管理可能会减少与高剂量肾上腺素相关的不良结果,并有助于更好地指导治疗以改善生存率。
# 摘要
重要性肾上腺素可改善院外心脏骤停 (OHCA) 后自主循环的恢复。这些有益的心脏作用并不能直接转化为更好的神经系统结局,可能是由于肾上腺素诱导的微血管作用产生了关键的脑缺血。
目的检查目标温度管理 (TTM) 是否改变增加院前肾上腺素剂量与神经功能良好生存之间的不良关联。
设计、背景和参与者本回顾性队列研究评估了 2008 年 1 月 1 日至 2018 年 12 月 31 日期间来自华盛顿州西雅图和 King 县的 14612 例非创伤性 OHCA 成人患者,包括达到自主循环恢复且在入院时无意识的患者。 在 2021 年 4 月至 2022 年 5 月期间进行了数据分析。
院前复苏期间的暴露量肾上腺素剂量和 TTM。
主要结局和指标较好的神经存活率(脑功能分级 [CPC] 1 或 2)和出院存活率。
结果在 14612 例接受评估的成人中,5253 例(中位年龄 63 岁;IQR,51-74 岁;3460 例 [65.8%] 男性)有资格参加研究。中位肾上腺素剂量为 2.0 mg (IQR,1.0-3.0 mg);3052 例患者 (58.1%) 接受了 TTM。CPC 1~2 者共 1889 例 (36.0%) 存活,2177 例 (41.4%) 存活至出院。肾上腺素剂量增加与 CPC 1-2(每增加 1 毫克肾上腺素,比值比 [OR],0.46;95% CI 0.42-0.50)和生存率 (OR,0.47;95% CI,0.43-0.51) 降低相关。TTM 改变了剂量依赖性肾上腺素的关系。校正 Utstein 协变量后,TTM 与 CPC 1-2 比值(相互作用 OR,1.36;95% CI,1.22-1.51)和生存率(相互作用 OR,1.37;95% CI,1.24-1.51)的相对逐步改善相关。当根据可电击 OHCA 和不可电击 OHCA 之间的初始节律分层分析时,也观察到显著相互作用(可电击相互作用 OR,1.20;95% CI,1.04-1.39;和不可电击相互作用 OR,1.24,95% CI,1.07-1.45)。
结论和相关性本队列研究发现 TTM 与肾上腺素剂量之间存在相互作用,使得 TTM 的有益关联随肾上腺素剂量的增加而增加,表明 TTM 可能减弱较高剂量肾上腺素的不良反应。
# 引言
院外心脏骤停 (OHCA) 是全球死亡的主要原因。[1],[2] 成功复苏和存活是可能的,依赖于及时的协调反应,包括早期识别、早期心肺复苏 (CPR)、早期除颤以及专家高级生命支持 (ALS) 和细致的复苏后护理。[1]、[3]
ALS 的主要治疗方法是使用肾上腺素帮助恢复自主循环。在一项比较肾上腺素与安慰剂用于 OHCA 复苏的大型随机临床试验 [4] 中,肾上腺素显著增加了自主循环的恢复 (30% vs 12%),但存活至出院的获益仅为中度 (3% vs 2%),对神经功能较好的存活率无影响 (2% vs 1.5%)。一种可能的解释是肾上腺素的心脏获益因其不良的神经系统作用而减弱。更具体地说,肾上腺素不仅可改善大血管冠状动脉流量、心电活动和心肌收缩力,还可诱导微血管失调,加重严重脑缺血。[5],[6] 随着肾上腺素总剂量的增加,这种获益和风险平衡可能变得越来越不利,尽管给药时间也可能影响结局。[7],[8]
目标温度管理 (TTM) 可能支持院外心脏骤停 (OHCA) 后的大脑恢复,可能是通过限制神经损伤级联反应,减少了心脏骤停后缺血以及可能因再灌注损伤使缺血加重、复苏后全身炎症反应以及有可能肾上腺素剂量不断增加等所导致的死亡。[9],[10] 尽管既往试验 [11]-[15] 在最佳温度方面显示了相互矛盾的结果,但来自 2 项大型回顾性研究的数据 [14],[15] 表明,TTM 益处最大的可能是缺血 - 再灌注损伤更严重的患者。
TTM 能否减轻肾上腺素相关的神经系统不良反应尚不明确。我们假设肾上腺素剂量与 TTM 之间存在相互作用,因此,TTM 可降低肾上腺素剂量增加与神经系统良好生存状态之间的不利关联,反之,TTM 的潜在生存获益也会随着肾上腺素剂量的增加而增加。
# 方法
研究设计、人群和环境
本回顾性队列研究评估了 2008 年 1 月 1 日至 2018 年 12 月 31 日在华盛顿州西雅图和 King 县(金县是美国华盛顿州的一个县,县治西雅图,成立于 1852 年 12 月 22 日,现有人口 2,079,967 人。县内有知名企业波音公司和微软公司。)可能符合 TTM 诊断的 14,612 例非创伤性 OHCA 成人(≥18 岁)([图 1])。为了符合 TTM 的条件,患者必须在复苏后入院,并且在到达急诊科 (ED) 时尚未清醒。不适合 TTM 的患者被排除在外,包括现场或 ED 宣布死亡或从 ED 出院存活的患者。其他排除标准包括:接受 King 县以外机构治疗的 ALS 患者、有医嘱停止复苏的患者以及肾上腺素剂量未知的患者。本研究由华盛顿大学机构审查委员会和西雅图和 King 县公共卫生研究审查委员会审查和批准。由于该研究是观察性的,并被认为风险极小,因此豁免了同意的要求。本研究按照加强流行病学观察性研究报告 ([STROBE]) 指南进行。[17]
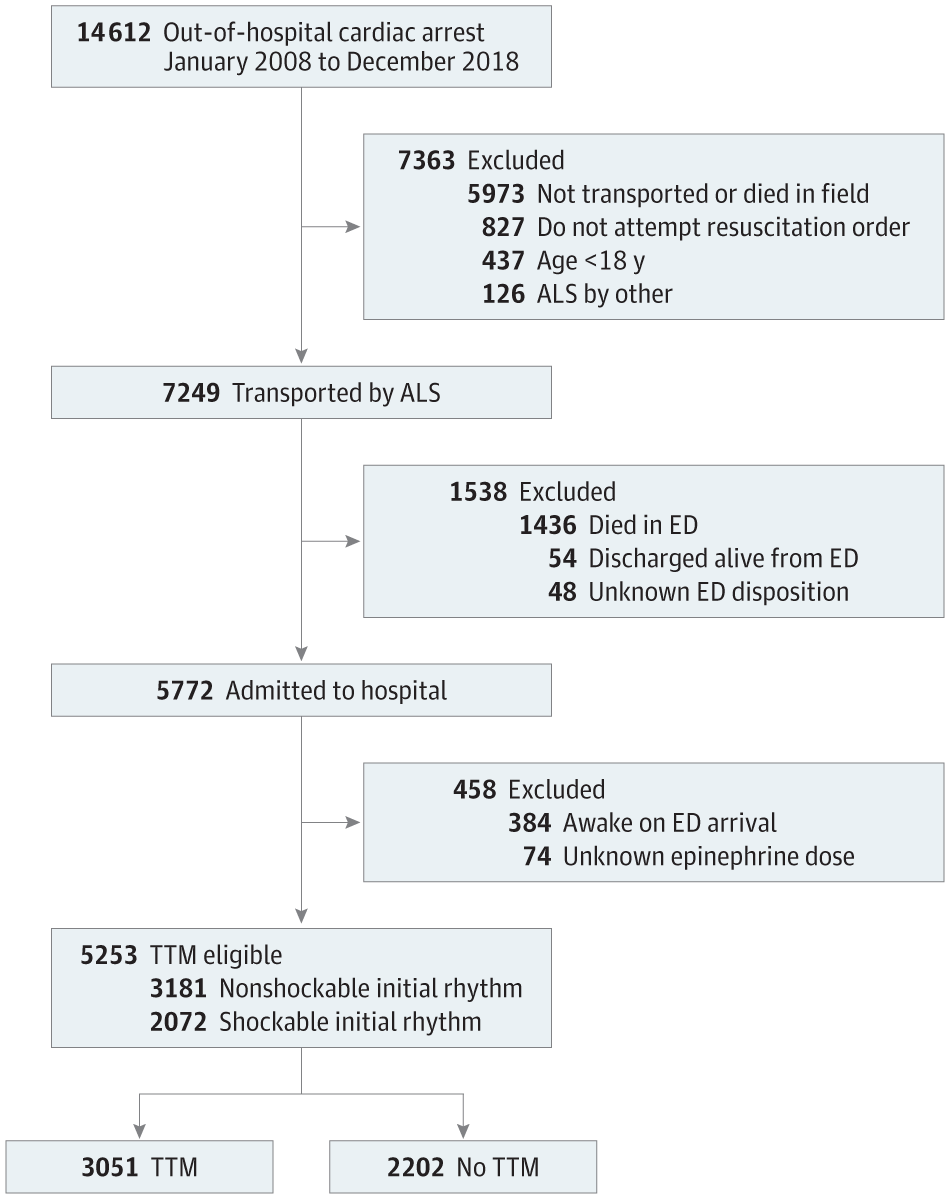
ALS indicates advanced life support; ED, emergency department; and TTM, targeted temperature management.
Figure 1. Flow Diagram of Patient Cohort
King 县是一个面积 2300 平方英里的大都市地区,有 230 万人居住在城市、郊区和农村。每年大约有 1300 人在 OHCA 后接受急救医疗服务 (EMS) 的复苏尝试。 复苏通常遵循美国心脏协会指南。[16] 一级急救医疗技术人员提供 CPR 和使用自动体外除颤器 (AED)。二级护理人员接受了高级心脏生命支持培训,包括手动节律评估、高级气道放置和高级心脏生命支持药物给药,如肾上腺素。患者被送至 14 家具有冠状动脉介入和重症监护能力的医院之一,包括 TTM。
数据收集和定义
紧急医疗服务根据 Utstein 模板对组织的每个 OHCA 治疗进行登记。[18] 经过培训的协调员审查派遣记录、EMS 记录、除颤器记录和医院信息,以编码人口统计学、情况、护理和结局信息。由于我们没有可靠准确的人种和种族类别数据源,因此我们未收集本研究该人口统计学特征的相关数据。前瞻性全面收集数据,以减少潜在的选择偏倚。根据 EMS 到达前停搏的患者从 9-1-1 呼叫到初始自主循环恢复的时间间隔,以及 EMS 到达后停搏的患者从现场到达到初始自主循环恢复的时间间隔,估计停搏持续时间。
暴露量
主要暴露是院前肾上腺素总剂量和 TTM。肾上腺素剂量根据 EMS 记录确定,TTM 定义为根据医院记录应用了表面冷却垫或血管内冷却导管。研究期间未进行院前降温。
结局
主要结局是根据脑功能分级 (CPC) 评估的出院时神经状态良好的生存率。通过调阅医院记录计算 CPC。 我们将 CPC 评分为 1 或 2 分界定为神经功能良好的生存状态。CPC 具有良好的评定者间可靠性 [19],与长期预后相关 [20]。次要预后是存活出院。
统计分析
使用标准统计软件(R,4.0.3 版,R Foundation for statistical Computing)进行所有统计分析。[21] 采用描述性统计量根据肾上腺素剂量和 TTM 状态评估总体基线特征。使用多变量 logistic 回归,我们对预后、肾上腺素剂量、TTM 以及肾上腺素剂量和 TTM 之间的相互作用与预后的相关性进行了建模。将肾上腺素剂量作为连续变量建模,以优化效能。次要分析也将肾上腺素剂量作为离散的独立分类变量建模。我们还进行了事后分析,以评价肾上腺素剂量的潜在阈值效应,根据接受 0 mg、超过 0-3 mg 和超过 3 mg 的患者按剂量分组。
调整 Utstein 协变量的多变量模型,包括年龄、性别、目击人状态(EMS 目击人、旁观者目击人和无目击人)、旁观者 CPR、AED 应用、初始节律(可电击 vs 不可电击)以及从收到 9-1-1 呼叫到初始应答者场景到达的时间间隔。为了解释不同医院护理或结局的潜在差异,我们使用了分层混合效应模型,将医院建模作为随机效应。在预先计划的亚组分析中,我们根据初始节律对结果进行分层:可电击与不可电击。在敏感性分析中,我们还对心脏骤停持续时间进行了额外调整。在 2021 年 4 月至 2022 年 5 月期间进行了数据分析。
# 结果
在 14612 例接受评估的成人中,5253 例(中位年龄 63 岁 [IQR,51-74 岁;3460 例 [65.8%] 男性和 1793 例 [34.2%] 女性)入组研究。 接受 TTM 的受试者更有可能为男性,在 EMS 到达前和在公众场所时心脏骤停,并表现出可电击节律([补充] 中的电子表 1)。肾上腺素的中位剂量为 2.0 mg (IQR,1.0-3.0 mg)。共有 3052 例 (58.1%) 接受了 TTM。当按肾上腺素剂量和 TTM 状态对特征进行分层时([表]),0 mg 肾上腺素剂量组中接受 TTM 的患者比例最小 (574 [48.8%])。在其他肾上腺素组中,接受 TTM 的患者比例范围为 58.0%(n = 450)(超过 2-3 mg)至 66.1%(n = 283)(超过 3-4 mg)。
Table. Patient Characteristics Stratified by Dose of Epinephrine and TTMa
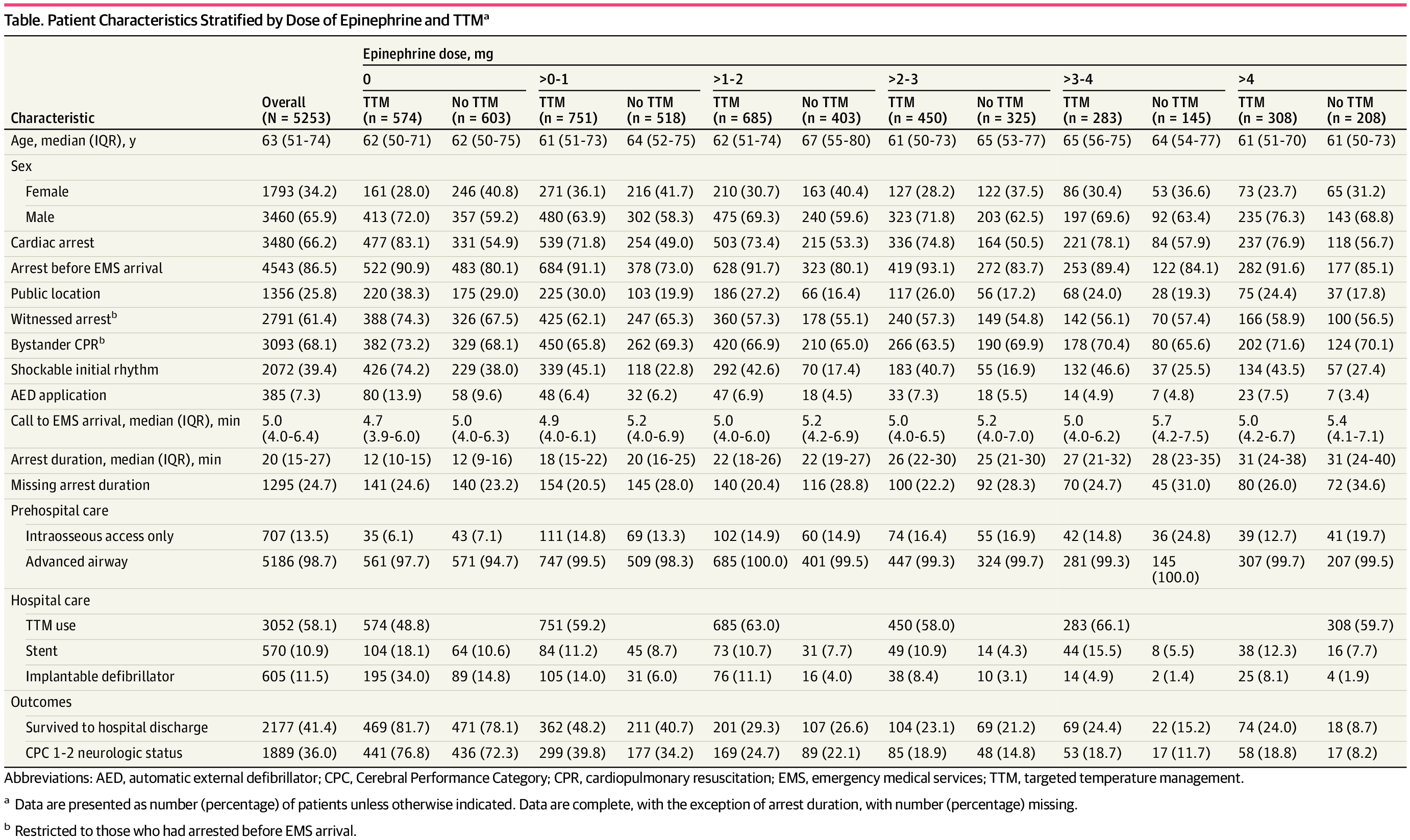
我们观察到肾上腺素剂量的增加与较好的神经功能存活率的降低之间存在剂量依赖性关联。接受 0 mg 治疗者的神经功能良好生存率为 74.5%(877/1177),接受 0-1 mg 治疗者为 37.5%(476/1269),接受 1-2 mg 治疗者为 23.7%(258/1088),接受 2-3 mg 治疗者为 17.2%(133/775),接受 3-4 mg 治疗者为 16.4%(70/428),4 mg 以上为 14.5%(75/516)。在 logistic 回归模型中,校正 Utstein 协变量后,较高的院前肾上腺素剂量与神经功能良好生存率下降(每增加 1 mg 肾上腺素,优势比 [OR],0.46;95% CI,0.42-0.50)和出院生存率下降(OR,0.47;95% CI,肾上腺素每增加 1 mg (0.43-0.51) 有关。总体而言,不同 TTM 状态的患者的神经功能良好生存率无差异(TTM 为 36.2%,非 TTM 为 35.6%)。
当肾上腺素剂量作为连续变量建模时,TTM 改变了预后和肾上腺素剂量增加之间的相关性([图 2])。 在校正了 Utstein 协变量后,与非 TTM 的受试者相比,TTM 逐步改善了神经功能良好生存的几率(相互作用 OR,1.36;95% CI,1.22-1.51,每增加 1 mg 肾上腺素)和生存率(相互作用 OR,1.37;95% CI,1.24-1.51,每增加 1 mg 肾上腺素)。显著的相互作用表明,预后与肾上腺素剂量的斜率因 TTM 状态不同而不同,接受 TTM 的患者的两种临床生存预后的下降均不太陡峭。当根据可电击 OHCA 和不可电击 OHCA 之间的初始节律分层分析时,也观察到显著相互作用(可电击相互作用 OR,1.20;95% CI,1.04-1.39 和不可电击相互作用 OR,1.24;95% CI,1.07-1.45)([图 2])。
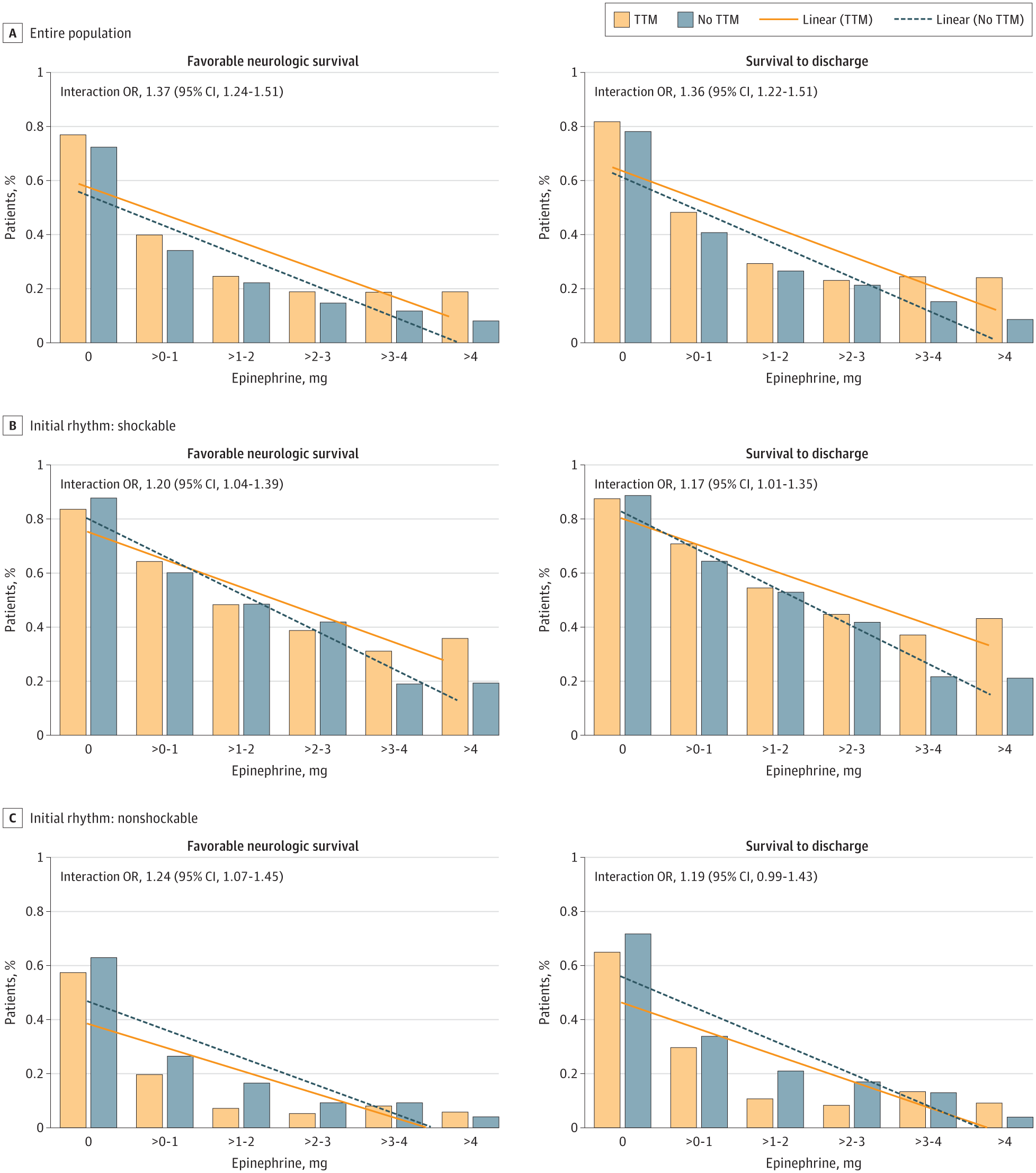
功能良好生存定义为脑功能分级 1-2。相互作用比值比 (OR) 是肾上腺素每增加 1 mg,与 TTM 相关的良好预后的 OR,使用连续肾上腺素剂量变量对肾上腺素 ×TTM 相互作用进行建模。调整 Utstein 协变量的多变量混合效应模型,包括年龄、性别、目击者状态(由紧急医疗服务人员目击、旁观者目击和无目击者)、旁观者心肺复苏术、自动体外除颤器应用、初始节律(可电击 vs 不可电击),以及从收到 9-1-1 呼叫到初始应答者场景到达的间隔,使用医院作为随机效应。
图 2. 院外心脏骤停后的目标温度管理 (TTM)、肾上腺素剂量和临床预后
当肾上腺素剂量作为独立分类变量建模时,TTM 与剂量超过 2 mg 时的有利神经功能生存率和出院生存率方面的获益相关([图 3])。在事后评价中,将肾上腺素剂量建模为 0、> 0-3 mg 和 > 3 mg,在较高肾上腺素剂量而非较低剂量肾上腺素下,TTM 与神经功能良好的生存获益相关([图 4])。当对不同肾上腺素暴露模型的停搏持续时间进行额外调整时,结果相似([补充] 电子表 2)。
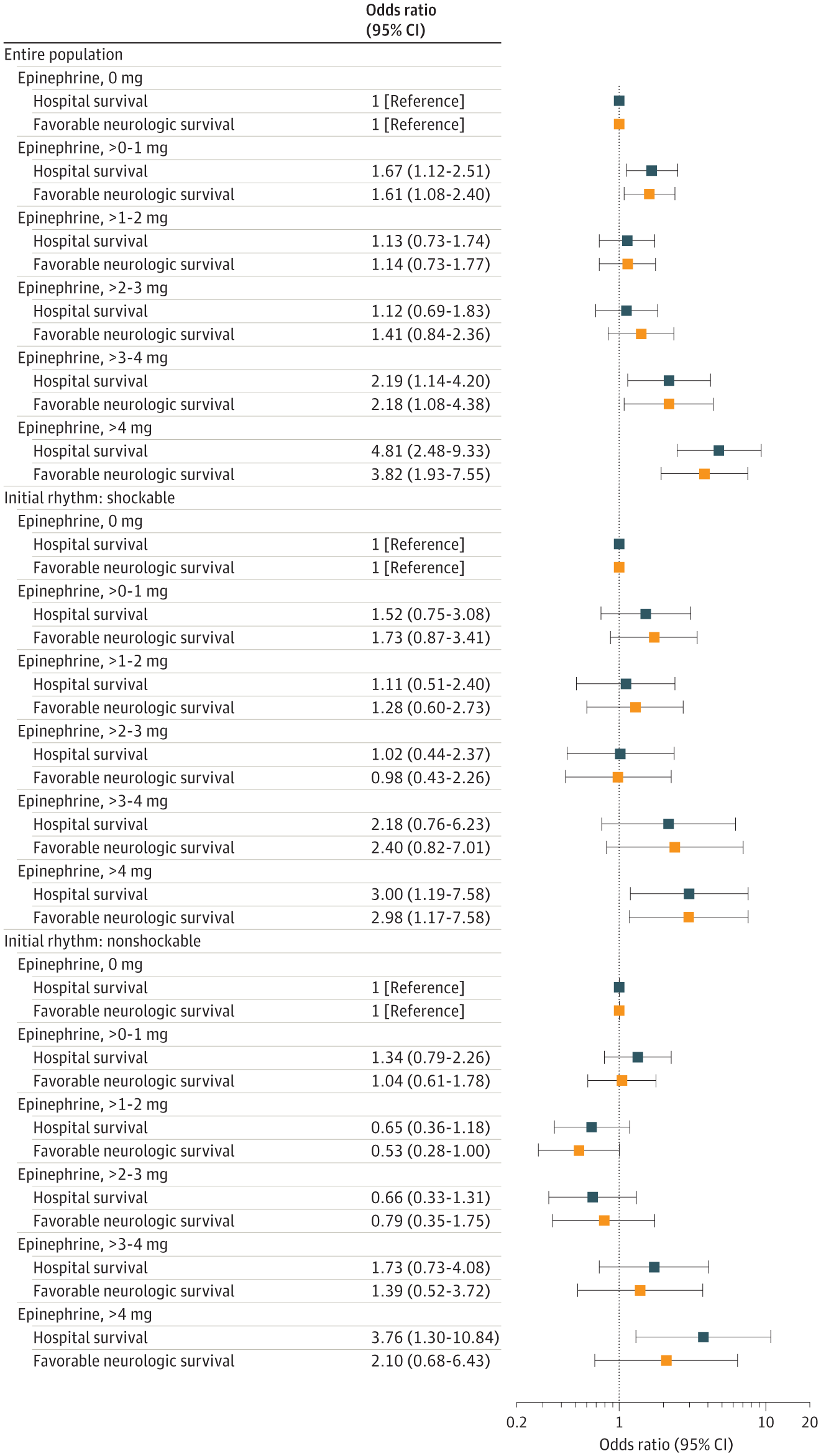
比值比代表了采用独立分类肾上腺素变量以 1 mg 增量对肾上腺素 ×TTM 相互作用进行建模时,TTM(vs 无 TTM)与各肾上腺素剂量的临床预后之间的相关性。将良好的神经功能存活定义为 1-2 级脑功能状态。调整 Utstein 协变量的多变量混合效应模型,包括年龄、性别、目击状态(由紧急医疗服务目击、由旁观者目击和无目击)、旁观者心肺复苏术、自动体外除颤仪应用,初始节律(可电击 vs 不可电击),以及从接收 9-1-1 呼叫至初始应答者场景到达的时间间隔,使用医院作为随机效应。
图 3. 根据院外心脏骤停后肾上腺素剂量评估目标温度管理 (TTM) 与临床预后的相关性
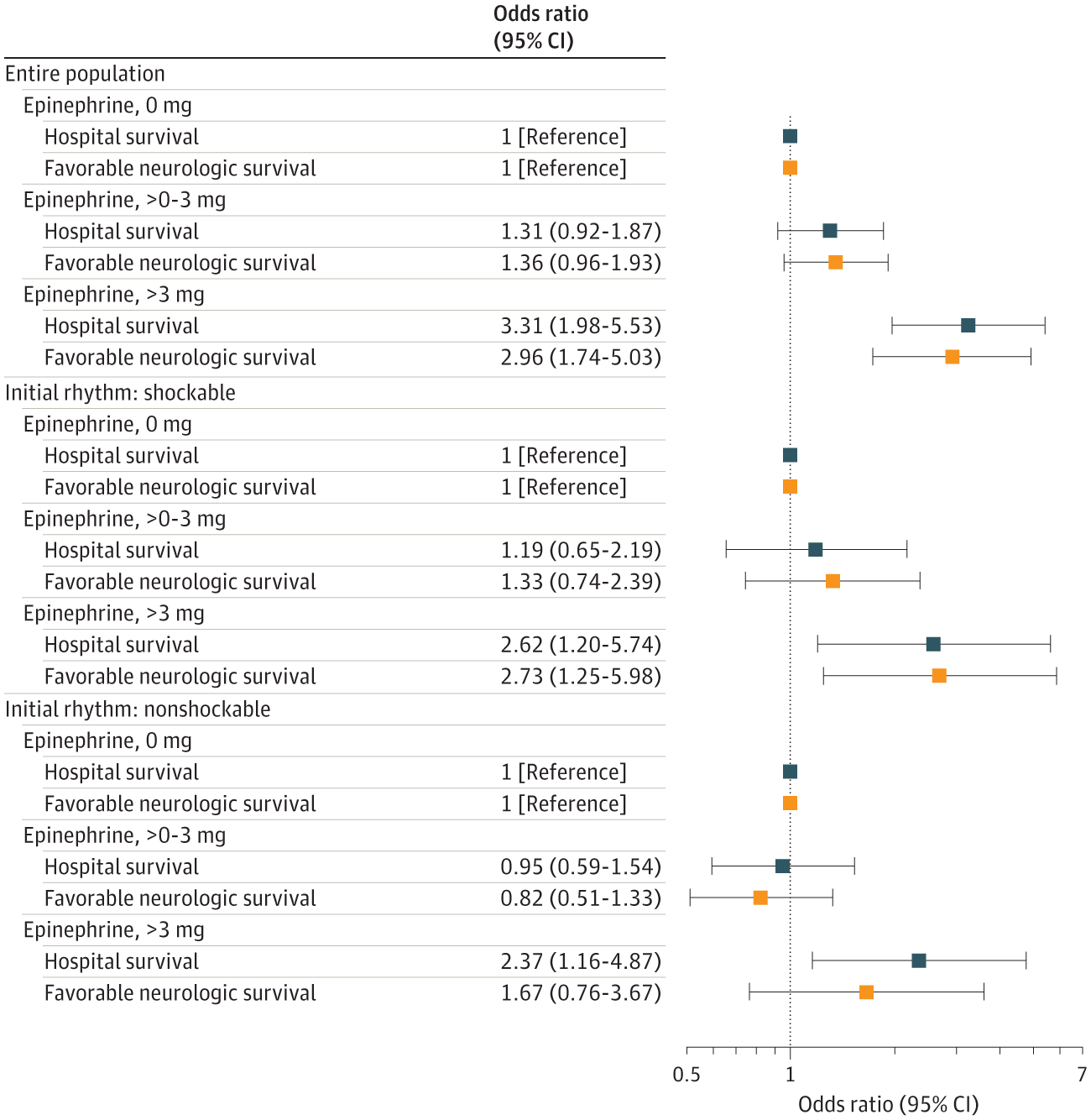
比值比代表了采用独立分类肾上腺素分组变量,通过肾上腺素 ×TTM 相互作用建模的每组肾上腺素剂量组 TTM(vs 无 TTM)与临床预后的相关性。将良好的神经功能生存定义为 1-2 级脑功能状态。调整 Utstein 协变量的多变量混合效应模型,包括年龄、性别、目击状态(由紧急医疗服务目击、旁观者目击和无目击)、旁观者心肺复苏术、自动体外除颤仪应用,初始节律(可电击 vs 不可电击),以及从接收 9-1-1 呼叫至初始应答者场景到达的时间间隔,使用医院作为随机效应。
图 4. 根据院外心脏骤停后肾上腺素剂量评估目标温度管理 (TTM) 与临床预后的相关性
# 讨论
小结
在从 OHCA 复苏并符合 TTM 条件的患者的队列研究中,我们评估了 TTM 是否改变肾上腺素剂量增加与降低神经功能良好生存率之间的负相关。我们观察到显著的相互作用,表明与 TTM 相关的相对良好生存获益随肾上腺素剂量的增加而增加。在没有或低剂量肾上腺素的受试者中,几乎没有与 TTM 相关的临床预后获益的证据;相反,在野外复苏期间接受超过 3 mg 肾上腺素的受试者中,TTM 与神经功能良好生存的几率增加 3 倍相关。在伴有可电击和不可电击节律的受试者中,肾上腺素与 TTM 之间的剂量依赖性相互作用一致。研究结果表明,院前肾上腺素的用量可以挑选出那些可能从 TTM 中获益较大的患者。
肾上腺素主要结局
在本研究中,我们观察到肾上腺素剂量的增加与良好的神经功能存活的可能性降低相关,这种相关性之前已提出。[8][22] 这种剂量负相关性有多种解释。肾上腺素增加可能是难治性患者生理特征的体现,表明增加肾上腺素剂量只是疾病严重程度的一个标志。或者,肾上腺素可能直接导致病理改变,因为获益和风险平衡会随着剂量的增加而变化。一些证据表明,肾上腺素对大脑的大血管和微血管效应具有剂量依赖性,随着剂量的增加,降低脑灌注和脑组织氧合。[6][7] 除了复苏期间给予的肾上腺素总剂量外,肾上腺素给药时间也与结局相关,突出了肾上腺素与预后之间相关性的复杂性。[23]
TTM 结局:相互作用的概念
鉴于对肾上腺素的理解,我们评估了 TTM 是否会因肾上腺素剂量不同而产生不同的影响。 在接受 TTM 的患者中,肾上腺素相关的脑血流量和脑组织氧合下降可能被较低的脑氧耗抵消或得以重新匹配。[6][7] 此外,TTM 可能通过限制缺血再灌注损伤复杂的病理生理机制提供神经保护作用。[14] 推测这种损伤可能的特征为严重程度不同 TTM 反应也不同。与损伤不太严重的患者相比,缺血再灌注损伤更严重的患者可能从 TTM 中获益更多。我们假设,以较高剂量肾上腺素为特征的更严重损伤患者可能从 TTM 中相对获益更多。当前研究的结果支持这种取决于肾上腺素剂量的 TTM 差异性效应的概念。
替代解释
我们的结果还有其他潜在的解释。如上所述,较高剂量的肾上腺素可能只是缺血负荷的标志物,因此这种相互作用真正反映了疾病严重程度越高的患者中 TTM 有益作用增加之间更普遍的相关性。肾上腺素剂量增加与估计的复苏持续时间延长相关,尽管针对停搏持续时间进行调整并未显著改变肾上腺素剂量、TTM 和结局之间的相关性([补充] 电子表 2)。或者,TTM 需要专门和长期的重症监护,通常会妨碍早期撤除支持或舒适护理,在受到最严重损害的患者中,这些努力可能尤其有益。因此,使用较高剂量肾上腺素观察到的 TTM 的相对神经功能良好生存和总生存获益可能确定该疾病最严重队列中综合重症监护的不同效应,而不是与减轻肾上腺素脑损伤相关的特定获益。
局限性
本研究存在一定的局限性。 本研究为观察性研究;因此,结果提供了相关性而非因果关系。此外,混杂因素可能导致观察到的相关性。例如,该研究缺乏有关心脏骤停前临床合并症的信息,患者是否经历心脏骤停,或与护理目标相关的决策和时间,可能与肾上腺素剂量相关的特征,TTM 的使用,以及存活的可能性。尽管 TTM 持续时间和程度的研究 [8]、[22] 尚未确定不同效应,但该研究无法评估可能具有治疗作用的 TTM 剂量(持续时间和温度)或模式。指南表明,复苏后仍昏迷的患者有资格接受 TTM。本研究排除了在 ED 被确定为清醒或有意识但无法应用更精细昏迷量表(如 Glasgow 昏迷评分)对昏迷进行分类的患者。该研究在一个相对高效的系统中进行,该系统中常见旁观者 CPR,EMS 反应相对快速,当前队列中肾上腺素的中位剂量为 2 mg,所有特征均可能影响普遍性。这些局限性应在研究强度背景下考虑:研究使用具有稳健的院前和医院协变量和结局指标的相对较大的队列评价了一个重要的临床问题。
结论
在从 OHCA 复苏的患者中,TTM 改变了肾上腺素的增加与良好神经功能存活之间的负相关性。TTM 的相对获益随着肾上腺素剂量的增加而增加,表明 TTM 可能有不同的作用,取决于在这种情况下的停搏期间的治疗(肾上腺素总剂量)。这种理解是否能够更好地指导治疗以改善生存率尚不确定,需要进一步研究。
References
Virani SS, Alonso A, Aparicio HJ, et al. Heart disease and stroke statistics–2021 update: a report from the American Heart Association. Circulation. 2021;143(8):e254-e743.
Yan S, Gan Y, Jiang N, et al. The global survival rate among adult out-of-hospital cardiac arrest patients who received cardiopulmonary resuscitation: a systematic review and meta-analysis. Crit Care. 2020;24(1):61.
Panchal AR, Berg KM, Hirsch KG, et al. 2019 American Heart Association focused update on advanced cardiovascular life support: use of advanced airways, vasopressors, and extracorporeal cardiopulmonary resuscitation during cardiac arrest: an update to the American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2019;140(24):e881-e894.
Perkins GD, Ji C, Deakin CD, et al; PARAMEDIC2 Collaborators. A randomized trial of epinephrine in out-of-hospital cardiac arrest. N Engl J Med. 2018;379(8):711-721.
Fries M, Weil MH, Chang YT, Castillo C, Tang W. Microcirculation during cardiac arrest and resuscitation. Crit Care Med. 2006;34(12)(suppl):S454-S457.
Ristagno G, Tang W, Huang L, et al. Epinephrine reduces cerebral perfusion during cardiopulmonary resuscitation. Crit Care Med. 2009;37(4):1408-1415.
Mavroudis CD, Ko TS, Morgan RW, et al. Epinephrine’s effects on cerebrovascular and systemic hemodynamics during cardiopulmonary resuscitation. Crit Care. 2020;24(1):583.
Shi X, Yu J, Pan Q, Lu Y, Li L, Cao H. Impact of total epinephrine dose on long term neurological outcome for cardiac arrest patients: a cohort study. Front Pharmacol. 2021;12:580234.
Weng Y, Sun S. Therapeutic hypothermia after cardiac arrest in adults: mechanism of neuroprotection, phases of hypothermia, and methods of cooling. Crit Care Clin. 2012;28(2):231-243.
Arrich J, Holzer M, Havel C, Müllner M, Herkner H. Hypothermia for neuroprotection in adults after cardiopulmonary resuscitation. Cochrane Database Syst Rev. 2012;82(9):CD004128.
Claxton A, Saha R. Targeted temperature management at 33°C versus 36°C after cardiac arrest. J Intensive Care Soc. 2014;15(2):171-172.
Lascarrou J-B, Merdji H, Le Gouge A, et al; CRICS-TRIGGERSEP Group. Targeted temperature management for cardiac arrest with nonshockable rhythm. N Engl J Med. 2019;381(24):2327-2337.
Dankiewicz J, Cronberg T, Lilja G, et al; TTM2 Trial Investigators. Hypothermia versus normothermia after out-of-hospital cardiac arrest. N Engl J Med. 2021;384(24):2283-2294.
Callaway CW, Coppler PJ, Faro J, et al. Association of initial illness severity and outcomes after cardiac arrest with targeted temperature management at 36 °C or 33 °C. JAMA Netw Open. 2020;3(7):e208215-e208215.
Nishikimi M, Ogura T, Nishida K, et al. Outcome related to level of targeted temperature management in postcardiac arrest syndrome of low, moderate, and high severities: a nationwide multicenter prospective registry. Crit Care Med. 2021;49(8):e741-e750.
Link MS, Berkow LC, Kudenchuk PJ, et al. Part 7: Adult Advanced Cardiovascular Life Support: 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2015;132(18)(suppl 2):S444-S464.
von Elm E, Altman DG, Egger M, Pocock SJ, Gøtzsche PC, Vandenbroucke JP; STROBE Initiative. The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: guidelines for reporting observational studies. Lancet. 2007;370(9596):1453-1457.
Perkins GD, Jacobs IG, Nadkarni VM, et al; Utstein Collaborators. Cardiac arrest and cardiopulmonary resuscitation outcome reports: update of the Utstein resuscitation registry templates for out-of-hospital cardiac arrest: a statement for healthcare professionals from a task force of the International Liaison Committee. Circulation. 2015;132(13):1286-1300.
Grossestreuer AV, Abella BS, Sheak KR, et al. Inter-rater reliability of post-arrest cerebral performance category (CPC) scores. Resuscitation. 2016;109:21-24.
Hsu CH, Li J, Cinousis MJ, et al. Cerebral performance category at hospital discharge predicts long-term survival of cardiac arrest survivors receiving targeted temperature management. Crit Care Med. 2014;42(12):2575-2581.
R Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing. 2020. Accessed June 30, 2022. [https://www.R-project.org/]
Hagihara A, Hasegawa M, Abe T, Nagata T, Wakata Y, Miyazaki S. Prehospital epinephrine use and survival among patients with out-of-hospital cardiac arrest. JAMA. 2012;307(11):1161-1168.
Sigal AP, Sandel KM, Buckler DG, Wasser T, Abella BS. Impact of adrenaline dose and timing on out-of-hospital cardiac arrest survival and neurological outcomes. Resuscitation. 2019;139:182-188.
