 新β-内酰胺酶抑制剂复合制剂
新β-内酰胺酶抑制剂复合制剂
# 新 β- 内酰胺酶抑制剂复合制剂
头孢洛扎 / 他唑巴坦(ceftolozane/tazobactam,FDA2014)、
头孢他啶 / 阿维巴坦(ceftazidime/avibactam,FDA2015)、
美罗培南 / 法硼巴坦(meropenem/vaborbactam,FDA2017)
亚胺培南(imipenem)/ 西司他丁(cilastatin)/relebactam(FDA2019)。
众所周知,感染性疾病是临床常见、常危及生命、涉及人体多个系统和几乎所有学科的疾病。正因如此,在临床感染性疾病诊治过程中,需要多个学科共同参与。中国医药教协会感染疾病专业委员会(IDSC)是国内首个专注于感染性疾病诊治和抗感染药物应用管理的感染疾病专业组织,成立 5 年以来,与美国感染病学会(IDSA)、欧洲临床微生和感染病学会(ESCMID)以及日本的有关学会交往密切,先后制定 3 部专家共识,包括《抗菌药物超说明书用法专家共识》、《感染相关生物标志物临床意义解读专家共》、《抗菌药物药代动力学 / 药效学(PK/PD)理论临床应用专家共识》,指导和规范临床抗感染诊疗工作。
为了帮助临床医生更好地做好感染性疾病诊治工作,《中国医学论坛报》与 IDSC 联合策划 IDSC 感染专栏,每 2 月一期,定期刊出感染性疾病领域最新进展相关内容,敬请关注。
多学科协作共同改善抗感染治疗的结局
感染性疾病常见于几乎所有的临床学科,其大多数是可以期望在短时间内彻底治愈的,但如治疗不当,甚至不够及时就会失去治愈机会而危及生命。就呼吸科而言,常见的慢性阻塞性肺疾病(COPD)、支气管哮喘、肺纤维化等,往往都无法彻底治愈,需要终身用药,唯有细菌性肺炎等感染是可以治愈的,所以也有人将不会治肺炎的呼吸科医生称为 “治不好病的医生”。实体器官、干细胞移植患者能否渡过感染这一 “生死关头”,也是决定预后的最重要因素之一,可见感染性疾病的诊治是临床各科重要的、永恒的关注焦点。
科学的抗感染治疗需要临床科室、微生物、临床药理等多方面密切合作。应此需要,5 年以前我们在中国医药教育协会下成立了中国感染病学会(IDSC)。IDSC 吸收了中国抗感染相关学科最有实践成就、最著名的专家,在国内外都产生了较大影响。
《中国医学论坛报》是在在国内医学界影响较大的著名报刊,我们十分高兴能有机会与《中国医学论坛报》合作,就感染这一重要内容辟出专栏,定期与读者讨论如何进一步改善中国患者抗感染治疗结局这一重要命题,希望能得到广大读者的关注,并不吝批评指正。
有临床应用前景的新抗菌药
解放军总医院 王睿
感染性疾病是严重危害人类健康的重大疾病,是多脏器功能衰竭等严重合并症和致死原因之一。据世界卫生组织(WHO)报道,感染性疾病导致患者死亡占全部疾病死因的 25% 以上,每年有约 1300 万儿童死于感染性疾病。而导致感染的致病菌耐药性问题已成为全球面临的严峻挑战。WHO 在 114 个成员国进行的细菌耐药性调查报告中提出警示,细菌对抗菌药物的耐药性已出现在世界每一个角落。然而,由于新抗菌药物研发难度较大,耗资、耗时,与其他药物(例如抗肿瘤药、抗高血压药、降糖药等)相比,适应证少、疗程短、利润低,上市后又可能出现严重不良反应或细菌迅速产生耐药等问题,药品生产厂家往往望而怯步,将可能导致个别耐药菌感染无药可医的严重局面。
针对细菌耐药问题,杭州 G20 国家首脑峰会公报(2016)指出,抗生素耐药性问题严重威胁公共健康、经济增长和全球经济稳定,强烈建议推动研发新抗菌药物。2018 年 WHO 发布了迫切需要研发的针对耐药菌的新抗菌药清单,特别强调了对多种抗菌药物耐药(MDR)的革兰阴性细菌的威胁性问题。美国等国家也相继制定了抗击耐药菌的国家行动计划,美国食品与药物管理局(FDA)对新抗菌药物研发提供了绿色审批通道。
由于以上政策的实施,使我们欣喜地看到,近年来在新抗菌药物研发方面已取得了较大进展。本文将介绍近年上市或进入研究阶段的有临床应用前景的新抗菌药,主要包括新的 β- 内酰胺酶抑制剂复合制剂、头孢菌素类、氨基糖苷类、四环素类、喹诺酮类、截短侧耳素类、恶唑烷酮类以及其他作用机制的新药等,其中也包括国内近年开发上市的有良好应用前景的新抗菌药。
新 β- 内酰胺酶抑制剂及其复合制剂
细菌产 β- 内酰胺酶是对 β- 内酰胺抗生素产生耐药的主要机制,尤其是逐年增多的碳青霉烯耐药的肠杆菌科细菌(CRE)、铜绿假单胞菌(CRPA)、鲍曼不动杆菌(CRAB)等,其主要耐药机制是产生各种碳青霉烯酶,例如 Ambler 分类中的 A 类 KPC 酶、B 类金属 β- 内酰胺酶(例如 NDM、IMP、VIM)或 D 类(OXA 型)等。而目前国内市场常用的 3 种 β- 内酰胺酶抑制剂,例如克拉维酸、舒巴坦和他唑巴坦对上述酶均无抑制效应,为此,研发新的 β- 内酰胺酶抑制剂及其复合制剂成为抗菌新药开发的重要方向之一。
01
FDA 已批准上市或处于临床研究阶段的新 β- 内酰胺酶抑制剂及其复合制剂
近 5 年来,FDA 已批准上市的新 β- 内酰胺酶抑制剂复合制剂有头孢洛扎 / 他唑巴坦(ceftolozane/tazobactam,FDA2014)、头孢他啶 / 阿维巴坦(ceftazidime/avibactam,FDA2015)、美罗培南 / 法硼巴坦(meropenem/vaborbactam,FDA2017)和亚胺培南(imipenem)/ 西司他丁(cilastatin)/relebactam(FDA2019)。
FDA 和欧洲药品管理局(EMA)批准头孢洛扎 / 他唑巴坦的临床适应证为复杂性腹腔感染(cIAI),复杂性尿路感染(cUTI)和医院获得性肺炎 / 机械通气相关肺炎(HAP/VAP)。前两种适应证推荐剂量用法为 1.5 g,q8h,静滴 1h;治疗 HAP/VAP 为 3 g,q8h。头孢他啶 / 阿维巴坦临床适应证为 cIAI、cUTI 和 HAP/VAP。推荐剂量为 2.5 g,q8h,静滴 2h。美罗培南 / 法硼巴坦的临床适应证为 cUTI、cIAI 和 HAP/VAP。推荐剂量为 4.0 g,q8h,静滴 3h。亚胺培南 / 西司他丁 /relebactam 的临床适应证为 cUTI、cIAI 和细菌性肺炎。推荐剂量用法为亚胺培南和西司他丁各 0.5 g, 加 0.25 g relebactam,q6h。
新旧 β- 内酰胺酶抑制剂及其抑酶谱比较见表 1。其中新抑制剂阿维巴坦(NXL104) 、法硼巴坦(RPX7009) 和 relebactam(MK7655)对超广谱 β- 内酰胺酶(ESBL)、KPC 酶等均有较强的抑制活性,但对 B 类金属酶无抑制作用。此外,阿维巴坦还具有抑制 AmpC 酶和 OXA 48 酶活性。
表 1 新旧 β- 内酰胺酶抑制剂及其抑酶谱比较
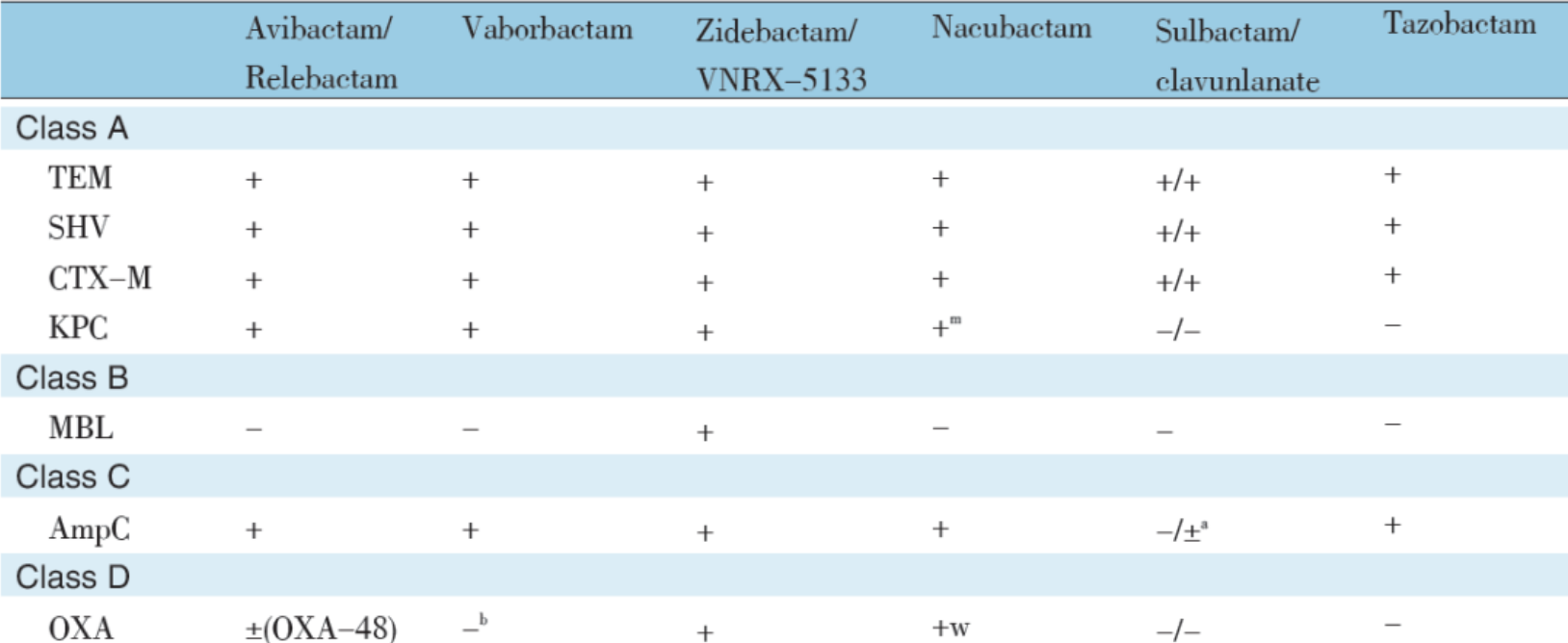
阿维巴坦属二氮杂二环辛烷(DBO)类非 β- 内酰胺结构的可逆性 β- 内酰胺酶抑制剂,具有更加广谱长效的 β- 内酰胺酶抑制作用。
Relebactam 也是一种非 β- 内酰胺 DBO 结构 β- 内酰胺酶抑制剂,与阿维巴坦结构相似,不同之处是在 2 - 位羰基上加入哌啶环。
法硼巴坦结构与阿维巴坦和 relebactam 不同,是环硼酸非 β- 内酰胺类,其硼原子模仿 β- 内酰胺环的羰基碳,与 β- 内酰胺酶中的丝氨酸残基结合形成共价键,也属于可逆的竞争性酶抑制剂。
阿维巴坦的另两种复合制剂氨曲南 / 阿维巴坦(aztreonam/avibactam)和头孢洛林 / 阿维巴坦(ceftaroline/avibactam) 正在进行 Ⅲ 期临床试验。其中氨曲南 / 阿维巴坦对 CRE 和 CRPA 有较强活性,且对 B 类金属酶比较稳定;头孢洛林 / 阿维巴坦除对 CRE 等有较强活性外,对耐甲氧西林金黄色葡萄球菌(MRSA)也有较强的抗菌活性,但对非发酵菌无效。
新 β- 内酰胺酶抑制剂 nacubactam(DBO 结构)也对 Ambler A 类(包括 ESBL、KPC)和 C 类 AmpC)及 D 类酶均显示了较强活性,其与多种抗菌药物如比阿培南(biapenem)、头孢吡肟(cefepime) 、哌拉西林(piperacillin)等组成复合制剂增强了抗菌作用,美罗培南 /nacubactam 在 Ⅰ 期临床研究中已显示很好结果,现正在进行治疗肺炎的临床试验。
02
处于早期研究阶段的新 β- 内酰胺酶抑制剂
针对十分棘手的细菌产 B 类金属酶问题,近年来研发了几类有希望的对 B 类金属酶有抑制作用的新 β- 内酰胺酶抑制剂,例如 zidebactam(DBO 结构)、taniborbactam、VNRX-5133(硼酸基结构) 、WCK -5153、GT-1-GT-055 等。相应的上述新 β- 内酰胺酶抑制剂复合制剂,例如头孢吡肟(cefepime)/zidebactam,头孢吡肟(cefepime)/VNRX-5133 和头孢吡肟(cefepime)-taniborbactam 正处于早期临床试验阶段。
还有几种新 β- 内酰胺酶抑制剂 ****WCK 4234,AAI101(β- 内酰胺架构),ETX0282, VNRX-7145,ETX2514 处于初始研发阶段。ETX2514 研究显示了不仅对 A 类(ESBL,KPC2)、C 类(AmpC)与 D 类(OXA10、23、24、48)β- 内酰胺酶有抑制作用,而且显示了对鲍曼不动杆菌、铜绿假单胞菌、大肠埃希菌的青霉素结合蛋白(PBP)1a、2、3 的亲和力较强。舒巴坦(sulbactam)本身就具有抗鲍曼不动杆菌活性,近年研发的舒巴坦 - ETK2514 对鲍曼不动杆菌作用显著增强,现处于 Ⅰ 期临床试验阶段。美罗培南 - WCK4234,头孢吡肟 - AAI101,头孢泊肟酯(cefpodoximeproxetil)-ETX0282,头孢布烯(ceftibuten)-VNRX-7145 等尚处于临床前研究阶段。
传统的三种 β- 内酰胺酶抑制剂克拉维酸、舒巴坦和他唑巴坦是不可逆酶抑制剂,目前研发了其与新头孢菌素类联合的复合制剂,例如他唑巴坦与新头孢类抗生素头孢洛扎(ceftolozane)的新复合制剂已于 2014 年在美国上市,对包括膜孔蛋白缺失、外排泵激活或产 Ambler A 类(ESBL)和 C 类(AmpC)而非产碳青霉烯酶耐药的多重耐药(MDR)铜绿假单胞菌、肠杆菌科细菌或脆弱拟杆菌等均有较强抗菌活性,其临床适应证为 cIAI、cUTI 和 HAP/VAP,前两种适应证用法是 1.5g,q 8h,静滴 > 1h;而治疗 HAP/VAP 为 3 g,q8h,静滴 > 1h。
头孢吡肟 - 他唑巴坦复合制剂目前处于临床试验阶段。头孢类抗生素头孢布烯(ceftibuten)与克拉维酸复合制剂也在临床前研究阶段。
其他结构新抗菌药
01
新头孢菌素类 —— 头孢地尔 Cefiderocol(s-649266)
Cefiderocol 是一种含铁载体(邻苯二酚部分)的头孢菌素类,可通过细菌铁转运系统,结合游离铁进入细菌细胞内,在细胞内铁被解离,药物与青霉素结合蛋白 3(PBP3)结合,破坏细菌细胞壁合成。该药不受细菌膜孔蛋白通道缺失与外排泵激活的影响。
Cefiderocol 对革兰阴性菌(肠杆菌科或非发酵菌)产生的 A、B、C 和 D 类酶均非常稳定,对 CRE、CRPA、CRAB 等 MDR 革兰阴性菌均有强效抗菌作用,只有多黏菌素、替加环素与 Cefiderocol 有相似的体外抗菌活性。但对缺乏铁调节外膜蛋白的铜绿假单胞菌体外活性降低。头孢地尔对 β- 内酰胺酶稳定性与新 β- 内酰胺酶抑制剂复合制剂抑酶谱比较见表 2。群体药代动力学研究表明,Cefiderocol 峰浓度可高达 > 75 μg/ml。在随机对照 Ⅲ 期临床试验中,对 MDR 革兰阴性菌所致成人严重感染 [HAP/VAP/ 医疗相关性肺炎(HCAP)、cUTI、血流感染(BSI)] 患者疗效良好,不良事件轻微。推荐剂量 2 g,q8h,静滴 3h。
表 2 新 β- 内酰胺酶抑制剂复合制剂与 cefiderocol 的抑酶谱与对 MDR 菌作用比较
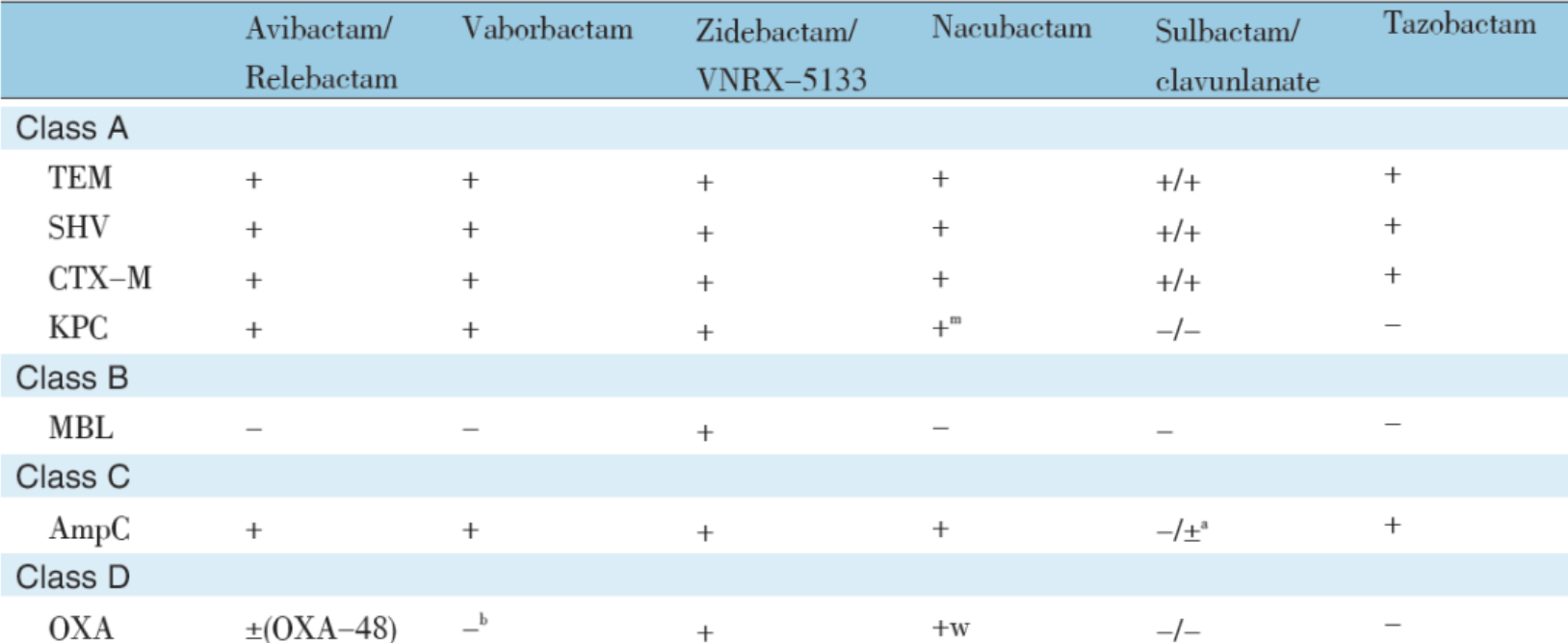
Cefiderocol 是一种非常值得期待的新一代头孢菌素类抗生素。
02
新四环素类
** 艾拉环素(eravacycline)** 是全合成氟环素类,结构类似替加环素,但因在 D 环 C-7 与 C-9 的特殊修饰,使其对革兰阳性耐药菌 [MRSA,耐万古霉素肠球菌(VRE)等] 和革兰阴性耐药菌(产 ESBL 或 KPC、B 类金属酶和 D 类酶的肠杆菌科细菌,鲍曼不动杆菌,嗜麦芽窄食单胞菌)等作用强于替加环素。与替加环素一样对铜绿假单胞菌和伯克霍尔德菌无效。有静脉和口服两种剂型,口服生物利用度为 > 90%,肺上皮细胞内液(ELF)浓度高于血浓度的 6~50 倍,对治疗肺部感染有一定优势。药物代谢动力学 / 药物效应动力学(PK/PD)的指数是药时曲线下面积(AUC)/ 最小抑菌浓度(MIC),主要排泄途径是经胆道从粪便中排出。FDA 2018 年已批准的主要适应证是 cIAI,1 mg/kg,q12h,静滴 60 分钟的方案。其他适应证 cUTI 和 HAP 尚处于 III 期临床试验阶段。常见不良反应是恶心呕吐等胃肠道反应、注射局部刺激症状,少见不良反应为肝功能不良、牙釉质发育不良、骨生长抑制等。
Omadacycline 是改良的二甲胺环素,与替加环素等甘酰胺环素相比,血浆蛋白结合率较低(20%~30%),诱发恶心呕吐的不良反应较小。对 MRSA、耐青霉素肺炎链球菌(PRSP)、VRE、产 ESBL 大肠埃希菌等肠杆菌科细菌(含 CRE)、鲍曼不动杆菌等有较好抗菌活性,但与替加环素一样对铜绿假单胞菌和变形杆菌属无效。FDA 2019 年批准的适应证是社区获得性肺炎(CAP)和复杂性皮肤与皮肤软组织感染(cSSSI),用法为第 1 天负荷剂量 200mg,qd,静滴 1h,维持剂量为 100 mg ,静滴 > 30 分钟,qd,序贯口服 300 mg ,qd,疗程 7~14 天。目前治疗 cUTI 的临床试验显示具有较好的疗效。对于肾功能不良患者和透析时不需要调整剂量。
03
新氨基糖苷类 —— 拉唑米星 plazomicin(AVHN490)
Plazomicin 是不受氨基糖苷修饰酶影响的西索霉素衍生物,对产生 A、B、C 或 D 类酶(NDM 除外)的革兰阴性菌(肠杆菌科或铜绿假单胞菌等)有效,对 MRSA 也有强大活性。对所有氨基糖苷类钝化酶稳定,但对氨基糖苷甲基化酶不稳定。
用法为每日 15 mg/kg,5 天后的最大血药浓度(Cmax)为 113 mg/L,AUC 0~24h 为 239 hr.mg/L,半衰期为 3h。疗程不超过 7 天。FDA 2018 年批准的适应证是 cUTI。在治疗 CRE 所致 HAP/VAP/cUTI/BSI 研究中,plazomicin 联合替加环素或美罗培南的疗效和安全性优于黏菌素(colistin)。
Plazomicin 的主要排泄途径是肾脏。主要不良反应包括肾毒性、耳毒性、神经肌肉接头阻滞作用等,表现为肾功能减退、头痛、恶心呕吐、腹泻和血压变化等。在临床应用时建议对存在肾功能不良的患者进行治疗药物监测(TDM)。
04
新喹诺酮类
** 非那沙星(finafloxacin)** 属于具有 C-7 独特取代基的氟喹诺酮类,目前静脉和口服制剂在开发中,生物利用度较高,半衰期为 10 h。对肺炎链球菌、金黄色葡萄球菌、幽门螺杆菌、产 ESBL 大肠埃希菌、肺炎克雷伯菌、变形杆菌属、普鲁威登菌属等肠杆菌科细菌、铜绿假单胞菌及厌氧菌有较强活性。对 MDR 鲍曼不动杆菌和嗜麦芽窄食单胞菌也有较强活性,尤其在弱酸性环境中(PH 5.8~6.2)对环丙沙星耐药的肠杆菌科细菌活性提高,适合皮肤、泌尿道、阴道等感染。与美罗培南、阿米卡星或多黏菌素联用对铜绿假单胞菌有协同效应。在治疗 cUTI 临床试验中,800 mg qd,5~10 天临床和微生物疗效达 70%,高于环丙沙星的 57%。FDA 2014 年批准的 finafloxacin 滴耳液临床适应证为金黄色葡萄球菌与敏感铜绿假单胞菌引起的急性外耳炎。
德拉沙星(delafloxacin) 是 C-7 和 C-8 有独特结构修饰的氟喹诺酮类,分子表面积增大,酸性环境利于跨膜渗透。有静脉和口服制剂,口服生物利用度 58%,静脉滴注 300 mg 与口服 450 mg 的全身暴露量相当。抗菌谱包括葡萄球菌属(包括 MRSA)、链球菌属、肠球菌属等革兰阳性菌,大肠埃希菌等肠杆菌科细菌,铜绿假单胞菌,厌氧菌等。是唯一对 MRSA 和铜绿假单胞菌均有活性的喹诺酮类。FDA 2017 年批准的适应证为急性细菌性皮肤和皮肤结构感染(ABSSSI),CAP 的临床试验在进行中。主要不良反应是胃肠道反应、神经系统反应、转氨酶升高等。
** 无氟喹诺酮类 —— 奈诺沙星(nemonoxaxin)** 是我国研发的具有结构特色的无氟喹诺酮类,1.1 类创新药。具有广谱抗菌活性,包括 MDR 革兰阳性菌、肠杆菌科细菌以及非典型病原体。对 CAP 常见致病源 PRSP、社区获得性耐甲氧西林金黄色葡萄球菌(CA-MRSA)、流感嗜血杆菌、卡他莫拉菌具较强抗菌活性,对大肠埃希菌等抗菌作用也增强,对左氧氟沙星、环丙沙星等氟喹诺酮类耐药肠杆菌科细菌仍有一定抗菌活性,对奴卡菌作用较强,对结核分枝杆菌无效。奈诺沙星口服吸收迅速,半衰期为 9~16h,蛋白结合率约为 16%,尿排泄率约为 45%。2014 年在我国台湾上市,2016 年国家食品药品监督管理总局(CFDA)批准口服治疗 CAP 在中国大陆上市。静脉剂型治疗成人 CAP 的 Ⅲ 期临床试验已完成申报,口服治疗糖尿病足感染的 Ⅱ 期临床试验也已完成,不良反应相对少见,上市后尚无关于对 QT 间期影响的报告。
05
截短侧耳素类 —— 利法呋林(lefamulin)
截短侧耳素是一类半合成的二萜类抗生素,自 20 世纪 50 年代以来在兽医学中已有广泛应用,作用机制是结合细菌 50S 核糖体,阻断 tRNA 肽转移,抑制细菌蛋白质合成。对革兰阳性菌作用较强,与其他抗菌药物没有交叉耐药性。lefamulin 是另一种新型截短侧耳素衍生物,对 CAP 常见致病菌例如肺炎链球菌、流感嗜血杆菌和卡他莫拉菌具有强效活性,已完成 CAP 的 Ⅲ 期临床试验,显示较好结果。研究还显示其对淋病奈瑟菌有效,包括 MDR 和泛耐药(XDR)菌株。PK/PD 指数是 AUC/MIC。用法是静滴 150 mg q12h,口服 600mg,q12h。
最近,有研究者在 C-12 上对截短侧耳素三环核心修饰,导致了新截短侧耳素衍生物扩展了抗菌谱,覆盖了肠杆菌科细菌,包括 CRE,正处于临床前评估阶段。
06
新恶唑烷酮类 ——tadizolid
Tadizolid 比较利奈唑胺有较大的优势,对甲氧西林耐药葡萄球菌属 [MRSA、耐甲氧西林表皮葡萄菌(MRSE)等]、VRE(包括利奈唑胺耐药菌株)、化脓性链球菌等抗菌活性比利奈唑胺增强,半衰期大于 10 h,口服生物利用度 > 90%,ELF 浓度相当于血浆浓度 20~40 倍,胃肠道反应、骨髓抑制作用和药物相互作用均比利奈唑胺降低。2014 年 FDA 和 EMA 批准的适应证是 ABSSSI。200 mg qd,7 天与利奈唑胺 600 mg q12h,10 天治疗 MDR 革兰阳性菌(尤其 MRSA)HAP/VAP 的随机对照 Ⅲ 期临床试验显示了较好的结果。
上述新药对 MDR 革兰阴性菌抗菌活性与适应证见表 3 和表 4。
表 3 非 β- 内酰胺类新药对 MDR - 革兰阴性菌抗菌活性
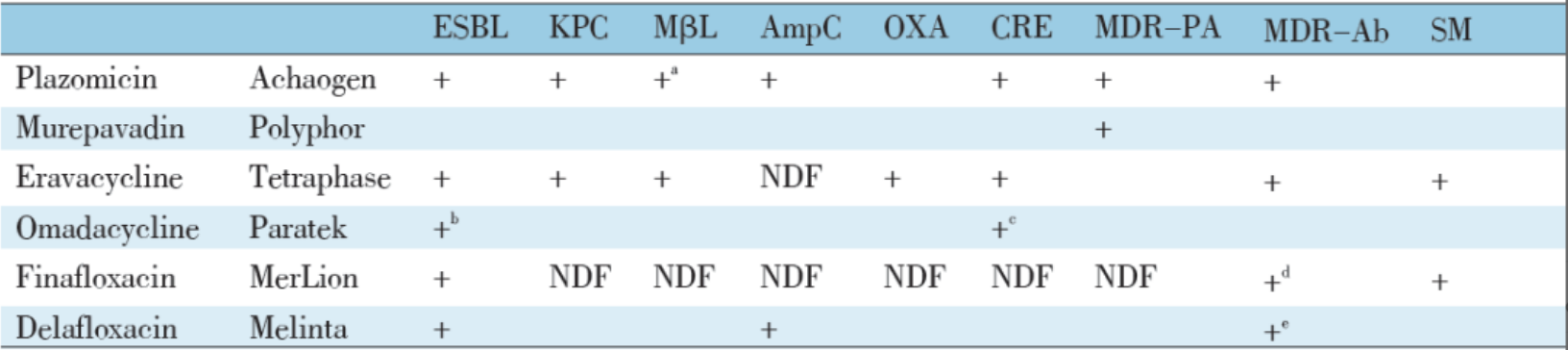

+:体外活性;a:对产 VIM 金属 β 内酰胺酶和酰亚胺酶细菌具抗菌活性,但对产新德里金属酶(NDM)细菌不具抗菌活性;b: 限于产 ESBL 大肠埃希菌菌落;c:药物公司仅追求对于大肠埃希菌的适应证;d:对耐环丙沙星菌株存在增强抗菌活性;e:对碳青霉烯不易感菌落有中等强度抗菌活性
表 4 近年研发新药对 MDR - 革兰阴性菌感染临床适应证
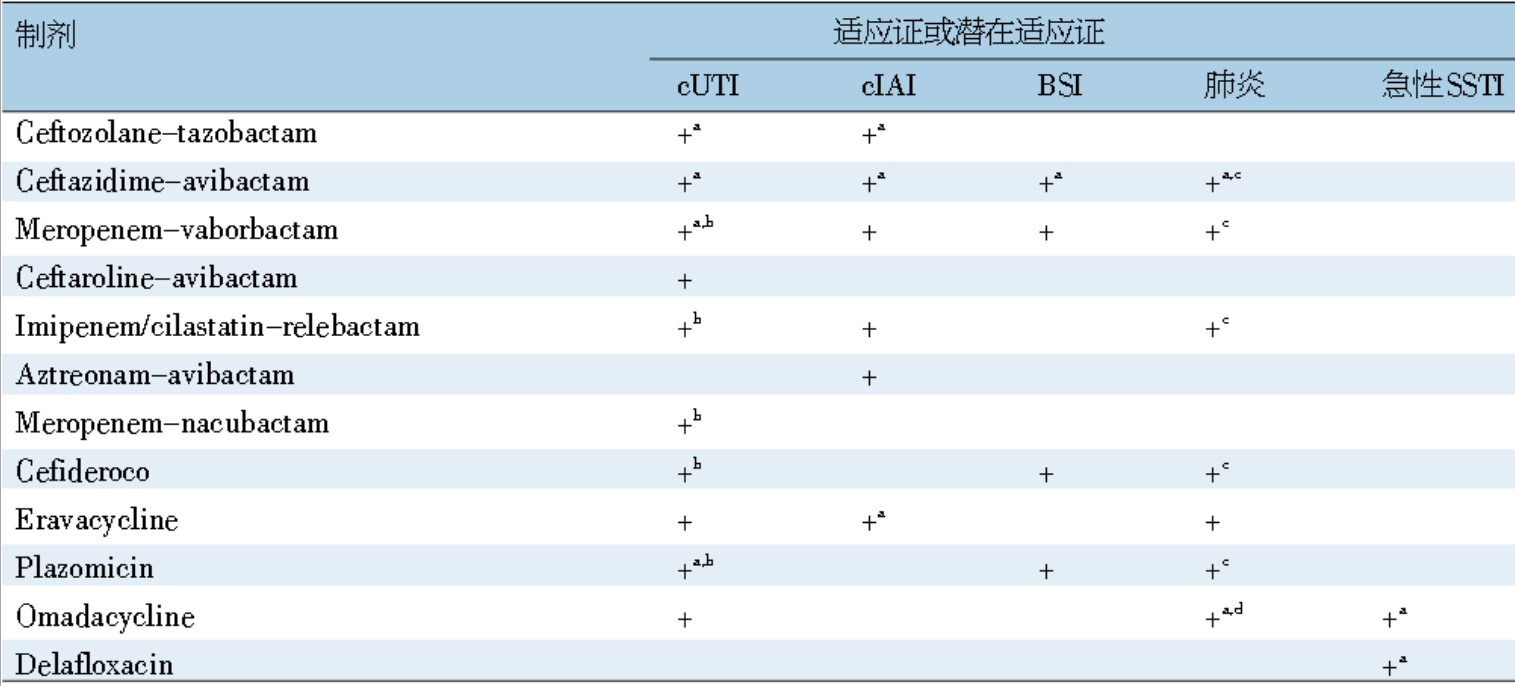
SSTI:皮肤及皮肤软组织感染
+:临床治疗中的适应证或潜在适应证;a:获得 FDA 批准;b:包括急性肾盂肾炎;c:医院获得性肺炎 / 机械通气相关肺炎
07
其他作用机制独特的抗菌新药
Murepavadin 是瑞士奥尔施威尔研发的一种 14 - 氨基酸环肽类药物,特异性作用于脂多糖转运的外膜蛋白,对 MDR 铜绿假单胞菌高度特异有效,对 CRE 有较强活性。在 ELF 中浓度较高。在治疗铜绿假单胞菌所致 HAP/VAP 的 Ⅲ 期临床试验中显示了所期待的疗效,肾毒性较小。
Arylomycin 通过抑制 I 型信号肽酶,导致细菌蛋白质分泌途径的通量不足,必须的蛋白质错误定位。其独特的抗菌机制使其具有巨大的抗耐药菌潜能。
小 结
综上介绍了国内外近 5 年已上市或正在研发的抗菌新药,主要集中在解决 MDR 革兰阴性菌产酶耐药问题,尤其是针对产 KPC、OXA 酶问题开发了一系列新 β- 内酰胺酶抑制剂及其复合制剂。在对 B 类金属酶抑制剂方面也有了新的突破,研发了几种有希望的新 β- 内酰胺酶抑制剂及其复合制剂,正在进行临床试验阶段。含铁载体的新头孢菌素 cefiderocol 有独特的作用机制,与其他头孢菌素类相比有重大创新,对革兰阴性菌(肠杆菌科或非发酵菌)产生的 A、B、C 和 D 类酶均有良好的抑制作用,故对 CRE、CRPA、CRAB 等革兰阴性菌均有强效抗菌作用。其他氨基糖苷类、四环素类、喹诺酮类、截短侧耳素类、恶唑烷酮类等新品种与已上市品种比较,扩大了抗菌谱,或增强了抗菌活性。新作用机制的抗菌新药开发有望克服对现有药物的交叉耐药。
总之,上述有应用前景的新药将为我们治疗多重耐药菌感染带来希望,值得临床医生关注。
