 多重耐药和广泛耐药铜绿假单胞菌感染的流行病学与治疗
多重耐药和广泛耐药铜绿假单胞菌感染的流行病学与治疗
# 多重耐药和广泛耐药铜绿假单胞菌感染的流行病学与治疗
Atman 机器翻译,人工粗校Horcajada JP, Montero M, Oliver A, et al. Epidemiology and Treatment of Multidrug-Resistant and Extensively Drug-Resistant Pseudomonas aeruginosa Infections. Clin Microbiol Rev. 2019;32(4):e00031-19. Published 2019 Aug 28. doi:10.1128/CMR.00031-19
# 摘要
近年来,所谓的多重耐药或广泛耐药 (MDR/XDR) 铜绿假单胞菌高危克隆在全球范围内的传播已成为一种公共卫生威胁。本文综述了它们的耐药机制、流行病学和临床影响以及当前和即将到来的治疗选择。讨论了体外和体内治疗研究以及药代动力学和药效学 (PK/PD) 模型。多粘菌素是一种重要的治疗选择,概述了剂量、药代动力学和药效学及其对 MDR/XDR 铜绿假单胞菌感染的临床疗效。还对它们较窄的治疗窗和联合治疗的潜力进行了讨论。其他抗菌药物 “老药”,例如某些 β- 内酰胺类、氨基糖苷类和磷霉素,在此综述。此外,还对新的抗假单胞菌药物以及在研药物进行了综述。头孢洛扎 - 他唑巴坦对相当比例的 MDR/XDR 铜绿假单胞菌菌株具有临床活性,描述了其微生物学和临床数据,以及改善其对这些细菌使用的建议,头孢他定 - 阿维巴坦也是如此,其对 MDR/XDR 铜绿假单胞菌具有更好的活性,尤其是具有某些特定耐药机制的菌株。本节专门讨论即将上市的活性药物,如亚胺培南 - 瑞来巴坦(雷利巴坦)、头孢吡肟 - 齐德巴坦坦(zidebactam)、头孢地尔和 murepavadin。最后,其他治疗策略,如使用疫苗、抗体、细菌素、群体感应抑制和噬菌体,为未来的选择。
关键词: 铜绿假单胞菌
# 引言
多重耐药 (MDR) 和广泛耐药 (XDR) 铜绿假单胞菌菌株的出现和传播最近已成为公共卫生问题的几个主要原因。首先,铜绿假单胞菌会引起严重感染,尤其是在医疗保健环境和免疫功能低下患者中。其次,它具有卓越的被选中和在体内传播抗生素耐药性的能力 ([1],[2])。第三,所谓的铜绿假单胞菌 “高危” 克隆株在全球范围内的成功传播对全球公共卫生构成了威胁,亟待研究和管理,亟待决断 ([3])。
缺乏替代疗法意味着这些抗生素耐药细菌引起的感染对全球发病率和死亡率构成了相当大的威胁。治疗不充分对这些感染的影响显著;事实上,世界卫生组织在 2017 年报告称,碳青霉烯类耐药铜绿假单胞菌被列入 “关键” 组,急需新的抗生素 ([4])。
近年来,MDR 和 XDR 铜绿假单胞菌菌株的流行率不断增加,在一些地区的流行率在 15% 至 30% 之间 ([5]-[7])。欧洲大多数国家报告,所有接受监测的抗菌药物组的耐药率均超过 10%([8])。联合耐药在铜绿假单胞菌中也很常见。2015 年,欧洲疾病预防和控制中心指出,13.7% 的铜绿假单胞菌分离株对至少 3 个抗生素组耐药,5.5% 对监测的所有 5 个抗生素组耐药 (EARS-Net)([8])。根据来自美国的数据,MDR 铜绿假单胞菌是 13% 重度医疗保健相关感染的原因 ([9])。
解决这一危机的方法是将更多的资源用于基础和临床研究以及感染控制和抗菌药物管理,开发新的抗菌药物,并优化现有药物的使用。本文综述了铜绿假单胞菌多重耐药性的当前定义、机制以及全球传播的高危克隆的流行病学。根据现有信息,对当前和即将到来的治疗选择进行了回顾,包括临床研究和体外和动物研究(缺乏这些治疗选择)。应该注意的是,大多数临床研究都有方法学局限性,难以解释证据。
# 铜绿假单胞菌耐药机制概述
# 内源性铜绿假单胞菌耐药性(内源性耐药菌)
铜绿假单胞菌具有一系列显著的抗生素耐药机制,包括多个染色体决定因素以及参与固有和适应性耐药的复杂调节通路 ([1],[2],[10]-[13])。与其他革兰氏阴性微生物相比,认为对铜绿假单胞菌较低的自然敏感性影响最大的机制是诱导性 AmpC 头孢菌素酶表达、组成性 (MexAB-OprM) 和诱导性 (MexXY) 外排泵产生以及外膜通透性较低。由于氨基青霉素和许多头孢菌素(尤其是头孢西丁)是表达的强诱导剂,也可被 AmpC 高效水解,诱导型 β- 内酰胺酶的产生在铜绿假单胞菌对这些药物的天然耐药性中具有关键作用。诱导性 AmpC 表达在铜绿假单胞菌对亚胺培南天然敏感性降低中起决定性作用,因为该抗生素的水解稳定性在一定程度上受其高诱导剂效力的影响。
另外两种染色体 β- 内酰胺酶,OXA 酶 OXA-50/PoxB([14],[15]) 和最近描述的亚胺培南酶 (PA5542)([16]),也可能对内在 β- 内酰胺类敏感性水平产生影响,尽管它们在内在和 / 或获得性耐药中的作用需要进一步阐明。MexAB-OprM 外排泵的组成性表达在对绝大多数 β- 内酰胺(亚胺培南除外)和氟喹诺酮类的敏感性较低的基础水平中起主要作用,而 MexXY 的诱导产生对氨基糖苷类内在的低水平耐药性有主要影响 ([17])。除了这些众所周知的耐药决定因素,对全基因组筛选得到的突变文库进行分析发现了大量基因,被统称为内在耐药组,它们对抗生素敏感性有影响 ([2],[16],[18],[19])。
# 通过染色体基因突变(突变抵抗体)获得耐药性
除了大量的内在耐药菌外,铜绿假单胞菌通过获得染色体突变,显示出对所有可用抗生素产生进一步抗生素耐药性的显著能力。[表 1] 总结了已知增加耐药水平从而形成铜绿假单胞菌突变耐药组的主要基因 ([3])。
# 表 1
涉及铜绿假单胞菌抗生素突变耐药的主要基因。
| 基因 | 耐药机制 | 受影响的抗生素 |
|---|---|---|
| gyrA | 喹诺酮靶点修饰(DNA 旋转酶) | 氟喹诺酮类 |
| gyrB | 喹诺酮靶点修饰(DNA 旋转酶) | 氟喹诺酮类 |
| parC | 喹诺酮靶点修饰(DNA 拓扑异构酶 IV) | 氟喹诺酮类 |
| parE | 喹诺酮靶点修饰(DNA 拓扑异构酶 IV) | 氟喹诺酮类 |
| pmrA,pmrB,phoQ, cprS,colR,colS | 脂多糖修饰(脂质 A 部分添加 4 - 氨基 - 4 - 脱氧 - l - 阿拉伯糖模体) | 多粘菌素 |
| parR | 1. 脂多糖修饰(脂质 A 部分添加 4 - 氨基 - 4 - 脱氧 - l - 阿拉伯糖模体) 2.OprD 下调 3.MexEF-OprN 过量产生 4.MexXY 过量生成 | 1. 多粘菌素 2. 亚胺培南,美罗培南 3. 氟喹诺酮类 4. 喹诺酮类、氨基糖苷类、头孢吡肟 |
| parS | 脂多糖修饰(脂质 A 部分添加 4 - 氨基 - 4 - 脱氧 - 1 - 阿拉伯糖模体) OprD 下调 MexEF-OprN 过量生成 MexXY 过量生成 | 多粘菌素 亚胺培南,美罗培南 氟喹诺酮类 氟喹诺酮类、氨基糖苷类、头孢吡肟 |
| mexR,nalC,nalD | MexAB-OprM 过量生成 | 氟喹诺酮类、头孢他定、头孢吡肟、哌拉西林 - 他唑巴坦、美罗培南、头孢他定 - 阿维巴坦 |
| nfxB | MexCD-OprJ 过量生成 | 氟喹诺酮类、头孢吡肟 |
| mexS | MexEF-OprN 过量生成 OprD 下调 | 氟喹诺酮类 亚胺培南,美罗培南 |
| cmrA,mvaT,PA3271 | MexEF-OprN 过量生成 | 氟喹诺酮类 |
| mexZ,PA5471.1,amgS | MexXY 过量生成 | 氟喹诺酮类、氨基糖苷类、头孢吡肟 |
| OprD | OprD 蛋白失活 | 亚胺培南,美罗培南 |
| ampC | AmpC 结构修饰 | 头孢洛扎 - 他唑巴坦、头孢他定 - 阿维巴坦 |
| ampD,ampDh2,ampDh3, ampR,dacB,mpl | AmpC 过量生成 | 头孢他定、头孢吡肟、哌拉西林 - 他唑巴坦 |
| ftsI | β- 内酰胺靶点修饰 (PBP3) | 头孢他定、头孢吡肟、哌拉西林 - 他唑巴坦、头孢洛扎 - 他唑巴坦、头孢他定 - 阿维巴坦、美罗培南 |
| fusA1 | 氨基糖苷类靶点修饰(延伸因子 G) | 氨基糖苷类 |
| glpT | 转运蛋白 GlpT 失活 | 磷霉素 |
| rpoB | 利福平靶点修饰,RNA 聚合酶 β- 链 | 利福平 |
染色体 AmpC 头孢菌素酶(涉及广泛的基因,属于复杂的调节细胞壁再循环途径)的过度产生可能是最常见的突变驱动的 β- 内酰胺耐药机制。在超过 20% 的铜绿假单胞菌临床分离株中检出 ([13],[20],[21])。
已知 dacB(编码 PBP4)和 ampD(编码 N - 乙酰基胞壁酰 - l - 丙氨酸酰胺酶)的突变失活是 ampC 产生过多和 β- 内酰胺耐药最常见的机制 ([21],[22])。PBP4 失活也被证明能够激活 CreBC/BlrAB 双组分系统,进一步增加抗性水平 ([21])。还在临床菌株中检测到了导致转录调节因子 AmpR 构象修饰(调节 ampC 过表达和 β- 内酰胺耐药)的特异性突变。这些突变包括在铜绿假单胞菌以外的物种中记录的 D135N 和 R154H 突变,与流行性 MDR/XDR ST175 高危克隆相关 ([13])。已发现多种其他基因中的突变可上调 ampC,包括编码其他酰胺酶 (AmpDh2/AmpDh3)、其他青霉素结合蛋白(PBP5 或 PBP7)、溶解性转糖苷酶(MltB 和 SltB1)、MPL(UDP-N - 乙酰胞壁酸:l - 丙氨酰 -γ-d - 谷氨酰 - 内消旋 - 二氨基 - 亚胺酸连接酶)和 NuoN(NADH 脱氢酶 I 链 N)的基因。然而,仍需要进一步分析它们对天然菌株中 β- 内酰胺耐药性的影响 ([13])。
除了 AmpC 的大量产生,最近的研究已经强调了一个事实,即导致 AmpC 结构修饰的突变可能是 β- 内酰胺类耐药的原因,包括新型 β- 内酰胺 - β- 内酰胺酶抑制剂复方制剂头孢洛扎 - 他唑巴坦和头孢他定 - 阿维巴坦 ([23]-[26])。另一项研究在一小部分(约 1%)与头孢洛扎 - 他唑巴坦和头孢他定 - 阿维巴坦耐药相关的铜绿假单胞菌临床分离株中检测到 AmpC 中的几种氨基酸变异体 ([27])。迄今为止,已经报告了超过 300 种假单胞菌衍生的头孢菌素酶 (PDC) 变异体,其中一些变异体增加了对头孢洛扎 - 他唑巴坦和头孢他定 - 阿维巴坦的耐药性。
PDC 变体的更新数据库可从 Antonio Oliver 实验室获得,地址为 https://arpbigidisba.com (opens new window). 除了 β- 内酰胺酶,越来越多的证据表明 PBP 修饰在 β- 内酰胺耐药中的作用,尤其是 PBP3(由 ftsI 编码)突变。囊性纤维化 (CF) 患者 ([28],[29])、流行病菌株 ([30],[31]) 和体外研究 ([32],[33]) 的最新数据表明,PBP3 的特定突变在 β- 内酰胺耐药性的出现中发挥作用。最常报告的是 R504 C/R504H 和 F533L,位于 β- 内酰胺 - PBP3 灭活复合物稳定区域 ([34])。
碳青霉烯类特异性转运蛋白 OprD 的丢失可能是由于 OprD 基因失活突变 / 插入序列,或上调外排系统 MexEF-OprN 或 CzcCBA 的远程突变,同时下调 OprD 表达。OprD 孔蛋白的突变失活或下调(以及可诱导的 AmpC 产生)可驱动亚胺培南耐药和美罗培南敏感性降低。亚胺培南耐药率通常高于 20%,涉及的大部分分离株都是 OprD 缺陷型 ([20],[35])。OprD 失活经常与 AmpC 过表达协同作用,以驱动对所有经典抗假单胞菌 β- 内酰胺类的耐药性 ([36])。铜绿假单胞菌的四个主要外排泵之一的突变过表达也在突变驱动的耐药性中发挥重要作用 ([17],[20],[37],[38])。临床分离株中 MexAB-OprM 和 MexXY 的过表达很常见(10% 至 30%),而 MexCD-OprJ 和 MexEF-OprN 的过表达率相当低 (<5%)。MexAB-OprM 具有最宽的底物谱,突变驱动的这种外排泵的过度表达导致对氟喹诺酮类和所有 β- 内酰胺类(亚胺培南除外)的敏感性降低。
MexAB-OprM 过表达和 OprD 失活的联合作用是临床菌株对美罗培南耐药的主要原因之一 ([35])。除了其内在氨基糖苷类耐药中的作用,突变驱动的 MexXY 过度生成是临床菌株对头孢吡肟耐药的常见驱动因素 ([39])。MexCD-OprJ 或 MexEF-OprN 过量生成较少见,主要影响氟喹诺酮类药物,尽管驱动 MexEF-OprN 过量生成的突变 (mexT/mexS) 也决定了由于抑制 oprD 而对亚胺培南产生耐药性 ([40])。在慢性感染中特别普遍的 MexCD-OprJ 过表达也促使头孢吡肟 MIC 增加,尽管确定对几种 β- 内酰胺类和氨基糖苷类的敏感性增加 ([41])。
除了外排泵过度表达,铜绿假单胞菌氟喹诺酮类耐药经常来自 DNA 旋转酶(GyrA 和 GyrB)和 IV 型拓扑异构酶(ParC 和 ParE)的突变 ([42])。氟喹诺酮类耐药率因地区而异,但在多个国家超过 30-40%。最近的研究表明,除了 MexXY 过度表达和水平获得性机制(见下文),氨基糖苷类耐药可能是由 fusA1(编码延长因子 G)突变导致的,事实上,特异性 fusA1 突变已被证明在体外 ([43],[44]) 和临床菌株中产生氨基糖苷类耐药,尤其是 CF 患者 ([29],[44],[45])。还使用定点诱变证明了特异性 fusA1 突变在耐药性中的作用 ([46])。
最后,虽然粘菌素耐药率仍然相对较低 (<5%),但最近有所增长,可能是由于粘菌素作为治疗 MDR/XDR 菌株引起感染的最后手段药物使用增加。
加入 4 - 氨基 - 4 - 脱氧 - 1 - 阿拉伯糖后,脂多糖 (LPS) 的脂质 A 部分发生了修饰,从而经常产生粘菌素耐药性 ([47])。所涉及的突变通常与双组分调节系统 PmrAB 和 PhoPQ 相关联,从而导致 arnBCADTEFΜ 的激活。最近的研究表明,ParRS 双组分调节因子的突变不仅通过激活 arnBCADTEF 操作驱动粘菌素耐药,还通过 MexXY 的过表达和 OprD 的下调导致 MDR([12])。已知另外两种双组分调节因子(ColRS 和 CprRS)也与多粘菌素耐药性有关 ([48])。
# 水平获得性耐药机制(水平获得性耐药体)
除了相对常见的突变耐药性外,铜绿假单胞菌的可转移性耐药性是另一个日益受到关注的领域。事实上,在全球范围内,最麻烦的可转移 β- 内酰胺酶、超广谱 β- 内酰胺酶 (ESBLs) 和碳青霉烯酶(尤其是 B 类碳青霉烯酶,或金属 β- 内酰胺酶 [MBLs]) 的流行率正在增加,尽管分布不均匀,范围从低于 1% 至接近 50%,取决于医院和地域 ([49])。此外,在铜绿假单胞菌中检测可转移 β- 内酰胺酶的挑战可能意味着其患病率在几个领域被低估 ([50])。编码 ESBLs 和碳青霉烯酶的基因一般见于 1 类整合子以及氨基糖苷类耐药的决定因素。尽管越来越多的报告称共轭元件参与其中 ([51]-[54]),但这些整合子通常会插入位于细菌染色体上的可置换元件中。Potron 等最近对迄今为止在铜绿假单胞菌中检测到的可转移 β- 内酰胺酶进行了综述。([55]) 最常报告的铜绿假单胞菌中的 ESBLs 包括 D 类(如 OXA-2 或 OXA-10 变体)和 A 类(PER、VEB、GES、BEL 和 PME)。通常以肠杆菌(如 TEM、SHV 或 CTX-M β- 内酰胺酶)顺序记录的 A 类 ESBLs 很少见于铜绿假单胞菌。就碳青霉烯酶而言,MBLs 在铜绿假单胞菌中最普遍,VIM 和 IMP 类型最常见,地理分布最广。SPM MBL 在巴西流行,NDM、GIM 和 FIM 仅偶尔检测到。最后,全球范围内铜绿假单胞菌中 A 类碳青霉烯酶的流行率较低,但几个国家已检测到 GES 酶和 KPC 酶 ([54])。
可转移的氨基糖苷类耐药性最常由 1 类整合子编码的氨基糖苷类修饰酶驱动。铜绿假单胞菌中最常描述的是来自 AAC (3′)(庆大霉素)和 AAC (6′)(妥布霉素包括或不包括阿米卡星)基团的乙酰转移酶 ANT (2′)-I(庆大霉素和妥布霉素)([1])。尽管如此,对市场上所有氨基糖苷类(包括新型 plazomicin)产生耐药性的 16srrna 甲基转移酶(例如 Rmt 或 Arm)也代表了出现的主要威胁 ([55])。偶尔可检测到主要由 Qnr 决定因素(如 QnrVC1)驱动的可转移氟喹诺酮耐药性 ([56])。最近的一项研究也报告了明显由新型磷酸转移酶 CrpP 驱动的质粒介导的喹诺酮耐药的发生 ([57])。
已知新型复方制剂头孢洛扎 - 他唑巴坦和头孢他定 - 阿维巴坦对 AmpC 水解相对稳定 ([58],[59]),在头孢洛扎 - 他唑巴坦这取决于头孢洛扎对抗 AmpC 水解的稳定性,在头孢他定 - 阿维巴坦取决于阿维巴坦对 AmpC 的抑制活性。
但是,最近的体外和体内数据表明,对两种药物产生耐药性可能是突变导致 AmpC 酶过度生成和结构修饰的共同结果 ([23],[25]-[27])。现有的体外和体内数据也表明特异性 PBP3 突变可能会降低对两种联合的易感性。另一方面,不同外排泵的过表达对头孢他定 - 阿维巴坦敏感性的影响似乎大于对头孢洛扎 - 他唑巴坦的影响 ([27],[60])。
对于获得性 β- 内酰胺酶,头孢洛扎 - 他唑巴坦和头孢他定 - 阿维巴坦对产 MBL 菌株均无活性。但是,头孢他定 - 阿维巴坦(而非头孢洛扎 - 他唑巴坦)可能对产生 A 类碳青霉烯酶(如 GES 酶)的分离株具有抗菌活性 ([61])。同样,头孢洛扎 - 他唑巴坦和头孢他定 - 阿维巴坦对产 ESBL 铜绿假单胞菌分离株的活性不同,但通常对头孢他定 - 阿维巴坦有利。最后,水平获得性 OXA 型 β- 内酰胺酶的超广谱突变可能导致对两种药物均耐药 ([25],[62],[63])。
# 铜绿假单胞菌多重耐药的流行病学:定义和流行
在过去的几十年中,已经使用了 MDR 铜绿假单胞菌特征的各种定义,尽管目前可能最广泛使用的共识定义是 Magiorakos 等人 2012 年发表的定义 ([64])。多重耐药 (MDR) 定义为对至少 3 个抗生素类别中的至少一种药物不敏感(中介 + 耐药 [I + R]),广泛耐药 (XDR) 定义为对除 1 或 2 个抗生素类别外的所有类别中的至少一种药物不敏感,和泛耐药 (PDR),因为对所有类别的所有药物均不敏感。
建议进行以下分类和抗生素检测:抗假单胞菌头孢菌素(头孢他定和头孢吡肟)、抗假单胞菌青霉素加 β- 内酰胺酶抑制剂(替卡西林 - 克拉维酸和哌拉西林 - 他唑巴坦)、单环类(氨曲南)、抗假单胞菌碳青霉烯类(亚胺培南、美罗培南和多利培南)、氨基糖苷类(庆大霉素、妥布霉素、阿米卡星和奈替米星)、氟喹诺酮类(环丙沙星和左氧氟沙星)、膦酸(磷霉素)和多粘菌素(黏菌素和多粘菌素 B)。虽然这一提议肯定有助于协调铜绿假单胞菌耐药特征的定义,但仍需考虑其他几个方面。首先,即使使用单一定义,根据是否使用 EUCAST 或 CLSI 断点,结果也会有所不同。其次,由于其中一种药物(磷霉素)缺乏临床折点(CLSI 和 EUCAST),限制了拟定定义的综合应用。同样,直至 2019 年,氨曲南的 EUCAST 折点认为铜绿假单胞菌对该药物本质不敏感,因此不适用于基于获得性耐药的 MDR/XDR/PDR 定义。最后,目前的定义不考虑最近引入的抗假单胞菌药物,如头孢他定 - 阿维巴坦或头孢洛扎 - 他唑巴坦。
不考虑上述定义和相关机制的问题,全球范围内 MDR 铜绿假单胞菌的流行很可能正在增加,尽管存在重大的地理差异。在过去几十年中,MDR 铜绿假单胞菌的流行增加,目前在多个地区的发生率范围为 15-30%([5]-[7],[56])。此外,相当比例的 MDR 菌株也符合分类为 XDR 的标准,这进一步限制了可用的治疗选择。以近期(2017 年)一项西班牙大规模(51 家医院)多中心铜绿假单胞菌感染研究显示,26% 的分离株为 MDR,其中 65%(占所有分离株的 17%)的铜绿假单胞菌符合 XDR 的标准,大多数仅对粘菌素(包括阿米卡星或不包括阿米卡星)敏感 ([56])。事实上,在全球许多医院中,仅粘菌素敏感 (COS) 特征并不少见,并且已经明确存在泛耐药 ([65],[66])。然而,这些研究中大多数未考虑对新型抗假单胞菌药物头孢洛扎 - 他唑巴坦和头孢他定 - 阿维巴坦的耐药性。虽然对这些新治疗选择耐药的总体发生率低于 10%,但是根据获得性 β- 内酰胺酶(如 ESBLs 或碳青霉烯酶)的发生率,存在相当大的地理差异 ([31],[66]-[70])。
# 高危克隆的流行
对从医院获得性感染、CF 患者或环境中获得的铜绿假单胞菌分离株进行分子流行病学分析,通常显示出克隆多样性较高,大多数分离株与独特的基因型有关,但是,仔细观察表明,抗生素敏感分离株也是如此,但表现 MDR/XDR 表型的分离株并非如此。事实上,数十年来医院环境中有多起 MDR/XDR 菌株的流行爆发报告和警报。最近的研究提供了 MDR/XDR 全球克隆(称为 “高风险” 克隆)在全球多家医院播散的进一步证据 ([71])。近期综述了铜绿假单胞菌高风险克隆 ([3])。[图 1] 提供了最普遍的高危克隆的全球分布图,[表 2] 总结了其特征。
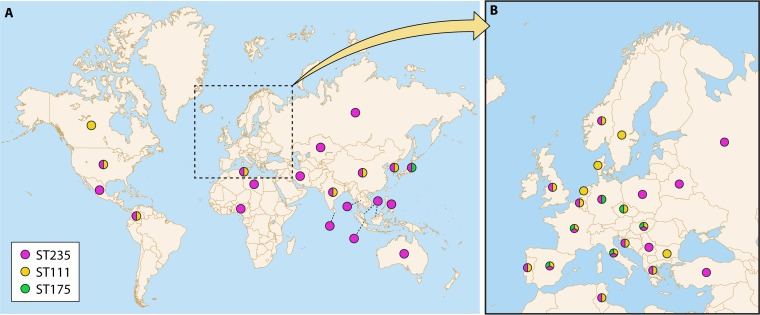
图 1. 基于已发表数据的 ST235、ST111 和 ST175 的全球分布 (A) 和欧洲分布 (B)。(经 Elsevier 许可后从参考文献 [3] 复制。)
# 表 2
全球 3 个主要铜绿假单胞菌高危克隆的特征
| 特征 | ST111 | ST175 | ST235 |
|---|---|---|---|
| O - 血清型抗原 | O12 | O4 | O11 |
| III 型分泌系统 | ExoS | ExoS | ExoU |
| 毒力 a | ++ | + | +++ |
| 全球分布 | ++ | + | +++ |
| 耐药传播 | ++ | + | +++ |
| 突变耐药 | ++ | +++ | ++ |
a 根据动物模型和临床经验的结果,在急性感染中产生更严重和 / 或更高死亡率的能力 ([5],[60],[65],[85],[86])。
关于高危克隆的流行率和影响,2008 年至 2009 年在西班牙进行的铜绿假单胞菌菌血症多中心研究显示,绝大多数敏感分离株由单基因型代表,但 MDR 尤其是 XDR 菌株的克隆多样性低得多 ([72],[73])。实际上 81 个 XDR 分离株中有 73 个 (90%) 只属于 3 个克隆,即主要国际 MDR/XDR 高危克隆:ST175([62])、ST111([9]) 和 ST235([5],[10])。在 7 年后进行的一项多中心研究中,ST175 仍是最常见的高危克隆(占 XDR 分离株的 68%)([31])。全球几项研究发现了相同的模式,大多数 MDR/XDR 分离株与这些和少数其他克隆相关联 ([74]-[78])。
毫无疑问,在三个主要的高危克隆中,与 O11 血清型相关的 ST235 最广泛,见于所有五个大陆的许多国家 ([3],[79])。ST111(血清型 O12)也在全球范围内分布,迄今为止,除大洋洲外,在每个大陆均有记录。最后,ST175(血清型 O4)在几个欧洲国家广泛分布。有趣的是,尽管敏感分离株的研究可能少于 MDR 分离株,但可用信息表明,这些克隆在敏感分离株中不常见。除了 3 个主要的高危克隆外,ST277 具有特殊意义,在巴西广泛传播 ([79])。ST244 在一些国家也经常检测到,但并不总是与 MDR/XDR 特征相关 ([72],[80])。其他最近报道的新出现的高危克隆包括 ST308 和 ST395([81],[82])。
高危克隆与水平获得性耐药机制之间的联系铺天盖地,大多数产 ESBL 或 MBL 铜绿假单胞菌分离株属于少数克隆,ST235 最频繁,其次是 ST111([3])。最近的一项基因组分析表明,DprA(参与可转化物种同源重组的决定因素)的 ST235 的特异性存在可能增加这种高风险克隆获得并维持外来抗性元件的能力,其速度高于其他铜绿假单胞菌克隆 ([79])。还报告了高风险克隆和突变驱动的耐药机制之间的显著关系。例如,ST175 克隆的 XDR 表型的机制是 AmpR (G154R)、OprD (Q142X) 和 MexZ (G195E) 特定突变和 3 喹诺酮耐药决定区 (QRDR) 突变的组合(GyrA T83I 和 D87N 以及 ParC S87W)([30]),ST175 克隆在西班牙和法国医院中广泛存在。全球大型 P 集合的耐药性分析。
铜绿假单胞菌菌株还表明,ST111 和 ST235 克隆中经常发生突变驱动机制;大部分都有 QRDR 突变(经常是 GyrA T83I 和 ParC S87L),经常表现出 oprD 突变 ([31],[83],[84])。
流行性高危克隆的致病性是另一个需要考虑的重大问题 ([85])。目前的证据表明,不同高危克隆之间的毒力不同。根据动物模型结果和临床经验 ([5],[61],[66],[86],[87]),我们认为毒力是在急性感染中产生更严重感染和 / 或更高死亡率的能力。这些研究特别表明,ExoU + ST235 高危克隆具有高度毒性,与极高的死亡率相关,而 ST175 的毒力似乎特别低。除了毒力,确定哪些因素驱动高危克隆的成功是另一个肯定需要澄清的主要问题。一项近期研究评价了可能与这些克隆成功相关的一组 8 个生物学特征 ([73])。令人惊讶的是,发现 3 个主要高危克隆(ST111、ST175 和 ST235)在 3 种类型的运动和色素(pyoverdine 和绿脓素)生成方面存在缺陷,并且还显示出体外适应性降低。另一方面,高风险克隆表现出自发突变频率增加和生物膜生长。其他近期研究表明,在高风险克隆中,生物膜形成增加,运动减少 ([88])。因此,为铜绿假单胞菌高风险克隆定义的这些生物学标记与通常由适应慢性感染导致的标记有相似之处 ([73])。然而,需要进一步的分析,包括全基因组测序 (WGS) 的信息 ([30],[31],[73],[84],[89],[90]),以便更全面地了解驱动高危克隆成功的因素。
# 多重耐药铜绿假单胞菌的临床影响
多重耐药的主要后果之一是难以选择适当的经验性抗生素治疗。MDR/XDR 病原体感染的患者接受不充分的初始抗菌治疗的风险增加 ([91],[92])。在铜绿假单胞菌血流感染患者中,延迟接受有效的抗生素治疗与较差的预后和较高的死亡率相关 ([93]-[96]),MDR/XDR 模式也与这些感染中经验性治疗不充分的可能性较高相关 ([97]-[100])。此外,用于治疗 MDR/XDR 感染的定向疗法通常是二线或三线抗菌药,因此疗效低于用于治疗敏感菌株引起的感染的疗法 ([85])。然而,多重耐药与临床预后之间的直接关系仍不明确 ([97],[101],[102])。虽然通常假设 MDR 细菌引起的感染与不良预后相关 ([94],[97],[103]-[105]),但感染预后不仅取决于接受充分抗菌治疗或使用次优直接治疗的延迟,还取决于宿主或病原体相关因素 ([5],[85],[98],[106],-[108]). 关于宿主,MDR/XDR 铜绿假单胞菌定植和感染通常发生在有多种基础疾病的患者中,这可能解释更差的预后 ([109],[110])。因此,这些患者的死亡可能是由于严重既存合并症所致 ([111],[112])。关于病原体,抗生素耐药性对铜绿假单胞菌毒力的生物学影响目前是一个热点 ([85],[86])。通常假设,获得耐药机制与适应性成本相关,导致 MDR/XDR 菌株的毒力降低 ([86],[113]-[117])。然而,也有报告称一些耐药突变与适合度成本无关 ([115],[118]),其他报告称 MDR 菌株将能够产生补偿性或抑制性突变,使其恢复初始适合度,从而最终不丧失毒力 ([113]-[115],[119])。如前所述,铜绿假单胞菌具有大量毒力因子 ([5],[85],[108],[120])。最重要的毒力决定因素之一是 III 型分泌系统 (TTSS)([5],[120]-[122]),它将效应细胞毒素(ExoS、ExoT、ExoU 和 / 或 ExoT)注入宿主细胞 ([5],[120],[122])。ExoU 是已确定的四种效应外毒素中最有效的一种,其表达与预后不良相关 ([5],[85],[120]-[123])。最近在铜绿假单胞菌菌血症患者中进行的一项临床研究表明,exoU + 基因型与早期死亡率增加相关,并表明它将是铜绿假单胞菌感染的一种有用的预后生物标志物 ([5])。除 TTSS 外,最近还描述了铜绿假单胞菌的其他毒力决定因素,如毒素 ExlA,其可诱导宿主细胞质膜破裂,导致细菌的毒力增加 ([108],[124])。HigB/HigA 毒素 / 抗毒素系统可能会影响铜绿假单胞菌的一些毒力因子,如绿脓菌素、群集和生物膜形成 ([125])。关于多重耐药对铜绿假单胞菌毒力的影响,Peña 等人 ([5]) 发现一些 TTSS 基因型和抗生素耐药模式之间存在相关性,MDR 菌株中 exoU + 基因型较少 ([5])。其他研究也表明 TTSS 与某些耐药特征相关 ([115],[122],[123])。exoU + 基因型仅存在于全球三个最普遍的高危克隆的 ST235 这一个中 ([5],[86])。如前所述,该高危克隆比其他流行克隆 ST175 和 ST111 更强 ([85],[86])([表 2])。但是,几项实验和临床研究表明 MDR/XDR 铜绿假单胞菌的毒力可能降低 ([5],[73],[86],[117],[126]-[129])。实验性体外研究表明,MDR 菌株的生长速率较低,并且在毒力决定因素(如细菌运动或色素生成)方面存在缺陷 ([73],[86],[117])。实验体内动物模型已证实 MDR/XDR 铜绿假单胞菌菌株产生感染、炎症反应和死亡的能力低于敏感菌株 ([86],[126],[127],[129])。临床研究也支持 MDR 铜绿假单胞菌菌株的毒力受损 ([5],[100],[107],[111],[130]),其中一些研究表明 MDR/XDR 菌株引起的感染与更高的死亡率无关,尽管他们更常通过延迟充分治疗进行管理 ([5],[98]-[100],[111],[114],[131])。考虑到这些研究,我们得出结论,XDR 菌株可能与适应性成本和毒力降低有关,但数据应谨慎解释,因为如上所述,至少一个国际 XDR 高危克隆菌株保持高毒力,而不考虑其耐药性特征。需要更多的研究来阐明这一点。
# 体外和体内治疗模型:抗生素联合方案
# 体外模型
已在几种体外模型中研究了药物与细菌之间的药效学相互作用。静态系统可用于快速测定时间 - 杀菌行为 ([132])。动态模型,如一室体外模型 (IVM) 和二室中空纤维感染模型 (HFIM) 提供了信息,允许开发改善治疗结果的给药方案 ([133])。两个系统均可开展剂量分割、抑制耐药突变、联合治疗和达到特定细菌杀灭量所需指数大小的研究 ([132])。与单室模型相比,中空纤维模型允许细菌负荷保持恒定,安全包含生物危害微生物,对吸收和消除曲线以及快速半衰期 (t1/2s) 建模 ([133])。
已经进行了体外研究,以寻找针对 MDR 或 XDR 铜绿假单胞菌的 “最佳治疗方案”。MDR/XDR 铜绿假单胞菌的联合抗生素治疗产生了兴趣,因为这些感染的潜在严重程度和单药治疗选择耐药的高风险。扩大覆盖范围、实现叠加或协同抗菌作用以及抑制新的耐药性的可能性均为支持联合治疗使用的因素 ([7])。
多项研究检查了各种抗假单胞菌抗生素(例如碳青霉烯类、多粘菌素 B、磷霉素、氨基糖苷类和喹诺酮类)之间的体外相互作用。目前已使用多种协同检测方法,包括微量稀释检测板技术、梯度扩散 (Etest)、时间 - 杀菌曲线分析 ([134],[135]) 和动态模型。报告的针对 MDR/XDR 铜绿假单胞菌的协同药物组合包括粘菌素 - 头孢他定 ([136])、粘菌素 - 利福平 ([137])、头孢吡肟 - 妥布霉素 ([138])、头孢他定 - 阿维巴坦 - 阿米卡星 ([139])、粘菌素 - 多利培南、亚胺培南和美罗培南 ([140],-[142])、美罗培南 - 左氧氟沙星 ([143])、亚胺培南 - 左氧氟沙星和粘菌素 - 左氧氟沙星 ([144])、美罗培南 - 环丙沙星 ([145])、多粘菌素 B - 恩诺沙星 ([146])、磷霉素 - 阿米卡星 ([147]),甚至一些双 β- 内酰胺复方制剂 ([148])。[表 3] 提供了针对 MDR/XDRP 的不同药物组合的研究列表,显示使用的体外研究模型,药物相互作用的类型,以及是否达到抑制耐药铜绿假单胞菌。然而,这些研究尚未为临床实践提出明确的建议,对于应使用哪种抗生素组合治疗这些难治感染,以改善治疗应答并减少耐药突变株的选择,缺乏共识 ([135])。
# 表 3
针对 MDR/XDR 铜绿假单胞菌联合治疗选择的体外和体内模型研究
| 联合用药(年,文献) | 铜绿假单胞菌类型 | 研究模型 a | 药物相互作用类型 | 抑制耐药 b |
|---|---|---|---|---|
| 头孢吡肟 - 氨曲南 (1998,[148]) | 菌株 164,包括野生型、部分去阻遏、和完全去阻遏表型 | HFIM | 协同作用 | — |
| 美罗培南 - 左氧氟沙星 (2010,[143]) | 野生型菌株 PAO1 和等位基因 MexAB-OprM 过表达菌株 | HFIM | 协同作用 | 是 |
| 粘菌素 - 多利培南 (2011 年,[140]) | 粘菌素 - 异种耐药参考菌株 (ATCC 27853) 和粘菌素 MDR 临床分离株 | IVM | 相加或协同 | 联合治疗后 ATCC 27853 粘菌素耐药亚群的出现减少和延迟 |
| 头孢吡肟 - 妥布霉素 (2012 年,[138]) | 野生型 PAO1 株及其等位基因 AmpC 持续去阻遏突变体 | HFIM | 相加 | 是 |
| 粘菌素 - 多利培南 (2014,[361]) | MDR | HFIM | 协同 | 是 |
| 亚胺培南 - 左氧氟沙星 粘菌素 - 左氧氟沙星 (2015,[144]) | MDR | IVM | 协同 | — |
| 粘菌素 - 美罗培南 (2016,[142]) | 野生型菌株 (ATCC 27853) 和美罗培南耐药菌株 (ARU552) | PK/PD 模型 | 协同 | 是 |
| 磷霉素 - 阿米卡星 (2017,[147]) | 菌株 PA SAT 290 | HFIM | 协同 | 是 |
| 头孢洛扎 - 他唑巴坦 - 美罗培南 (2018,[157]) | 菌株 ST175 | HFIM | 协同 | 是 |
| 头孢洛扎 - 他唑巴坦 - 黏菌素或 - 阿米卡星 (2018,[154]) | MDR | IVM | 协同 | 是 |
| 头孢洛扎 - 他唑巴坦 - 阿米卡星 (2018,[155]) | 5 个菌株,3 例 OprD 突变和 AmpC 过表达 | IVM | 相加 | 是 |
| 恩诺沙星 - 多粘菌素 B (2018,[16]) | 菌株 12196 | IVM 和 HFIM | 协同 | 是 |
| 美罗培南 - 妥布霉素 (2018,[362]) | PAO1 野生型毒株及其等基因高变 PAOΔmutS 株 | HFIM | 协同 | — |
| 头孢他定 - 阿维巴坦 - 阿米卡星 (2018,[139]) | 3 株碳青霉烯类耐药铜绿假单胞菌分离株,头孢他定 - 阿维巴坦 MIC 为 4/4-8/4 μg/mL,AMK-I MIC 为 8-64 μg/mL | Chemostat 模型 | 联合用药杀菌更快 | — |
| 美罗培南 - 环丙沙星 (2018,[145]) | 超突变 | HFIM | 高剂量下为协同 | 是 |
| 头孢洛扎 - 他唑巴坦 - 美罗培南以及头孢他定单独给药和与黏菌素联合给药 (连续输注) (2019,[151]) | MDR-HUB1 (头孢洛扎 - 他唑巴坦和美罗培南敏感),XDR-HUB2,(头孢洛扎 - 他唑巴坦敏感和美罗培南耐药),MDR-HUB3 (耐头孢洛扎 - 他唑巴坦和美罗培南敏感) | 生物膜的体外药效学模型 | 黏菌素联合头孢洛扎 - 他唑巴坦和联合美罗培南的组合分别是治疗 XDR 和 MDR 铜绿假单胞菌菌株引起的生物膜相关感染最合适的方法。 | 是 |
| 粘菌素 - 利福平 (2009,[158]) | MDR | AM | 协同 | 是 |
| 粘菌素 - 氨曲南 (2017,[159]) | MDR | AM | 协同 | 是 |
| 亚胺培南 - 妥布霉素 (2017,[238]) | MDR | AM | 协同 | 是 |
a IVM,体外一室模型;HFIM,中空纤维感染模型;AM,动物模型。
b —,未评价。
研发规划中缺乏抗假单胞菌药物使这种情况进一步复杂化 ([149]),尽管近年来在开发新分子和新的 β- 内酰胺酶抑制剂组合方面取得了一些进展 ([150],[151])。新型头孢菌素 ceftolozane(原名 CXA-101)([58]) 联合他唑巴坦治疗铜绿假单胞菌感染显示出良好的特征 ([152])。自 2010 年以来,已开展了许多关于头孢洛扎抗 MDR 和 XDR 铜绿假单胞菌作用的体外研究。VanScoy 等人 ([153]) 研究了头孢洛扎 - 他唑巴坦对 2 株铜绿假单胞菌分离株的影响:ATCC 菌株和临床分离株。针对野生型分离株(MIC 为 0.5 mg/L),任何剂量均未选择耐药;然而针对临床铜绿假单胞菌分离株(MIC 为 4 mg/L),虽然耐药受到每 8h 给予 2 g/1 g 头孢洛扎 - 他唑巴坦的抑制,但是在中等剂量方案中观察到耐药(125/62.5 至 1,000/500 mg)([153])。因此,对于一些 MDR/XDR 感染也开始研究联合治疗。最近的一些研究表明,头孢洛扎 - 他唑巴坦与黏菌素和阿米卡星联用时具有协同效应 ([154],-[156])。有趣的是,在中空纤维感染模型中,头孢洛扎 - 他唑巴坦加美罗培南的联合疗法对细胞杀伤具有协同效应,也阻止了对属于 ST175 克隆的 XDR 铜绿假单胞菌菌株的耐药性选择 ([157])。
需要临床试验来确认这些模型的结果,然而这些结果对于决定应该开发哪些试验非常有用。
# 体内模型
关于不同抗生素选择和组合对 MDR/XDR 铜绿假单胞菌的体内研究很少。在肺炎小鼠模型中,鼻内粘菌素联合利福平有利于协同抗菌活性 ([158])。在中性粒细胞减少小鼠大腿模型中,高剂量粘菌素对 MDR 铜绿假单胞菌感染的抗菌活性降低了 1.5 log10 CFU([159])。在同一项研究中,高剂量粘菌素与氨曲南联合用药效果更好,显示减少了 2.5 log10 CFU。Yadav 等人最近,优化的亚胺培南加妥布霉素联合方案显著增强了对 MDR 铜绿假单胞菌临床分离株的体内杀伤作用 ([160])。
# 目前可用的治疗 MDR 和 XDR 铜绿假单胞菌感染的抗生素
# 多粘菌素
细菌对抗生素的耐药性增加加上研发计划中新药的缺乏,已成为全球范围内一个重大的临床和公共卫生问题,在 MDR、XDR 和 PDR 铜绿假单胞菌的情况下尤其令人担忧 ([3],[4])。
虽然新型药物如头孢洛扎 - 他唑巴坦和头孢他定 - 阿维巴坦扩大了治疗领域 ([67],[157],[161]-[165]),但在某些情况下,多粘菌素仍然是唯一的治疗选择。
两种多粘菌素可用于临床:多粘菌素(多粘菌素 E)和多粘菌素 B,于 20 世纪 50 年代放行,未接受现代药物所需的相同药物开发程序和监管综述,因此,直至最近,我们对这两种多粘菌素的基础药理学了解才相对可靠 ([166]-[168])。然而,近年来出现了大量关于这些 “老药” 的临床前和临床数据 ([169]-[173])。多粘菌素的化学性质对其抗菌活性非常重要。多粘菌素带正电荷,使其能够与脂多糖 (LPS) 脂质 A 中带负电荷的磷酸基团相互作用 ([168])。多粘菌素还具有能够与 LPS 相互作用的疏水区 ([174])。这些相互作用的结果是破坏细菌细胞膜 ([174]-[176]),这是作用机制的第一步。然而,尚不清楚细菌细胞死亡的最终机制 ([168])。最近对铜绿假单胞菌进行的研究反对粘菌素通过在细胞质膜上打孔发挥杀菌作用的传统观点 ([177]-[179])。新的研究应该探索其他假设,例如细菌杀灭是由于外膜和细胞质膜之间的磷脂交换,抑制呼吸酶和 / 或形成活性氧 ([179])。
由于粘菌素和多粘菌素 B 仅相差肽环中的一个氨基酸 ([174]),它们具有相似的抗菌谱并不奇怪,主要针对革兰氏阴性杆菌 ([174])。
然而,尽管其化学结构相似,但在患者肠外给药时以不同形式使用。多粘菌素 B 作为活性抗生素直接给药,而粘菌素作为无活性前体药物甲磺酸粘菌素 (CMS) 给药 ([168],[176]),给药后必须转化为粘菌素 ([180])。一种或其他多粘菌素的使用因地域而异。在欧洲和澳大利亚,唯一可用的剂型是粘菌素(CMS 形式),而在美国、巴西、马来西亚和新加坡,临床医生可以使用粘菌素或多粘菌素 B 肠外制剂 ([168])。
静脉内粘菌素给药存在争议。最初,根据生产商的说明 ([181]-[183]),在诊所使用低剂量 CMS,但由于来自群体研究的最新药代动力学和药效学 (PK/PD) 数据,现在有可能提供推荐剂量的更新 ([171],[172],[184],[185])。尽管一些临床研究评价了肠外粘菌素在 900 万 IU 负荷剂量后较高剂量给药的疗效(4.5 IU,每 12h 给药一次【注:或许是 450 万 U】)([186],[187]),但是尚没有按照公式( Garonzik et al.([170]) 提出,Nation et al.([171],[172]) 于 2016 年更新)用药的患者临床预后数据。为了将 PK/PD 知识转化为临床实践,Sorlíet al. 在 91 例 MDR/XDR 铜绿假单胞菌引起的感染患者中研究了粘菌素血浆浓度对临床预后的影响 ([188])。该队列患者的平均粘菌素血浆浓度为 1.67±1.42 mg/L,低于其他研究和近期多粘菌素使用指南中提出的浓度 ([170]-[172],[185])。尽管如此,79.9% 的患者达到临床治愈,未观察到粘菌素血浆浓度在统计学上与临床治愈相关 ([188])。同一组研究证实,高血浆粘菌素浓度是肾毒性的独立风险因素 ([183],[189])。总之,尽管 PK/PD 研究已经得出结论,应该使用更高剂量的粘菌素,但是缺乏根据最近的建议治疗的患者预后的临床研究 ([171],[172],[185])。在尿路感染的情况下,粘菌素是一个很好的选择,因为尿液中形成的粘菌素浓度很高 ([185])。此外,也因此,在尿路感染中,粘菌素剂量可能低于其他侵袭性感染 ([190])。但是,尚无临床数据证实该选择。
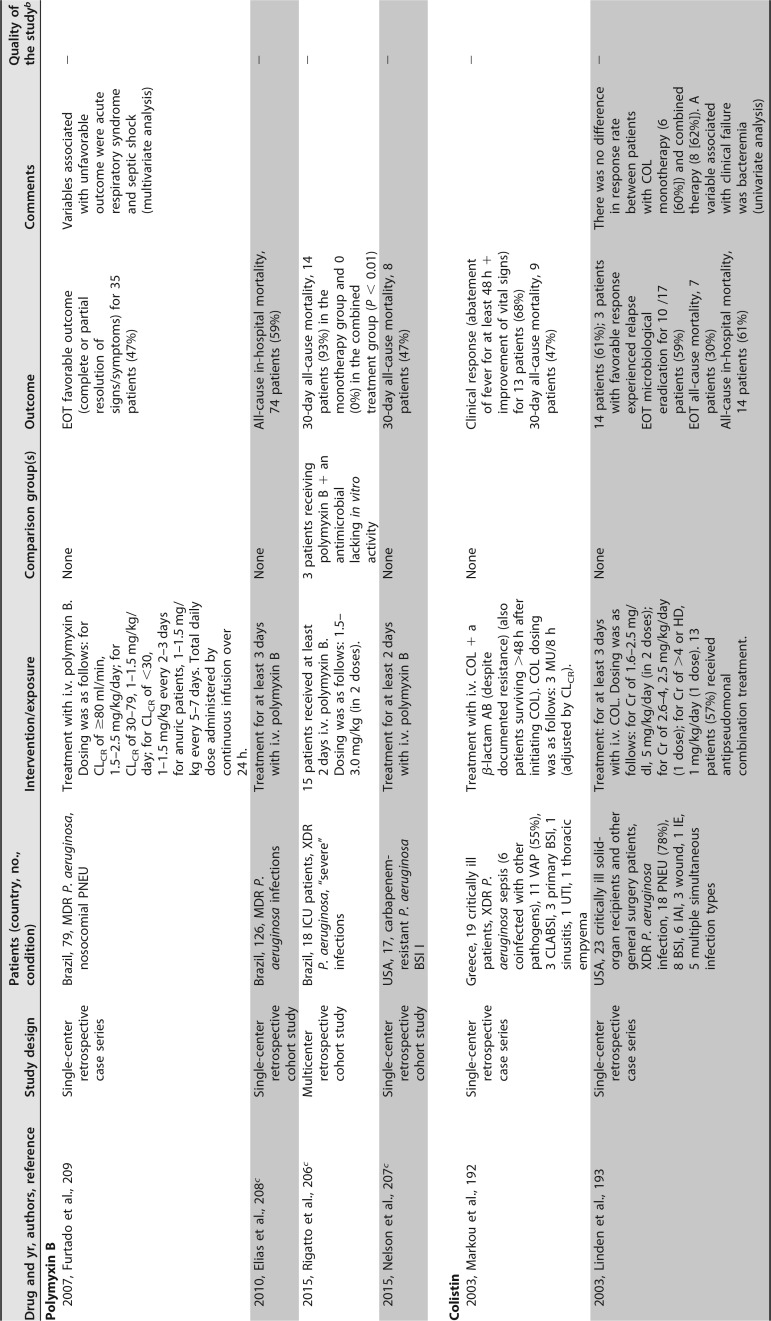
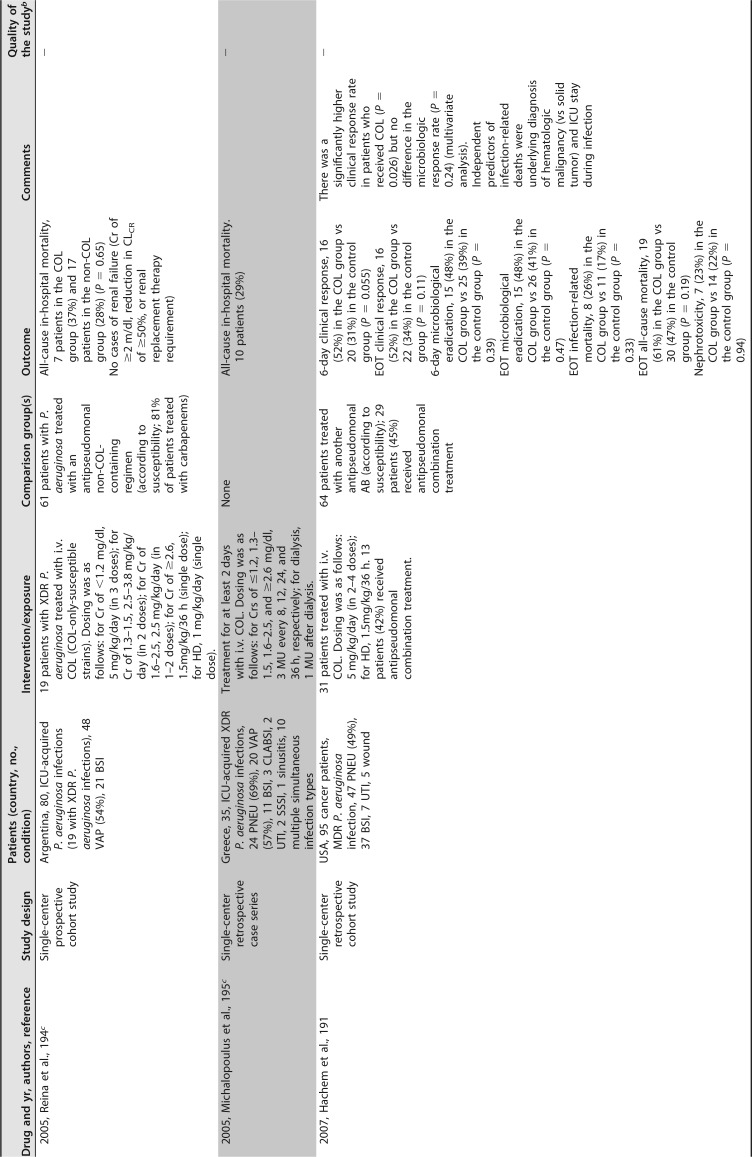
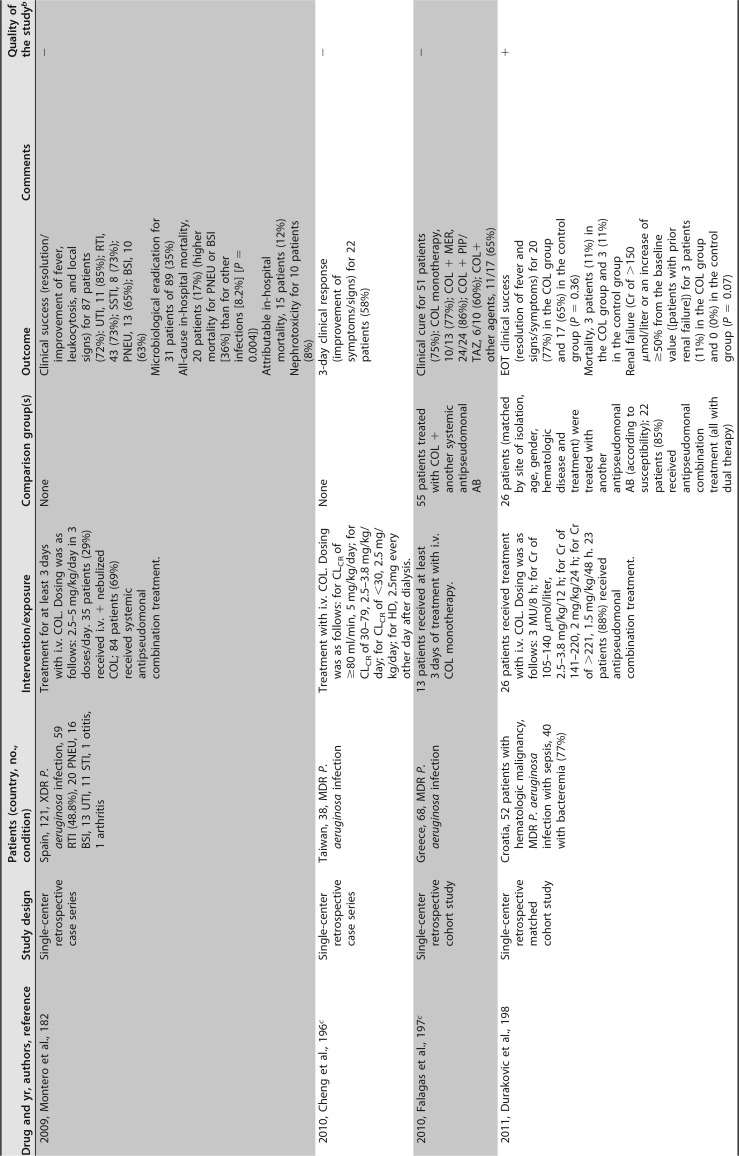
已发表的几项临床研究关注粘菌素治疗 MDR/XDR 铜绿假单胞菌感染。大多数是单中心回顾性序列研究,患者数量较少,除了包括超过 100 例患者 ([182],[183]) 和患者特征非常不同(重症监护室 [ICU],癌症,血液学,肺病学等)的两个例外。最常见的传染源是下呼吸道感染。粘菌素剂量可变,并根据肾功能进行了调整。在这些序列中,51% 至 100% 的患者接受了联合治疗。不同时间点的临床应答不同,范围是 52% 至 79%,其中一半的研究高于 70%。死亡率(不同时间点)为 11%-61%。这些研究中未提供有关耐药性选择的信息 ([181],[182],[188],[191]-[201])([表 4])。
# 表 4
提供 MDR/XDRP 感染预后信息的临床研究。
铜绿假单胞菌接受全身抗菌治疗 a
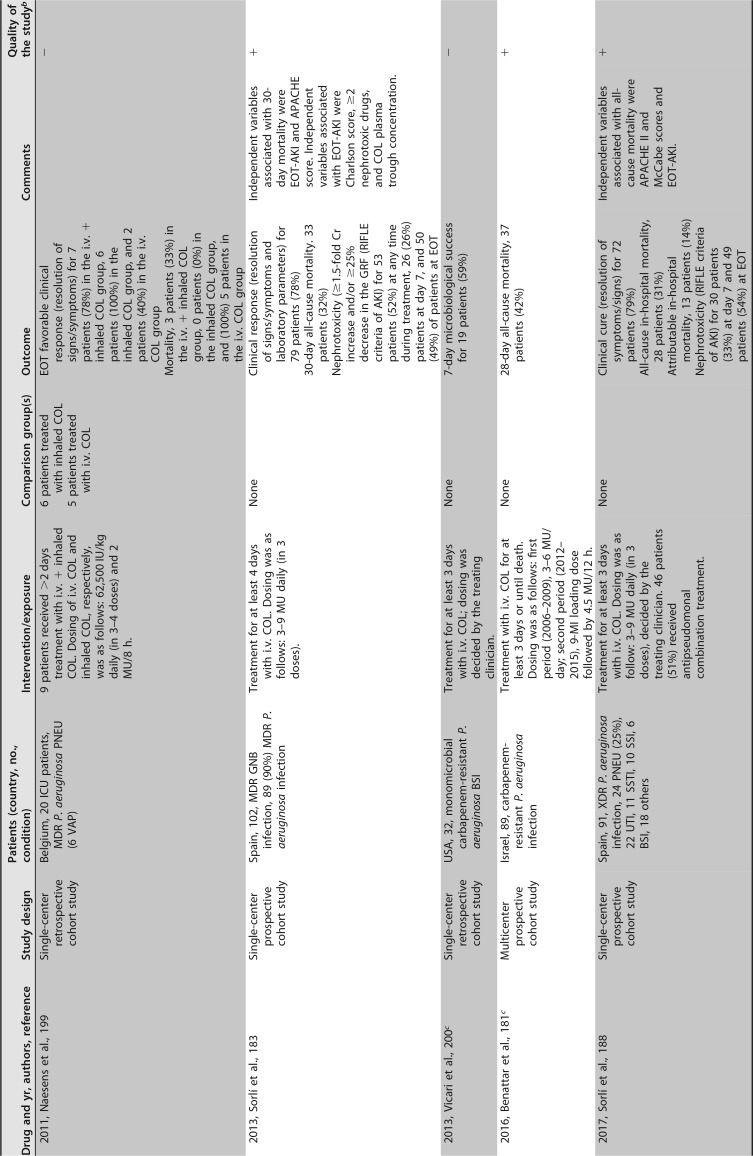

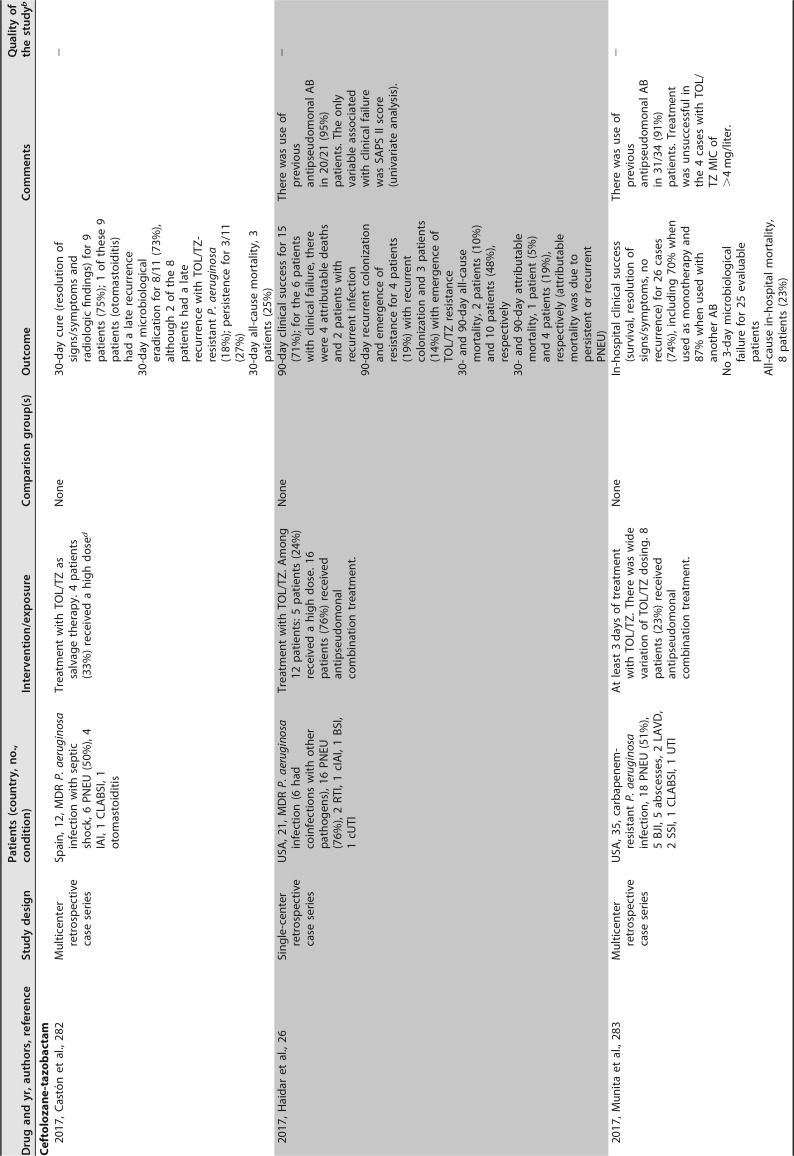
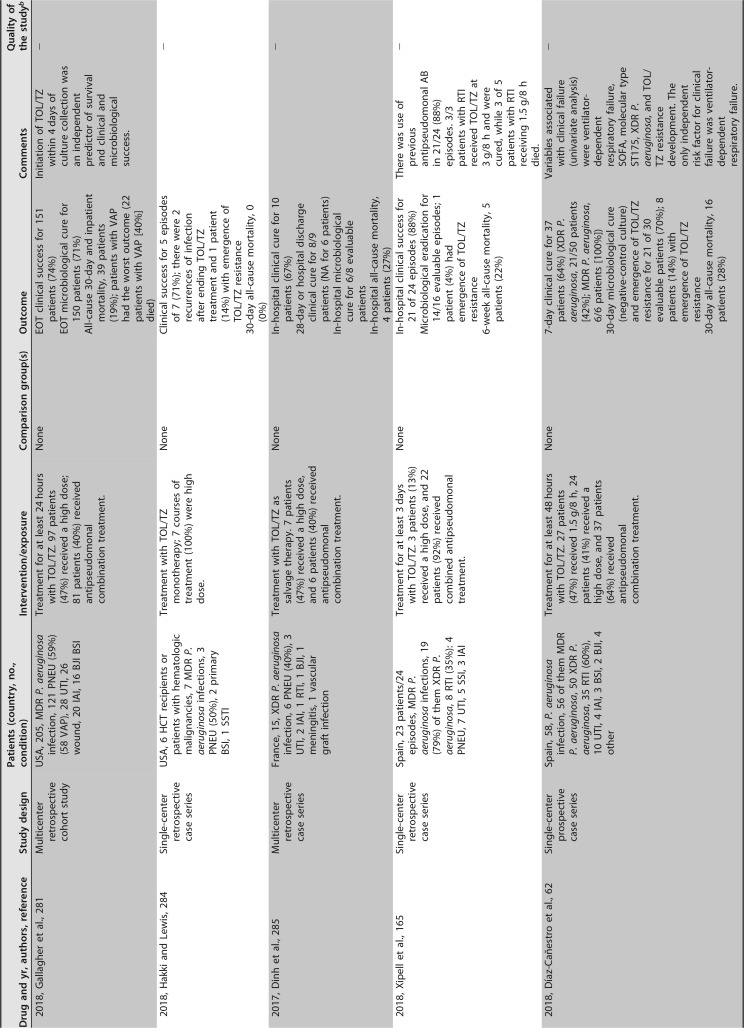

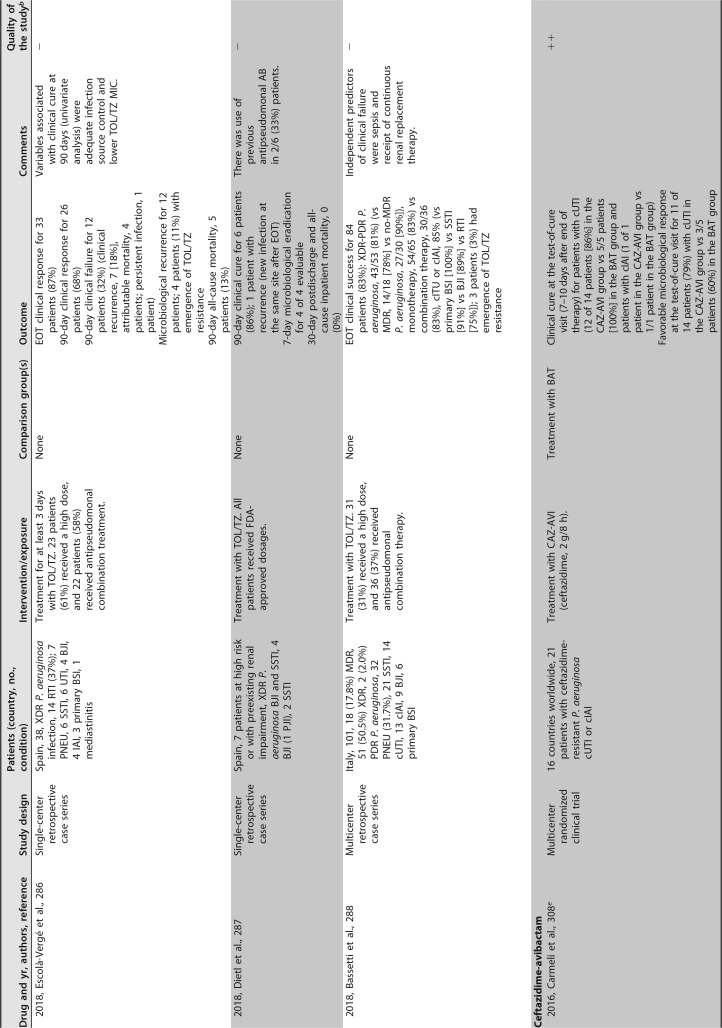
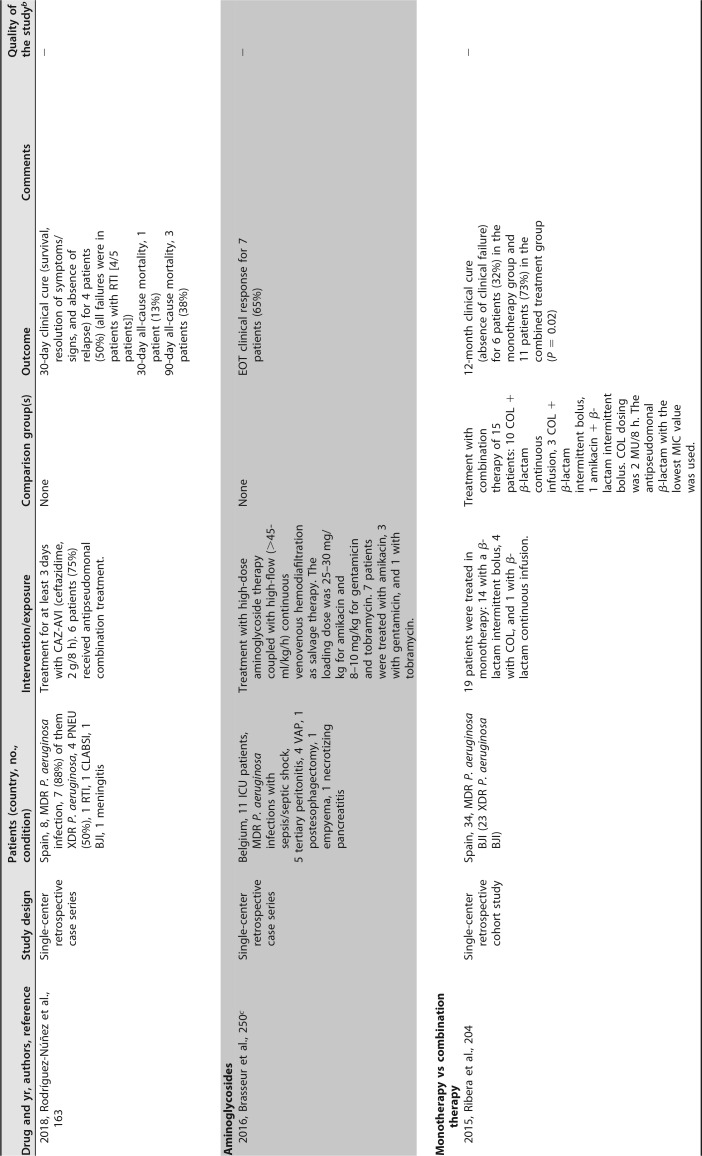
缩略语:AB,抗生素;AKI,急性肾损伤;BAL,支气管肺泡灌洗;BAT,最佳可用治疗;BJI,骨和关节感染;BSI,血流感染;CAZ-AVI,头孢他定 - 阿维巴坦;cIAI,复杂性腹腔内感染;COL,粘菌素;Cr,血浆肌酐浓度;CLCR,肌酐清除率;cUTI,复杂性尿路感染;CLABSI,中心静脉导管相关的血流感染;DOR,多利培南;EOT,治疗结束;GRF,估计的肾小球滤过率;IE,感染性心内膜炎;FDA,食品药品监督管理局;FOS,磷霉素;HCT,造血细胞移植;IAI,腹腔内感染;ID,感染性疾病;LAVD,左心室辅助装置;MDR,多重耐药;MU,百万国际单位;NA,不适用;PIP-TAZ,哌拉西林 - 他唑巴坦;PJI,人工关节感染;PNEU,肺炎;SSI,手术部位感染;RIFLE,风险,损伤,衰竭,缺失和终末期肾病;RTI,呼吸道感染(除肺炎或未指明外);SAPS-II,简化急性生理学评分;SSTI,皮肤和软组织感染;TOL/TZ,头孢洛扎 - 他唑巴坦;UTI,尿路感染;VAP,呼吸机相关性肺炎;XDR,广泛耐药。
b + +,高质量;+,可接受;-,低质量。改编自苏格兰校际指南网络 (SIGN)(https://www.sign.ac.uk/methodology.html).
c 研究包括 MDR 不动杆菌属、MDR 铜绿假单胞菌和 / 或其他 MDR GNB 感染患者;仅报告了铜绿假单胞菌感染的具体信息。
d 高剂量,TOL/TZ 剂量为 3 g/8 h(2 g 头孢洛扎 + 1 g 他唑巴坦,每 8h 一次)或在调整肾功能后的等效剂量。
e 研究包括由头孢他定耐药的革兰氏阴性病原体而非特定的多重耐药革兰氏阴性病原体引起的感染。
联合治疗是否可以改善患者预后的问题是使用多粘菌素治疗 MDR/XDR 铜绿假单胞菌感染需要考虑的另一个主要问题。来自 PK 研究的数据证实,根据欧洲药品管理局 (EMA) 和 FDA 的给药建议,粘菌素血浆浓度较低,不足以治疗 MDR/XDR 铜绿假单胞菌感染 ([165]-[167],[178],[182],[183])。这些发现强调了考虑多粘菌素联合治疗 MDR/XDR 铜绿假单胞菌感染的重要性。Zusman et al.([202]) 最近发表了一篇关于多粘菌素联合或单药治疗碳青霉烯类耐药革兰阴性菌 (GNB) 的系统综述,显示多粘菌素联合碳青霉烯类或替加环素和 / 或氨基糖苷类与生存期之间存在未校正的相关性,但当从分析中排除偏倚研究时,联合治疗与生存期无相关性。大多数研究不包括铜绿假单胞菌感染 ([202])。Khawcharoenporn et al. 表明与活性单药治疗相比,2 种活性药物联合治疗的生存期更长,在大多数病例中,包括粘菌素 ([表 4])([203])。有趣的是,最近的一个 MDR/XDR 铜绿假单胞菌导致的骨关节感染的前瞻性临床序列也显示,与 β- 内酰胺类或黏菌素单药治疗相比,黏菌素联合治疗的临床预后更好 ([204])([表 4])。需要更大规模的侵袭性 MDR/XDR 铜绿假单胞菌感染的临床序列和随机临床试验来证实这些数据。在此之前,最新的专家小组指南推荐,多粘菌素的最佳使用可用于治疗 MDR/XDRP。
多粘菌素感染应与一种或多种其他病原体表现出敏感铜绿假单胞菌 MIC 的药物联合使用 ([185])。
关于多粘菌素 B,MDR/XDR 铜绿假单胞菌感染的临床经验有限 ([166],[205]-[209])。这些研究均为回顾性序列,患者数量较少,只有 1 项研究中有 126 例病例 ([208])。菌血症和肺炎是主要适应症。尚未充分研究临床应答,死亡率极高 ([表 4])。
肾毒性是全身给予多粘菌素的常见不良反应 ([210],[211])。尽管多粘菌素 B 的肾毒性似乎较低,但是这种不良反应对两种多粘菌素(多粘菌素和多粘菌素 B)均具有剂量限制性 ([205])。在粘菌素的情况下,与肾损伤相关的血药浓度与细菌效应所需的血药浓度重叠 ([212])。已证实,粘菌素血浆浓度是急性肾损伤 (AKI) 发生的最重要风险因素。平均稳态血浆粘菌素浓度大于~2 mg/L 被认为是粘菌素相关肾毒性的独立风险因素 ([183],[189],[213])。这些数据突出了粘菌素较窄的治疗窗。在这种情况下,治疗药物监测可能是一种有用的临床工具,可最大化临床目标,同时最小化潜在的肾毒性 ([185])。
多粘菌素 B 和 CMS 均作为吸入疗法给药,用于治疗肺炎、支气管扩张和慢性铜绿假单胞菌感染以及囊性纤维化患者的肺部急性加重。同样,大多数吸入给药研究均采用 CMS。最近的一项荟萃分析重点关注非 CF 患者使用吸入性粘菌素单药治疗呼吸道感染 ([214])。
分析包括 10 项诊断为肺炎患者的研究和 2 项呼吸机相关气管支气管炎患者的研究。总体全因死亡率为 33.8%,临床成功率为 70.4%([214])。这项荟萃分析的作者得出结论,接受吸入型 CMS 单药治疗的患者的预后令人鼓舞,值得进一步考虑治疗 MDR GNB 引起的呼吸道感染。最近的另一项荟萃分析分析了吸入和静脉 (i.v.) 粘菌素的组合。这些研究使用了低质量的数据,这些数据表明,除了给予较低的 i.v. 粘菌素剂量外,联合用药不会降低 MDR 革兰阴性菌感染患者的死亡率。未具体提取 MDR/XDR 铜绿假单胞菌感染的结果 ([215])。
关于在铜绿假单胞菌引起的感染患者中进行的研究,Athanassa et al. 在机械通气的重症患者中开展了一项吸入型 CMS 的药代动力学研究 ([216])。该研究纳入了 8 例铜绿假单胞菌感染患者,每 8h 接受一次 80 mg CMS。上皮细胞衬液 (ELF) 中的粘菌素浓度比血清中达到的浓度高 5 倍,尽管第 4h 和第 8h 的 ELF 浓度低于 EUCAST 折点。基于这些数据,作者得出结论,尽管 80 mg 每 8h 一次的剂量可能不适合治疗多耐药 GNB 引起的感染,但是吸入性粘菌素可以在肺部获得较高的药物浓度 ([216])。Lu 等人 ([217]) 比较了 122 例由对 β- 内酰胺类、氨基糖苷类或喹诺酮类敏感的铜绿假单胞菌和鲍曼不动杆菌菌株引起的呼吸机相关性肺炎 (VAP) 患者接受静脉注射抗生素治疗 14 天与 MDR 铜绿假单胞菌或鲍曼不动杆菌引起的 VAP 患者通过雾化黏菌素(500 万 IU,每 8h 一次)单药治疗 (n = 28) 或与静脉注射氨基糖苷类联合治疗的临床预后。有一些方法学局限性,他们得出结论,雾化 CMS 不劣于静脉注射 β- 内酰胺类联合氨基糖苷类或喹诺酮类 ([217])。关于 CMS 在呼吸机相关气管支气管炎患者中的应用,Maskin et al. 在一项 17 例感染 MDR 铜绿假单胞菌患者的研究中证实,吸入 CMS 能够减少气管分泌物量、化脓和细菌负荷 ([218])。
关于多粘菌素 B 雾化的临床信息很少。最近在小鼠肺部感染模型中进行的一项吸入多粘菌素 B 抗铜绿假单胞菌的研究强调了肺内给予多粘菌素 B 相对于静脉给药在获得高水平 ELF 药物暴露方面的优势 ([219])。Pereira et al. 开展的临床研究着重于使用雾化多粘菌素 B 作为肺炎的挽救治疗和 MDR GNB 引起的气管支气管炎的初始治疗 ([220]) 的结论是,吸入性多粘菌素 B 可用作静脉治疗失败的 MDR GNB 引起的医院获得性肺炎的挽救治疗以及单独用于治疗铜绿假单胞菌气管支气管炎时。考虑到所有这些结果,我们认为应该考虑吸入多粘菌素治疗 MDR/XDR 铜绿假单胞菌引起的下呼吸道感染。证据不足以认为吸入性药物单药治疗肺炎,其中静脉注射和吸入性多粘菌素联合治疗是一种良好的选择。在气管支气管炎的情况下,可以单独使用吸入疗法,尽管还需要更多的剂量研究和临床序列。
多粘菌素可在治疗 MDR/XDR 细菌所致的中枢神经系统感染 (CNS) 中发挥重要作用的另一种情况。
当 MDR 微生物是感染的原因时,报告的 CNS 死亡率高达 71%([221])。这在一定程度上是由于在这些难以治疗的感染中,只有一部分静脉注射抗生素剂量到达了感染部位 ([222]-[224])。因此,需要大剂量静脉注射才能达到杀菌效果。但是,由于广泛的肾脏重吸收和粘菌素相关的肾毒性风险,外周给药的粘菌素对 CNS 感染既无效也不安全 ([225])。为了克服这一问题,多粘菌素的鞘内或脑室内给药已在临床实践中普遍使用,并已成为治疗对所有其他抗生素耐药的 MDR GNB CNS 感染的唯一治疗选择。虽然该给药途径的大多数临床经验报告为鲍曼不动杆菌引起的感染,但仍有一些 MDR/XDR 铜绿假单胞菌引起感染的报告 ([226]-[233]) 具有良好的临床预后。尽管在这种情况下鞘内给药是强制性的,但从未根据 PK/PD 指数对鞘内多粘菌素治疗进行优化 ([225])。目前的 IDSA 指南建议鞘内给予 10 mg CMS 或 5 mg 多粘菌素 B,每日一次 ([234])。近期关于多粘菌素使用的国际共识指南推荐脑室内或鞘内给予 125,000 IU CMS(~4.1 mg 粘菌素基质活性)或 5 mg (50,000 IU) 多粘菌素 B / 天 ([185])。
在临床实践中,甚至在指南中,CNS 感染的治疗剂量和持续时间都是经验性选择,因为迄今为止尚未确立 PK/PD 目标。因此,如 Nation et al. 指出在不久的将来,重要的是确定优化通过鞘内途径给予多粘菌素的剂量方案的最佳目标 ([169])。
# 碳青霉烯类
与所有 β- 内酰胺类抗生素一样,碳青霉烯类表现出时间依赖性抗菌活性。不同的体外和体内研究已确定 最能预测疗效的 PK/PD 参数为未结合或游离血清药物浓度超过病原体 MIC 的给药间期百分比 (fT> MIC)【游离药物浓度大于细菌最低抑菌浓度的时间占比】。旧的体外和体内 PK/PD 研究最初将 fT > MIC≥40% 定义为碳青霉烯类抗菌活性的最佳值 ([235])。在一个小鼠大腿模型中发现了相似的数值,该模型感染了铜绿假单胞菌菌株,在标准和高接种量下过表达 MexA-MexB-OprM 外排泵 ([236])。
采用目前批准的抗生素剂量和短期输注方案,在所有患者人群和敏感病原体中达到最佳 PK/PD 目标暴露量的概率大于 80%(http://www.eucast.org/documents/rd/;访问日期 2018 年 10 月 25 日)。但是,在较不敏感或甚至耐药病原体(例如 MDR 或 PDR 铜绿假单胞菌)引起的感染情况下,该概率大大降低。因此,需要旨在实现预期目标的新战略。在这种情况下,许多研究评估了新的给药策略,如增加剂量或使用延长输注给药。
旨在确定这些难以治疗的铜绿假单胞菌感染在不同特殊人群中的最佳碳青霉烯类剂量的各项研究显示,可能需要高剂量。
一项采用 Monte Carlo 模拟的药效学研究评价了美罗培南间歇或延长 (3h) 输注给药方案对不同敏感性的肠杆菌科、铜绿假单胞菌和不动杆菌菌群的作用。MIC 数据和分布来源于美罗培南年敏感性试验信息收集 (MYSTIC),这是一项在 14 个美国中心开展的多中心、纵向监测项目。共纳入 276 株铜绿假单胞菌分离株,其中 22.1% 的 MIC 值 > 4 mg/L。对所有敏感的铜绿假单胞菌分离株,暴露于 50% fT > MIC(MIC 值≤4 mg/L)时,需要的美罗培南剂量为 1 g/8 h(延长输注)或 2 g/8 h(间歇 / 延长输注)。然而,对于被认为对美罗培南中介的微生物 (MIC = 8 mg/L),只有 2 g/8 h 延长输注的较高剂量方案达到了充分的杀菌暴露。作者建议将美罗培南的最高剂量 (2 g/8 h) 通过延长输注给药,用于治疗中度或耐药铜绿假单胞菌 ([237])。
使用 Monte Carlo 模拟的体外感染模型评价亚胺培南联合妥布霉素抗碳青霉烯类和氨基糖苷类耐药铜绿假单胞菌临床分离株的最佳剂量。获得最佳抗菌活性的模拟剂量为亚胺培南 4 或 5 g / 天,持续输注联合妥布霉素 ([238])。在中性粒细胞减少的 XDR 铜绿假单胞菌感染小鼠大腿模型中,同一组证实了该给药方案的适当性 ([160])。在一项包括 237 株对碳青霉烯类敏感性降低的铜绿假单胞菌分离株的血液感染研究中,测试了不同的碳青霉烯类给药方案:0.5-1 g/6 h 的亚胺培南 0.5h 和 3h 输注,1-2 g/8 h 的美罗培南 0.5h 和 3h 输注,以及多利培南以 0.5 至 2 g/8 h 的速率给药,输注 1h 和 4h。T > MIC 40% 被认为是最佳的 PK/PD 比值。结果显示,美罗培南 2 g/8 h 持续滴注 3 h 和多利培南 1 g/8 h 持续滴注 4 h 对碳青霉烯类敏感性降低的铜绿假单胞菌的疗效最佳 ([239])。有趣的是,在 1 例 MDR 铜绿假单胞菌所致肺炎的双肺移植重症患者(美罗培南 MIC 为 32 mg/L)的病例报告中,患者持续接受美罗培南输注(8 g 美罗培南 / 24 h),达到了临床治愈 ([240])。
# 其他经典抗假单胞菌 β- 内酰胺类
关于一些经典抗假单胞菌 β- 内酰胺类药物如头孢吡肟、头孢他定、哌拉西林 - 他唑巴坦和氨曲南在单药治疗 MDR/XDRP. 铜绿假单胞菌感染中作用的数据非常少。
氨曲南可能是治疗 Ambler B 类 MBL 产生的革兰氏阴性菌(包括铜绿假单胞菌)的一种可能选择。一个序列评估了其对产 MBL 铜绿假单胞菌感染的临床疗效。在该研究中,死亡率为 30%,但大多数病例涉及联合治疗,样本量太小,无法得出明确的结论 ([241])。另一个序列纳入了 9 例接受静脉内粘菌素联合氨曲南或哌拉西林 - 他唑巴坦的产 MBL 假单胞菌感染患者,其中 7 例 (77.8%) 患者的预后良好且存活 ([242])。
1 份病例报告描述了 1 例免疫功能低下的 MDR 铜绿假单胞菌伤口感染患者,通过连续输注(8.4 g / 天)给予高剂量氨曲南成功治疗 ([243])。另一份病例报告描述了一名接受血液透析的患者,其发生 MDR 铜绿假单胞菌菌血症,头孢吡肟 MIC 为 16 mg/L,并成功接受该抗生素的延长输注方案 (3h) 治疗 ([244])。
1 例严重免疫抑制的 MDR 铜绿假单胞菌菌血症患者(头孢他定 MIC 为 64 mg/L)接受高剂量头孢他定持续输注治疗(6.5-9.6 g / 天),临床成功 ([243])。
如前文所述,一些体外联合检测,如头孢吡肟 - 妥布霉素 ([138]) 和头孢吡肟 - 氨曲南 ([148]) 的检测,显示了对 MDR 铜绿假单胞菌的累加或协同效应。
根据菌株的类型和耐药表型和基因型,在个体病例中一种可能的策略是在联合治疗方案中使用这些药物中的一种以高剂量长期输注给药。
# 氨基糖苷类
一些氨基糖苷类对 MDR/XDR 铜绿假单胞菌菌株仍有活性 ([245],[246])。虽然氨基糖苷类可用于尿路感染的单药治疗 ([247]),但氨基糖苷类可与其他抗菌药物联合使用,治疗 MDR/XDR 铜绿假单胞菌引起的更严重感染。
关于药效学,许多体外和体内研究已经证明氨基糖苷类具有浓度依赖性抗菌活性,峰浓度(最大浓度 [Cmax]/MIC)≥8 至 10 是疗效的最佳 PK/PD 预测因子 ([248])。应在治疗的最初 24-48h 内达到该值。在铜绿假单胞菌菌血症患者中进行的一项回顾性临床研究中,该 PK/PD 指数与更好的临床治愈率相关,该菌血症并非由 MDR 或 XDR 铜绿假单胞菌菌株特异性引起 ([249])。【pk 指 pharmacokinetics,即药物代谢动力学,指体内药物浓度与时间的关系。pd 指 pharmacodynamics 即药物效应动力学,指体内药物浓度与作用效应强度的关系。】
近年来,一些研究已开始优化给药方案以对抗 MDR GNB,如铜绿假单胞菌。上文引用的一个 PK 模型评价了妥布霉素和亚胺培南对碳青霉烯类和氨基糖苷类耐药铜绿假单胞菌临床分离株的最佳剂量 ([238])。作者得出结论,需要 7-mg/kg 剂量的妥布霉素,每 24h 一次,0.5h 输注给药,联合亚胺培南,以达到充分的细菌杀灭,并在 48h 时防止再生长。
一种策略用于治疗 XDRP 引起的感染。
铜绿假单胞菌将给予非常高剂量的氨基糖苷类联合连续肾脏清除技术,以预防肾毒性。结果显示了较高的生存率,尽管纳入的患者数量有限 ([250],[251])。
在重度或深部感染的情况下,如 MDR 或 XDR 铜绿假单胞菌导致的肺炎或脑膜炎,氨基糖苷类可使用其他给药途径。对于肺炎的治疗,吸入阿米卡星允许在感染部位(例如 ELF)达到较高的药物浓度,并预防可能引起全身毒性的较高全身暴露。但是,目前仅推荐将吸入性抗生素(多粘菌素或氨基糖苷类)作为仅对氨基糖苷类或多粘菌素敏感的革兰氏阴性杆菌引起的感染的辅助治疗,并与其他全身给药药物联合使用 ([252])。
脑膜炎是另一种难以治疗的感染。由于对中枢神经系统的渗透性较差,导致感染部位浓度低且不充分,因此静脉注射氨基糖苷类的疗效有限。在这种情况下,可能需要脑室内氨基糖苷类给药。近期有 1 例 PDR 铜绿假单胞菌引起的术后脑膜炎病例,采用头孢吡肟静脉连续输注联合阿米卡星静脉和脑室内给药成功治疗 ([253])。虽然该菌株对阿米卡星的 MIC 为 32 mg/L,但在中枢神经系统中达到 200 mg/L 的浓度足以治愈感染。
# 磷霉素
由于磷霉素静脉给药在体外具有优良的杀菌活性,可以杀灭广谱细菌,包括 MDR 铜绿假单胞菌,因此重新出现与其他抗生素联合治疗 MDR 细菌引起的感染 ([254],[255])。提出的一种治疗选择是使用磷霉素和碳青霉烯类,这是一种对不同的铜绿假单胞菌分离株表现出良好协同活性的组合。该复方制剂也显示出更好的临床预后,尤其是在延长输注时 ([256]-[258])。
其他试验也评估了磷霉素与 β- 内酰胺类、氨基糖苷类或者黏菌素联合使用 ([259])。其中 1 例患者接受原位肝移植,5 位患者使用磷霉素,其中 3 位是 XDR 铜绿假单胞菌感染,磷霉素的 MIC < 16 mg/L,另 1 位是 XDR 肺炎克雷伯菌和铜绿假单胞菌感染,MIC 是 32 mg/L([259])。在其中 2 例患者中,感染被根除,但在另外 3 例中,治疗失败(在 2 例中,临床应答较差,第 3 例发生二重感染)。
这种所谓的 “旧” 抗生素也与新的抗菌剂有关,例如头孢他定 - 阿维巴坦或头孢洛扎 - 他唑巴坦 ([260],[261])。1 例 XDR 铜绿假单胞菌脑膜炎患者采用 3-g/8h 剂量的头孢洛扎 - 他唑巴坦联合 4-g/6h 剂量的磷霉素成功治疗 ([261])。然而,这些病例使用的磷霉素剂量差异很大,这提供了证据表明这种抗生素治疗难治性感染的最佳剂量还没有确定。
在系统评价磷霉素治疗 MDR、XDR 或者 PDR 非发酵革兰阴性菌感染的临床和微生物学疗效时,磷霉素治疗铜绿假单胞菌感染的剂量范围是 2 g/12 h 至 5 g/8 h,与其他抗生素联合 ([254])。
几项研究评价了磷霉素的不同剂量方案联合碳青霉烯类治疗非 MDR 和 MDR 铜绿假单胞菌临床分离株时,以 PK/PD 目标达成率为基础。
其中之一是使用 Monte Carlo 模拟计算不同磷霉素和碳青霉烯类药物剂量和输注时间达到目标的概率 ([262])。在非 MDR 铜绿假单胞菌分离株的情况下,延长碳青霉烯类抗生素的输注时间联合磷霉素连续输注,剂量是 16-24 g / 天可以获得最佳的 PK/PD 比值。但是,对于 MDR 铜绿假单胞菌分离株,磷霉素和碳青霉烯类复方制剂都没有达到 PK/PD 目标。应该注意的是,这项研究是在泰国开展,检测的临床分离株的磷霉素 MIC 值非常高,不能将结果外推至其他环境 ([262])。
还需要更多的临床序列和试验来确定磷霉素在这些感染中的未来作用,包括最佳剂量和可能的联合用药。
# 对抗 MDR 和 XDR 铜绿假单胞菌的新抗生素
尽管通常对新旧抗假单胞菌抗生素进行了明确的区分 ([263],[264]),但是,近年来,新旧药物联合使用产生的两种抗生素已经上市 ([265],[266])。
# 头孢洛扎 - 他唑巴坦
头孢洛扎 - 他唑巴坦是一种有效的针对多种 MDR 革兰阴性杆菌的复方制剂,尤其是 MDR/XDR 铜绿假单胞菌。Ceftolozane 是活性最强的抗假单胞菌药之一。其对铜绿假单胞菌的活性超过其他抗假单胞菌 β- 内酰胺类药物 20%-25%([267])。Ceftolozane 抑制 PBPs 和非 ESBL TEM 和 SHV 变体以及 AmpC 酶,而他唑巴坦靶向 A 类丝氨酸 β- 内酰胺酶和 ESBLs。Ceftolozane 还对非 ESBL D 类苯唑西林酶起作用,但缺乏对碳青霉烯酶的活性 ([268])。 【1963 年在雅典首次报道了由大肠埃希菌(大肠杆菌)产生的质粒介导的 TEM-1β 内酰胺酶(命名来自携带此菌株的病人 Temoniera 【特莫涅拉】的缩写),1969 年 TEM-2 在英国被报道。与 TEM-1 相比是在 39 位氨基酸残基处发生了 Ser→Lys 的突变,两者生化特性几乎完全相同,至今未发现与它们结构基因同源性很高的染色体介导的酶,所以其起源仍是个谜。1974 年 SHV-1 (sulphydryl variable【巯基变量】的缩写,也叫 PIT-2) 在瑞典被首次报道,该酶与存在于肺炎克雷伯菌中由染色体介导的 LEN-1 有 88.9% 的同源性,因此,SHV-1 可能起源于 LEN-1。TEM-1 和 SHV-1 有 63.7% 的同源性,它们同 TEM-2 一起都属于普通广谱 β 内酰胺酶,即对所有青霉素类高度耐药,对第 1 代头孢菌素低度耐药,耐药程度与产酶量有关。】
在许多研究中,已证实 MDR/XDR 铜绿假单胞菌对头孢洛扎 - 他唑巴坦的敏感性是可变的,根据序列和国家不同 ([31],[67],[150],[245],[246],[269]-[274]),发生率在 55% 至 96.6% 之间。
这些研究的数据见 [表 5]。
# 表 5
头孢洛扎 - 他唑巴坦对铜绿假单胞菌耐药菌株的活性
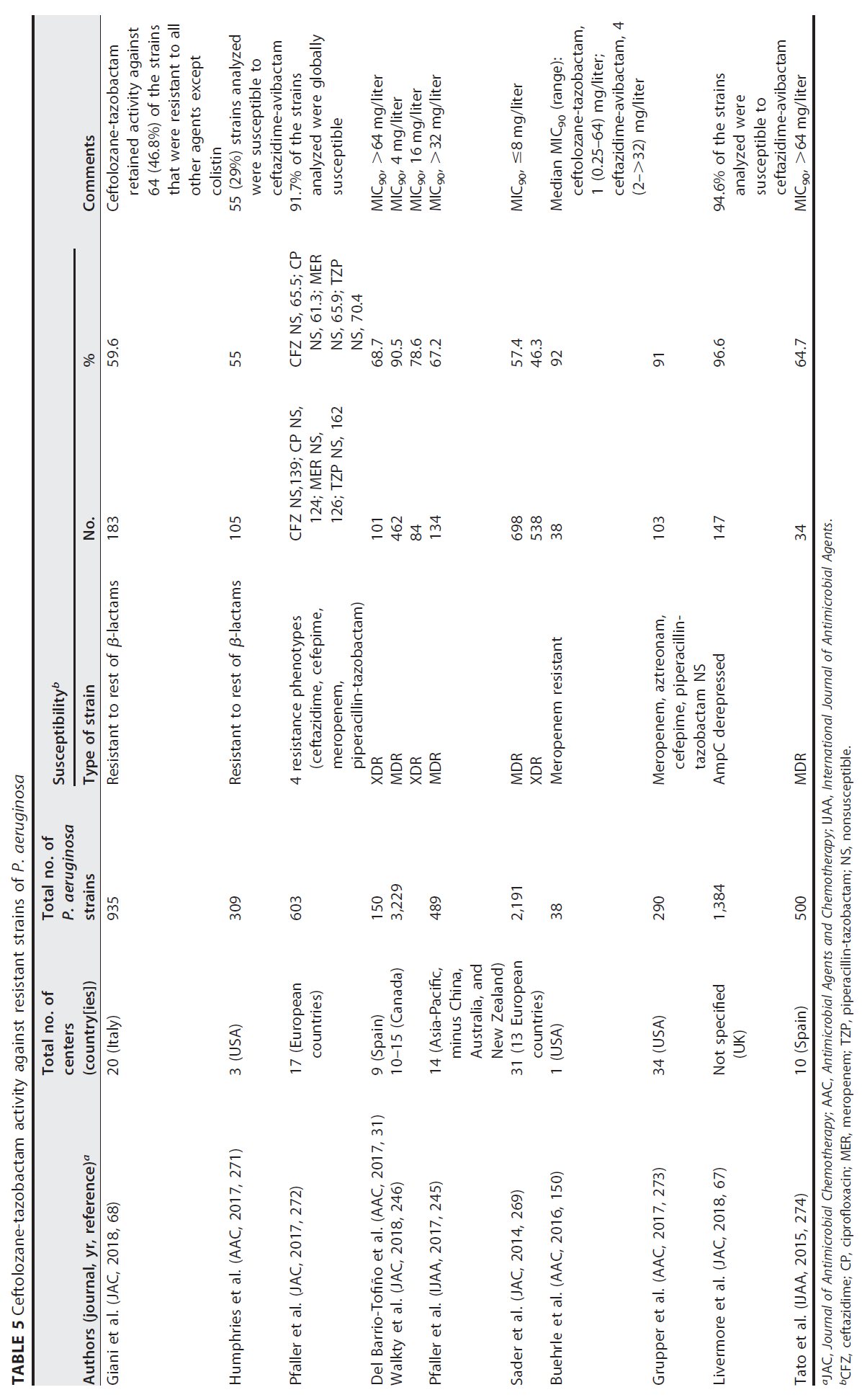
a JAC, 抗菌化疗杂志;AAC, 抗菌药物与化疗;IJAA, 国际抗菌药物杂志。
b CFZ,头孢他定;CP,环丙沙星;MER,美罗培南;TZP,哌拉西林 - 他唑巴坦;NS,不敏感。
就其 PK/PD 指数而言,与其他头孢菌素一样,头孢洛扎 - 他唑巴坦的杀菌疗效与血药浓度高于目标微生物 MIC 的时间百分比相关 (% T> MIC)([151])。开展了 Monte Carlo 模拟,以研究头孢洛扎 - 他唑巴坦给药方案,并确定该药物治疗 MDR 铜绿假单胞菌引起感染的最佳剂量,MIC 值在 4 至 32 mg/L 之间,检测了不同剂量、输注时间和肾功能状态 ([275])。模拟的多种情况确定了当 MIC≤32 mg/L(肌酐清除率 [CLCR],15 至 50 mL/min)、≤16 mg/L(CLCR,51 至 120 mL/min)和≤8 mg/L(CLCR,121 至 180 mL/min)时,当前 1/0.5 g 的头孢洛扎 - 他唑巴坦剂量为最佳剂量。
在 MIC 为 4 至 32 mg/L 的感染中增强肾脏清除率的模拟中,与较短的连续输注相比,延长输注 4 至 5h 达到目标的概率(PTA,达标概率)更高 ([275])。另一项研究模拟了 4 种头孢洛扎 - 他唑巴坦剂量,范围为 250/125 mg 至 2/1 g,每 8h 一次,输注持续时间为 1 至 7h,连续输注。PTA 目标定义为 40% fT > MIC([276])。结果显示,对于≤32 mg/L 的 MIC 和不同的肾功能值,当前剂量 1/0.5 g 为最佳剂量。但是,在肾脏清除率升高的患者中,延长输注 4-5h 提供的 PTA 高于间歇性输注。另一方面,在肺炎患者中进行的另一项群体 PK 研究(包括 ELF 中的动力学)也模拟了不同的给药方案,并得出结论,对于 MIC≤8 mg/L 的病原体,ELF 中有必要达到 > 90% PTA(实际,98%)的 2 g/1g 剂量 ([277])。与其他 β- 内酰胺类抗生素一样,通过延长或持续输注长期给药是提高达到 PK/PD 目标概率的潜在策略。但是,直到最近,关于延长或持续输注头孢洛扎 - 他唑巴坦的评价证据很少。1 例病例报告描述了 1 例 MDR 铜绿假单胞菌引起的尿路感染患者,该患者在门诊以 4/0.5 g 剂量的头孢洛扎 - 他唑巴坦每 24h 一次持续输注成功治疗,未发生不良事件 ([278])。另一份病例报告评价了该抗生素在 MDR 绿脓杆菌人工髋关节感染的重症患者中的药代动力学,这些患者接受连续性静脉 - 静脉血液滤过,每 8h 给予 1/0.5g 剂量的头孢洛扎 - 他唑巴坦,在 4h 内延长输注 ([279])。
一名患有碳青霉烯类耐药铜绿假单胞菌引起的肺脓肿的门诊患者连续输注 3 g/1.5 g 头孢洛扎 - 他唑巴坦后,其 MIC90 为 2 mg/L([280])。在最后 2 例病例中,血清浓度分析证实这些给药方案足以达到预期的 PK/PD 目标 ([279],[280])。
已经发表了一些关于头孢洛扎 - 他唑巴坦治疗 MDR/XDR 铜绿假单胞菌感染的序列临床经验 ([表 4])。这些研究主要是回顾性研究,除一项 205 例患者的研究外 ([281]),患者序列较短。这些病例序列的主要适应症是呼吸道感染,使用了不同剂量的头孢洛扎 - 他唑巴坦,有时是联合治疗。治愈率接近 70%,在一些研究中出现耐药性为 4% 至 14%,在不同时间测定的死亡率范围为 0%(小序列病例)至 27%([26],[62],[165],[281]-[288])。
总之,对于对本药敏感的 MDR/XDR 铜绿假单胞菌感染的治疗,头孢洛扎 - 他唑巴坦可能是一个良好的选择,但应谨慎使用并优化剂量,可能还应优化输注时间。高菌量感染(高接种量感染)可考虑联合治疗,以防止选择体内耐药 ([表 6])。然而,还需要更多的临床研究来充分证实这些声明。具体而言,在不久的将来,使用该药物以及在现实世界中可能选择耐药突变株的观察性研究、比较单药治疗与联合治疗的临床试验以及更大序列的 MDR/XDR 铜绿假单胞菌感染将是有用的。
# 表 6
针对 MDR/XDR 铜绿假单胞菌最常见耐药谱的抗菌治疗选择建议 a
| 耐药特征 | 耐药机制 | 高风险克隆出现频率更高 | 治疗方案 b |
|---|---|---|---|
| PTZ R, CAZ R, ATM R, MER R, TOL/TZ S, CAZ/AVI S, AMK S COL S | AmpC 过表达 + OprD 缺陷 | ST175 | COL、POLY-B、TOL/TZ、CAZ/AVI、AMK |
| PTZ R, CAZ R, ATM S, MER R, TOL/TZ R, CAZ/AVI R, AMK S COL S | MBL 产物 | ST235、ST111(ST175) | COL,POLY-B,ATM,AMK |
| PTZ R, CAZ R, ATM R, MER R, TOL/TZ R, CAZ/AVI S, AMK S COL S | A 类碳青霉烯酶(如 GES 酶)或某些具有 OprD 缺陷的 ESBLs 的组合 | ST235 | COL,POLY-B,CAZ/AVI |
a 缩略词:PTZ = 哌拉西林 - 他唑巴坦;CAZ = 头孢他定;ATM = 氨曲南;MER = 美罗培南;TOL/TZ = 头孢洛扎 - 他唑巴坦;CAZ/AVI = 头孢他定 - 阿维巴坦;AMK = 阿米卡星;COL = 黏菌素;POLY-B = 多粘菌素 B。
b 在重度感染中,应考虑 β- 内酰胺类长期或连续输注给药和 / 或与静脉注射粘菌素、多粘菌素 B 或阿米卡星联合给药。阿米卡星或多粘菌素单药治疗可用于尿路感染。建议对黏菌素或阿米卡星进行治疗药物监测。应该考虑使用雾化黏菌素 (2-5 MU/8 h) 作为下呼吸道感染的辅助治疗。
# 头孢他定 - 阿维巴坦
阿维巴坦含有二氮杂双环辛烷核,是一种广谱抑制剂,对含有亲核丝氨酸残基的酶有效 ([289])。
它对 MBL 产生菌株没有活性 ([290])。头孢他定中加入阿维巴坦可保护头孢菌素免受铜绿假单胞菌菌株(主要由于 Amp-C 酶,也可由于 ESBLs 和 A 类碳青霉烯酶,如 GES 酶)引起的酶促降解,导致头孢他定的 MIC 下降,与更高剂量的阿维巴坦合并用药时更明显 ([291])。
【肠杆菌科细菌对碳青霉烯类抗菌药物的主要耐药机制包括产碳青霉烯酶、外膜蛋白缺失或突变、外排泵过度表达,以及青霉素结合蛋白变异等,其中最主要的是碳青霉烯酶,其是一类能水解广谱 β- 内酰胺环的水解酶,可以使所有含有 β- 内酰胺环的抗菌药物失效。编码酶的基因位于基因组 DNA 上或质粒上,因为水平基因转移元件的存在,可以对各种耐药基因进行整合,并通过质粒进行传播,使耐药基因的传播跨越生殖隔离,耐药性更加具有传播性。Ambler 分类法根据氨基酸序列将 β- 内酰胺酶分为 A、B、C、D 4 类,其中 A、B、D 3 类具有水解碳青霉烯类抗菌药物的活性。A 类是一类丝氨酸蛋白酶,可以引起青霉素类、氨曲南、碳青霉烯类耐药,不水解第 3 代头孢菌素,他唑巴坦、克拉维酸可以抑制此类酶,但不能被乙二胺四乙酸所抑制。包括肺炎克雷伯菌碳青霉烯酶 (Klebsiella pneumoniae carbapenemase, KPC)、亚胺培南水解 β- 内酰胺酶 (imipenem-hydrolyzing β-lactamase, IMI)、粘质沙雷菌 β- 内酰胺酶 (S. marcescens enzyme, SME)、圭亚那超广谱 β- 内酰胺酶 (Guiana extended spectrum β-lactamase, GES)、NMC、SHV 6 种,其中 KPC 最为常见,KPC 常位于 IncA/C 型和 IncFIIK+ FIBK 型质粒的 Tn4401 转座子上,该质粒具有宿主种类多、分布范围广的特点,更加速了 KPC 基因的传播 [19]。B 类属于金属酶类,目前已知的有亚胺嘌呤金属 -β- 内酰胺酶 (integron-encoded metallo-β-lactamase, IMP)、维罗纳整合子编码的金属 -β- 内酰胺酶 (Verona integron-encoded metallo-β-lactamase, VIM)、新德里金属 -β- 内酰胺酶 (the New Delhi metallo-β-lactamase, NDM) 3 种。IMP 型金属酶有 8 种亚型,其活性位点上包含金属离子,对常见的碳青霉烯类抗菌药物有很强的水解活性,能够灭活青霉素类、头孢菌素类和碳青霉烯类抗菌药物,对氨曲南无水解活性。其水解活性不被克拉维酸、舒巴坦等酶抑制剂抑制,但可以被乙二胺四乙酸和巯基化合物等金属离子螯合剂所抑制,多位于质粒上并与整合、插入序列等可移动性基因元件结合,具有很强的传播能力 [20]。D 类是一种苯唑西林酶,多位于染色体上,目前已发现 400 种以上的 OXA 家族基因,其中 232 种对常见的碳青霉烯类抗菌药物有低的水解活性,多见于鲍曼不动杆菌,主要是 OXA-48 型。】【GES/IBC 分别是 Guiana extended-spectrum Blactamase/,Integron-borne cephalosporinase 的简称】
多项体外研究已经证明,头孢他定 - 阿维巴坦对世界不同地区和不同时间收集的大量 MDR/XDR 铜绿假单胞菌菌株表现出良好的活性,抑制率在 66.1%-86.5% 之间 ([162],[292]-[295])([表 7])。在 INFORM 研究中收集的另一个包括 5716 株铜绿假单胞菌的序列中,头孢他定 - 阿维巴坦对所有试验菌株显示出 92.4% 的活性 ([296])。虽然其对 MBL 阳性菌株的活性较低,但它是仅次于粘菌素的活性第二高的药物。同样,在另一项体外研究中,几株不同耐药水平的铜绿假单胞菌菌株暴露于 β- 内酰胺类抗生素,74.1% 的泛 β- 内酰胺耐药分离株对头孢他定 - 阿维巴坦敏感,MIC90 为 16 mg/L([59])。同样,对美国医院尿路感染患者的铜绿假单胞菌菌株的活性显示,对头孢他定、美罗培南或哌拉西林 - 他唑巴坦耐药菌株的 MIC90 为 32 mg/L([297])。INFORM 2012-2014 研究分析了头孢他定 - 阿维巴坦对 7 062 株铜绿假单胞菌的活性,发现其中 563 株 (8%) 对该抗生素表现出耐药性。其中一半原因是拥有编码 MBL 的基因 ([298])。另一项研究在一项治疗复杂性尿路感染的 III 期试验中评估了头孢他定 - 阿维巴坦对临床分离株的活性,其中 41 株铜绿假单胞菌。这些菌株的 MIC 范围是 4-16 mg/L([299])。
# 表 7
头孢他定 - 阿维巴坦对 MDR 和 XDR 铜绿假单胞菌的活性
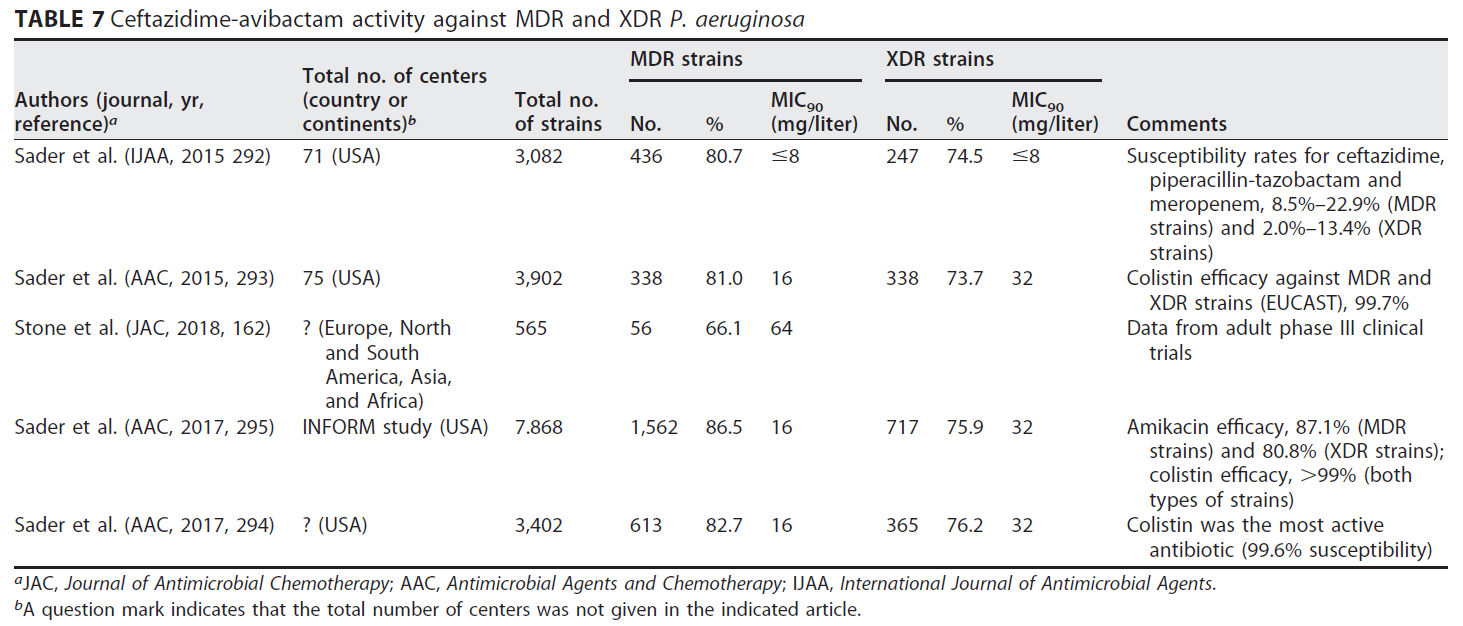
a JAC, 抗菌化疗杂志;AAC, 抗菌药物与化疗;IJAA, 国际抗菌药物杂志。
b 问号表示所示文章中未给出中心总数。
为了分析铜绿假单胞菌对头孢他定 - 阿维巴坦的耐药性,开展了一项研究,评估暴露于抗生素后该微生物的演变。有趣的是,研究的菌株产生了对头孢他定 - 阿维巴坦耐药的突变体,主要通过外排泵 PA14_45890 和 PA14_45910([60])。
关于 PK/PD 参数,头孢他定 - 阿维巴坦 2 g/0.5g 多次给药后,Cmax 是 113.0/15.0 mg/mL,曲线下面积 (AUC) 是 348.2/42.2 mg・h/L。关于头孢他定 - 阿维巴坦的 PK/PD 特性,提出了一种新的比率,可以在体外或体内中计算,定义为 % fT > CT,其中 CT 是阿维巴坦的 “浓度阈值”([300])。在 HFIM 中,检测了几个 CT 值,以确定哪一个与对头孢他定耐药铜绿假单胞菌菌株的疗效相关性最好(头孢他定的 MIC 为 32-128 mg/L,头孢他定 - 阿维巴坦的 MIC 为 2-16 mg/L)([301])。
PK/PD 研究旨在评价监管机构确定的头孢他定 - 阿维巴坦对不同细菌敏感性截断点的预测性能 ([161])。在敏感铜绿假单胞菌菌株的情况下,结果一致,但当考虑到对临床试验中包括的几种抗生素耐药的菌株时,截断点受到挑战。认为该模型分析头孢他定 - 阿维巴坦抗耐药铜绿假单胞菌的活性不可靠,可能是因为这些菌株的耐药机制不能通过头孢他定加阿维巴坦逆转。
多项体外和体内 PK 研究评价了头孢他定 - 阿维巴坦对不同革兰阴性微生物的 PK/PD 参数。已证实至少 50% 给药间隔的 fT > MIC 可达到最大细菌杀灭 ([302])。对于在临床相关浓度下不具有抗菌活性的阿维巴坦,定义了达到充分抑制 β- 内酰胺酶以恢复头孢他定活性所需的最低游离阿维巴坦浓度(阈值浓度 [fCT])。估计的临界浓度阈值 (CT)≤0.15 mg/L([303])。在表达 AmpC 和 / 或 TEM-24 β- 内酰胺酶的头孢他定耐药铜绿假单胞菌的中性粒细胞减少小鼠肺和大腿感染模型中,avibactam 获得 40% 至 50% 的游离 T > CT 和 1 mg/L 的 fCT,超过了铜绿假单胞菌繁殖停滞暴露量 1 log10 kill 和 2 log10 kill 水平 ([300])。另一项体外研究评价了头孢他定 - 阿维巴坦对 18 铜绿假单胞菌分离株和 15 肠杆菌科分离株的杀菌活性,包括野生型分离株和产 ESBL、KPC 和 / 或 AmpC 酶的分离株 ([304])。第 6h,作者观察到对所有肠杆菌科分离株的时间依赖性和杀菌活性,对所有铜绿假单胞菌分离株的初始杀菌程度较低。第 24h,头孢他定 - 阿维巴坦没有任何杀菌活性,在两个物种中均检测到细菌再生长。
【Log10 (kill)=Log10 (control)-Log10 (test sample) > 6,Log10 (kill) 表示已经处理之微生物死亡值,Log10 (Control) 表示空白组中微生物之菌数,Log10 (Test) 表示试验组经处理后残余之存活菌数,6 代表空白组中有百万菌数,经处理后存活菌数不超过 1 个方能获的此结果依此公式,要符合真正的灭菌效果,必须将原有病菌数削减至原有菌数之百万分之一 (削减率:99.9999%)】
基于这一 PK/PD 目标,在群体 PK 模型中评价了达到目标的最佳剂量,推荐肾功能正常的患者采用 2/0.5 g 头孢他定 - 阿维巴坦,每 8h 一次静脉给药,持续 2h。选择的剂量允许使用头孢他定 - 阿维巴坦断点≤8/4 mg/L([305]) 实现针对肠杆菌科和铜绿假单胞菌分离株的 PK/PD 目标。这些头孢他定 - 阿维巴坦的群体 PK 模型是使用五项 III 期试验的 PK 数据建立的,这些试验的受试者是复杂的腹腔内感染、复杂的尿路感染和医院内(包括呼吸机相关)肺炎患者 ([306])。在 HFIM 以及中性粒细胞减少和免疫活性小鼠大腿感染模型中,在头孢他定 - 阿维巴坦 MIC 为 4 至 16 mg/L 的情况下,进一步验证了该临床剂量。
头孢他定 - 阿维巴坦治疗 MDR/XDR 铜绿假单胞菌感染的临床研究很少,且患者数量较少。使用的剂量为 2/0.5 g/8 h,有时开具复方制剂。治愈率接近 80%,大多数失败发生在呼吸道感染中。关于死亡率、微生物学根除、复发或出现耐药的信息有限 ([163],[308])。与此相关,令人担忧的是,在比较头孢他定 - 阿维巴坦与美罗培南治疗院内获得性肺炎的 III 期临床试验中,在 9/355 例 (2.5%) 微生物学可评价患者中鉴定出头孢他定 - 阿维巴坦耐药铜绿假单胞菌分离株 ([309])。
总之,体外研究表明头孢他定 - 阿维巴坦可能是治疗 MDR/XDR 铜绿假单胞菌感染的良好选择,但目前临床经验有限。根据潜在的耐药机制,头孢他定 - 阿维巴坦可能是一些 MDR/XDR 铜绿假单胞菌菌株的最佳选择,例如携带 A 类碳青霉烯酶(如 GES 酶)的菌株或某些 ESBLs 与 OprD 缺乏的组合 ([表 6])。需要更大序列的头孢他定 - 阿维巴坦治疗 MDR/XDR 铜绿假单胞菌感染的研究。
# 对能提供预后信息的 MDR/XDR 铜绿假单胞菌感染临床研究的关键评价
[表 4] 提供了包括 5 例或以上患者的临床研究总结,这些患者分析了采用不同全身抗生素方案治疗的 MDR/XDR 铜绿假单胞菌感染患者的预后。虽然一些研究仅涉及 MDR/XDR 铜绿假单胞菌感染,但许多其他研究将其与其他 MDR GNB 感染联合考虑,包括由鲍曼不动杆菌和 / 或肠杆菌科引起的感染。其中,只有那些特别详细说明 MDR/XDR 铜绿假单胞菌感染患者的任何预后的患者才包括在此,依据的是苏格兰校际指南网络 (SIGN) 方法(https://www.sign.ac.uk/methodology.html).
大多数出版物分析了接受粘菌素 ([180]-[188],[299],[300]) 和最近接受头孢洛扎 - 他唑巴坦 ([26],[62],[165],[281]-[287]) 治疗的患者。有一些文章是关于患者接受多粘菌素 B([207]-[209])、头孢他定 - 阿维巴坦 ([163],[308]) 和氨基糖苷类 ([250]) 或不同抗菌药联合治疗 ([203],[204],[206],[258])。总体而言,研究数量有限。
大多数是病例序列或队列的回顾性研究,具有这种类型设计的所有固有局限性,以及样本量较小。同时,大多数研究还有其他显著的局限性。首先,它们包括基线特征(年龄、合并症和免疫能力)、感染部位、多微生物感染百分比(通常未提供)和就诊时严重程度不同的患者,以及病原体敏感性(MDR 和 XDR 铜绿假单胞菌)和抗菌剂 MIC(通常未提供)的差异,根据患者肾功能不全的程度使用不同的抗菌药物剂量或调整剂量(尤其是黏菌素),延迟至有效治疗的时间,以计划外的方式使用不同的抗菌药物组合,初始(经验性和 / 或针对性)抗菌治疗失败后研究的抗生素使用情况、不同的治疗持续时间、关于来源控制的不同信息量或完全没有信息。尽管存在这种异质性,但预后通常以聚合形式呈现,使其难以解释。此外,在比较不同抗生素、剂量或抗生素组合的少数研究中,总是较小的样本量使得难以调整影响结果的所有其他变量。其次,纳入的研究未采用耐多药铜绿假单胞菌的统一定义。第三,在不同的研究中考虑的预后(临床和微生物学应答和死亡率)通常以不同的方式定义和 / 或在临床进展的不同时间点进行评价。在黏菌素和头孢洛扎 - 他唑巴坦的特殊情况下,另一个问题是不同的研究使用了不同的剂量,并有随时间推移而增加的趋势,这使得难以对出版物之间的结果进行比较。
如前所述,直到最近,粘菌素才是许多 MDR 铜绿假单胞菌感染病例的唯一替代方案。由于其治疗窗窄和发生率较高的肾毒性,以及尚未确定足够的剂量,该药物的使用很复杂。最近,头孢洛扎 - 他唑巴坦和头孢他定 - 阿维巴坦的上市代表了向前迈出的一大步,主要是因为它们对多种 MDR/XDR 铜绿假单胞菌菌株有效,且副作用有限。但是,难以使用已发表数据作为比较这些抗菌剂与粘菌素结果的基础。缺乏头孢他定 - 阿维巴坦的临床研究。对于头孢洛扎 - 他唑巴坦,一些临床研究允许进行一些比较。关于 28 天至 30 天的全因死亡率,3 项研究 ([181],[183],[192]) 中报告的粘菌素的比率为 32% 至 47%,4 项研究 ([26],[62],[281],[282]) 中报告的头孢洛扎 - 他唑巴坦的比率为 10% 至 28%。由于已经提到的研究的局限性,应该谨慎解释这些明显的差异。在使用头孢洛扎 - 他唑巴坦治疗期间出现耐药铜绿假单胞菌突变体尤其值得关注。这一事实支持在高剂量下使用头孢洛扎 - 他唑巴坦,最好是延长或持续输注,也提出了在难治和高接种物感染中联合抗生素的可能优势的问题,至少在治疗的最初几天。
几项研究阐述了联合治疗的潜在优势 ([203],[204],[206],[258]),并提出了可能的替代方案:延长或持续输注 β- 内酰胺类(在 MIC 被分类为中等)联合粘菌素,以及包括多利培南(中等 MIC)延长输注、磷霉素或黏菌素的不同联合双联疗法。在 3 项研究中,联合治疗的结果优于单药治疗 ([203],[204],[206])。然而,这些研究的局限性使得无法得出明确的结论。只有一项设计良好的临床试验解决了这个问题,比较了粘菌素 + 美罗培南联合用药与单独使用粘菌素 ([187])。不幸的是,该研究缺乏足够的效力来得出针对 MDR 铜绿假单胞菌的结论。
另一个方面,已有多篇文献发表,在呼吸道感染的情况下,吸入性与静脉内粘菌素给药或两者联合给药的可能有用性或优势。最近的两项荟萃分析在多耐药 GNB 患者中解决了这一问题 ([214],[215]),尽管这些研究未提供多耐药 / XDR 铜绿假单胞菌感染的具体结果。此处仅纳入明确详述 MDR 铜绿假单胞菌呼吸道感染患者预后的研究 ([199],[217])。从这些研究中无法得出确定性结论。这是治疗这些仍未解决的复杂感染的许多问题中的另一个。然而,基于其他 MDR GNB 感染的数据,雾化黏菌素似乎可作为治疗 MDR/XDR 铜绿假单胞菌呼吸道感染的辅助治疗。
考虑到所有综述的研究和数据,我们根据 MDR/XDR 铜绿假单胞菌最常见的耐药特征定义了一些一般治疗建议 ([表 6])。
# 具有抗 MDR/XDR 铜绿假单胞菌活性的在研药物
# 亚胺培南 - 瑞来巴坦
Relebactam (瑞来巴坦)是 A 类和 C 类 β- 内酰胺酶的活性 β- 内酰胺酶抑制剂 ([310]),与亚胺培南(加西司他丁)联合使用,可以恢复亚胺培南对耐药菌株包括产 AmpC 酶铜绿假单胞菌的活性 ([311])。1 项研究旨在评估亚胺培南释放杆菌巴坦对 21 家参与 SMART 项目的美国医院收集的 3,143 株非变形杆菌肠杆菌科细菌和铜绿假单胞菌的体外活性 ([312])。在所有检测的铜绿假单胞菌菌株中,94.4%(846/896) 对该抗生素敏感,而 74.7%(669/896) 对亚胺培南敏感。亚胺培南 - 瑞来巴坦复方制剂对耐亚胺培南铜绿假单胞菌菌株的体外活性为 78%,对 MDR 铜绿假单胞菌菌株的体外活性为 82.2%。只有黏菌素和阿米卡星的抗菌活性与亚胺培南 - 瑞来巴坦相似或更优。另一项研究评估了其体外对 ESKAPE(屎肠球菌、金黄色葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌和肠杆菌属)组菌株的活性,其中包括 MDR 铜绿假单胞菌 ([313])。亚胺培南 - 瑞来巴坦对 94%(796/845) 的铜绿假单胞菌有抗菌活性,而亚胺培南为 70.3%(594/845)。此外,这些耐亚胺培南微生物的 80.5% 菌株 (MIC90,16 μg/mL) 对亚胺培南释 - 瑞来巴坦敏感,MIC90 为 2 μg/mL。只有阿米卡星表现出与亚胺培南 - 瑞来巴坦相当的活性,敏感性为 95.6%。
一项双盲、I 期临床试验评价了单独使用或与亚胺培南 - 西司他丁联用时,relbactam 的药代动力学和安全性 ([314])。
在 25 至 1,150 mg 的剂量范围内单次给予瑞来巴坦后,终末半衰期 (t1/2) 介于 1.3 至 1.8h 之间,药代动力学与亚胺培南相似,支持以相同的输注频率与该抗生素联用。AUC 和 Cmax 随剂量呈指数方式增加。125-mg 的 relbactam 与亚胺培南同时给药时达到了 13.1 mg・h/l 的 AUC 目标,但是当 relbactam 作为单独的药物给药时,AUC 达到了更高的数值。当作为标准联合疗法或与 relrelebactam 联合给药时,亚胺培南 - 西司他丁的药代动力学相似。单次给予 125 mg 剂量的 relbactam 与 500 mg 亚胺培南,成人和老年女性中 relbactam 的 AUC 值分别比男性高 22% 和 25%。老年男性和女性的平均血药浓度比相应的成年男性组分别高 41% 和 45%。Relebactam 几乎完全经尿液排泄,单次给药后 24h 内,百分比范围为 94.7%-100%。所有研究组的亚胺培南 PK 参数相当。耐受性良好,嗜睡是最常见的不良反应。在研究 2 中,125 mg relbactam 与 500 mg 亚胺培南连续 7 天多次给药后,第 1 天和第 7 天的 t1/2 值相似,relbactam 没有蓄积。相同剂量的舒巴坦再次达到 AUC 目标 13.1 mg・h/l。同样,当以所述剂量给予化合物时,药物通常耐受良好。
一项 II 期临床试验评价了不同剂量的 relbactam 联合亚胺培南 - 西司他丁治疗复杂性腹腔内感染患者的情况 ([315])。
125 mg 和 250 mg 剂量的 relbactam 联合 500 mg 亚胺培南在铜绿假单胞菌感染患者中均显示出 100% 的微生物清除率。在总共 5 株亚胺培南耐药的铜绿假单胞菌中,有 3 株显示出对瑞来巴坦联合用药的敏感性。迄今为止,尚未发表有关亚胺培南 - 瑞来巴坦和 MDR/XDR 铜绿假单胞菌感染的临床经验。但是,考虑到其特性和抗菌活性,本药在不久的将来可能在 MDR/XDR 铜绿假单胞菌的治疗中发挥重要作用。
# 头孢地尔
头孢地尔是一种铁载体头孢菌素,对多种革兰阴性菌有效,包括对其他抗生素耐药的菌株 ([316])。头孢地尔通过与铁结合发挥作用,使其能够利用细菌铁转运蛋白穿透外部细菌膜。它对 β- 内酰胺酶,包括丝氨酸依赖性 β- 内酰胺酶和 MBL 也具有高度稳定性 ([317],[318])。已经研究了头孢地尔中和 AmpC 过量生成的能力、对这些酶的稳定性以及在阴沟肠杆菌和铜绿假单胞菌中诱导 AmpC 的能力 ([318])。虽然由于 AmpD 和 DacB 的灭活作用,头孢他定和头孢吡肟对 铜绿假单胞菌 PAO1 菌株的 MIC 增加了 4-16 倍,但头孢地尔 MIC 仅受到轻微影响。AmpC 灭活对这些抗生素 MIC 的影响非常有限。当研究对 AmpC 过量产生的影响时,观察到相似的结果。因此,头孢地尔对这些酶是非常稳定的头孢菌素。
另一项体外试验评价了头孢地尔对来自 52 个国家的 1873 株革兰氏阴性微生物临床分离株的活性 ([319])。共 262 株 MDRP。
铜绿假单胞菌暴露于各种抗生素;粘菌素和头孢地尔的 MIC90 值为 1 mg/L,而环丙沙星 > 8 mg/L,美罗培南、头孢吡肟、头孢他定 - 阿维巴坦和头孢洛扎 - 他唑巴坦 > 64 mg/L。当研究几种抗生素对 100 株亚胺培南耐药铜绿假单胞菌的活性时,也观察到相同结果 ([320])。头孢地尔的 MIC90 为 1 mg/L,在研究的所有抗假单胞菌抗生素中,该药的活性最强。
采用小鼠感染模型测定了该抗生素对不同铜绿假单胞菌菌株的 PK/PD 特征,头孢地尔 MIC 在 0.063-0.5 mg/L 范围内 ([321])。当计算不同菌株的 % fT > MIC 时,观察到在 166 mg/kg/8 h 剂量下,所有供试菌株达到治疗目标的概率为 100%。正在进行的临床试验和其他临床研究的结果正在等待,该药有望治疗 MDR/XDR 铜绿假单胞菌感染。
【cefiderocol 首个被批准的具有铁载体功能的抗生素,于 2019 年 11 月 14 日在美国获批(Fetroja)、2020 年 4 月在欧盟获批(Fetcroja),用于治疗选择有限或没有治疗选择的 18 岁及以上成人患者,治疗由易感革兰氏阴性菌导致的感染。cefiderocol 是一种新型铁载体头孢菌素,具有独特的穿透革兰氏阴性菌(包括多药耐药菌)细胞膜的作用机制,具有克服碳青霉烯耐药 3 种主要机制(孔蛋白通道改变、β- 内酰胺酶失活、外排泵过量产生)的独特能力。cefiderocol 与三价铁结合,并通过细菌铁转运蛋白,通过细胞膜外膜被主动运输至细菌细胞内。这种特洛伊木马策略允许 cefiderocol 在细菌细胞周质中达到更高的浓度,在周质空间中与青霉素结合蛋白结合并抑制细菌细胞壁的合成。来自 cefiderocol 多国监测研究的数据显示,cefiderocol 在体外对广谱需氧革兰氏阴性病原体(包括世界卫生组织列出的全部三种关键优先病原体:碳青霉烯类耐药鲍曼不动杆菌、铜绿假单胞菌、难治性耐碳青霉烯肠杆菌)以及嗜麦芽窄食单胞菌具有强效抑制作用。此外,cefiderocol 还对可产生多种耐药酶(如超广谱 β- 内酰胺酶 [ESBL],AmpCβ 内酰胺酶 [AmpC],丝氨酸碳青霉烯酶和金属碳青霉烯酶)的某些细菌具有强劲的体外抗菌活性。】
# Murepavadin
需要找到具有新作用机制的抗生素,已经产生了能够与磷脂和脂多糖组成的外部细菌膜相互作用的某些药物 ([322])。作为对该微生物具有特异性活性的拟肽抗生素,Murepavadin 能够与铜绿假单胞菌的膜蛋白 LptD 相互作用。因此,它将是第一个微生物特异性抗菌分子 ([323])。已经研究了 murepavadin 对 785 株 XDR 铜绿假单胞菌的活性,并与其他抗生素,如黏菌素、头孢洛扎 - 他唑巴坦和妥布霉素进行了比较 ([324])。这种抗生素的活性极好,因为它能在 < 2 mg/L 浓度下抑制 97.8% 研究的分离株,表现出比粘菌素高 8 倍的活性。
一项 I 期研究旨在评估健康志愿者中 0.05 mg/kg-4.5 mg/kg 单次给药后和 1 mg/kg-5 mg/kg 每 12h 一次多次给药后,Murepavadin 的 PK 行为 ([325])。最低多次给药的 AUC 范围为 12,500 ng・h/ml,最高剂量的 AUC 范围为 74,500 ng・h/ml,平均 t1/2 分别为 6.17 h 和 7.15 h。另一项研究比较了这种抗生素在不同程度肾功能患者中的 PK([326])。在肾功能最差(平均肌酐清除率为 25.5 mL/min)的患者与健康志愿者中,AUC 的平均值范围为 71.13 至 27.52 ng・h/ml,清除率的平均值范围为 2.4 至 7 l/h,t1/2 的平均值范围为 1.4 至 7.8 h,分布容积的平均值范围为 80.9 至 76.3 l。在健康志愿者中,该抗生素的 ELF / 血浆比值几乎为 1。
在一项呼吸机相关性肺炎患者的 II 期研究中,12 例确诊铜绿假单胞菌感染的患者中有 10 例患者使用 Murepavadin 达到临床治愈 ([327])。同样,死亡率为 8%,由于研究中纳入的患者数量较少,应谨慎解释该值。Murepavadin 是第一个微生物特异性抗假单胞菌分子,由于其优良的抗菌活性和 PK 数据,是一种有前景的治疗替代药物。
# 头孢吡肟 - 齐德巴坦
Zidebactam 与 avibactam 一样,是一种非 β- 内酰胺类药物,属于二氮杂双环辛烷类,对革兰氏阴性微生物的 PBP2 位点具有高亲和力以及对 β- 内酰胺酶抑制的能力高 ([328])。一项研究评估了齐德巴坦单药或联合头孢吡肟对包括 50 株铜绿假单胞菌在内的几种革兰氏阴性微生物的活性 ([329])。在 8 和 32 mg/L 浓度下,Zidebactam 对两株 NDM 阳性铜绿假单胞菌表现出活性。
对该药对 1291 株铜绿假单胞菌的体外行为进行了分析,其中 43 株 MDR 铜绿假单胞菌:10 株对头孢吡肟敏感,21 株 AmpC 酶或外排泵过表达,12 株产 MBL([330])。复方制剂对头孢吡肟敏感菌株的 MIC90 为 2 mg/L,而头孢吡肟为 4 mg/L。对于 AmpC 或外排泵过表达的菌株,1:1 组合的头孢吡肟 - 齐德巴坦 MIC 为 8 mg/L,而 2:1 组合的 MIC 为 16 mg/L,头孢吡肟和齐德巴坦单药的 MIC 分别为 64 mg/L 和 32 mg/L。最后,对于产 MBL 菌株,1:1 和 2:1 组合的 MIC 分别为 8 mg/L 和 16 mg/L。这些数值表明这种新抗生素对 MDR/XDR 铜绿假单胞菌具有非常高的体外活性。
一项研究评价了在健康志愿者中多次给予 2 g 头孢吡肟和 1 g zidebactam 的血浆和肺内药代动力学,还进行了安全性分析 ([331])。第 7 次给药后,头孢吡肟的平均血浆 PK 值为 Cmax 139.5 μg/mL 和 AUC 327.0 mg・h/l,而齐德巴坦的平均血浆 PK 值为 Cmax 60.0 mg/L 和 AUC 139.5 mg・h/l。给药后 1.25h,ELF 中头孢吡肟和齐德巴坦的平均浓度达到数值分别为 35.24 mg/L 和 14.61 mg/L,血浆 / ELF 比值为 2.41。在肺泡巨噬细胞中,头孢吡肟和齐德巴坦的最高平均浓度分别为 8h 时 16.99 mg/L 和 6h 时 2.06 mg/L。一名志愿者出现与药物相关的中度超敏反应。这些数据,连同这种新抗生素对 MDR/XDR 铜绿假单胞菌非常高的体外活性,将其定义为这些感染的一个极好的未来选择。
# 噬菌体
细菌噬菌体(Bacteriophages)是一个多世纪前开发出来的,但后来被抗生素所取代,这主要是因为细菌的活性经常限于特定菌株;然而,现在由于其对难治菌株的活性正在重新研究 ([332])。噬菌体治疗在东欧有特殊的地位,尤其是俄罗斯、格鲁吉亚和波兰。有关使用房室模型的有效性的经验有限。它们主要用于抗铜绿假单胞菌不同耐药菌株活性的混合物中,用于治疗感染,显示出有前景的结果,其中一些有待发表。
一篇综述显示,使用噬菌体治疗或预防铜绿假单胞菌感染的研究数量有限,大多数或所有研究均在囊性纤维化患者中开发并用作吸入治疗 ([333])。鉴于该人群中的一些感染是由 MDR 铜绿假单胞菌的粘液型菌株产生的,所用的噬菌体应具有抗生物膜产生菌株和非生物膜产生菌株的活性。活性抗生素和噬菌体的联合治疗可能是未来研究中应该评价的一种选择。一项研究使用体外模型和两种小鼠模型确定了 6 种噬菌体的组合对囊性纤维化患者中产生生物膜的 MDR 铜绿假单胞菌菌株的活性 ([334])。使用噬菌体鸡尾酒疗法的结果令人鼓舞,显示出噬菌体减少细菌负荷和生物膜形成的良好能力。这可能是局部治疗深部感染的有用策略,如 XDR 铜绿假单胞菌引起的骨和关节感染 ([335])。另一项研究基于从医院污水样本中分离出不同的铜绿假单胞菌噬菌体,尤其是 SL1、SL2 和 SL4([336])。5 株 MDR 铜绿假单胞菌受至少一个研究的噬菌体影响,未观察到细菌再生长。SL2 对浮游菌株的抗菌活性最高,而 SL4 对生物膜模型的抗菌活性最好。SL1 的生存率最高。然而,鸡尾酒疗法的活性并不优于活性最强的单独使用的杆状细胞。
吸入性抗生素的使用目前正在蔓延,一项研究旨在评价用于给予噬菌体 PEV44 的三种不同类型的雾化器,该雾化器对铜绿假单胞菌有效 ([337])。作者得出结论,Omron NE22 雾化器能最好地维持噬菌体的活性。在 MDR 铜绿假单胞菌引起的肺部感染小鼠模型中,评价吸入给予铜绿假单胞菌噬菌体的有效性和安全性 ([338])。结果证明,气管内给予噬菌体干粉显著降低了小鼠肺 MDR 铜绿假单胞菌的细菌负荷,对肺组织的损伤极小。
另一种治疗耐药微生物感染的策略是使用噬菌体联合抗生素 ([339])。已证实噬菌体和药物联合治疗优于每种药物各自的活性。在体外模型中研究了噬菌体 - 抗生素协同作用 (PAS),其中黏病毒科、普布那病毒属的噬菌体与多种抗生素表现出协同作用,在对铜绿假单胞菌有活性的情况下,与哌拉西林和头孢他定表现出协同作用 ([340])。
# 细菌素
细菌素是由一些细菌产生的具有抗菌活性的物质。有人提出,它们可以在临床上用于治疗多重耐药微生物引起的感染 ([341])。一项研究评估了由铜绿假单胞菌菌株产生的三种 R 型脓菌素(pyocins)对囊性纤维化患者铜绿假单胞菌临床分离株的活性 ([342])。这些物质显示出潜在的治疗活性,应在未来的临床研究中考虑。
# 对抗群体感应策略
群体感应分子是存在于多种微生物中的毒力机制的调节因子,包括 MDR/XDR 铜绿假单胞菌 ([343],[344])。这些调节因子也参与生物膜的形成和作为细胞群集体行为基础的基因表达的调节。通过抑制 MDR 细菌的致病性和生物膜形成,已经提出干扰这些分子作为 MDR 细菌的替代或辅助工具 ([345])。干扰群体感应的策略直接针对生物合成、积累和检测来自作为群体感应传播自诱导剂的小分子的信号 ([346])。抑制群体感应的策略包括干扰与 DNA 转录相关的转录因子以及一旦检测到群体感应的信号时对其实施干扰,就像成功用在铜绿假单胞菌的一样 ([347]),以及抑制不同细菌中与该过程相关的细菌酶,包括铜绿假单胞菌 ([348])。
# 疫苗和单克隆抗体
对抗 MDR/XDR 微生物感染的策略之一是使用疫苗或单克隆抗体,这是预防高危患者获得 MDR 铜绿假单胞菌感染的新型工具 ([349])。一些疫苗,如 IC43、KB001-A 和 KBPA-101,已经在重症患者中进行了检验 ([350])。一项在机械通气重症患者中进行的研究证实了该人群中 IC43 疫苗接种的免疫原性 ([351])。
在抗体方面,旨在中和毒力因子的新的作用靶点,如铜绿假单胞菌 III 型分泌系统 (TTSS) 正在用于单克隆抗体和疫苗的研发 ([352])。PcrV 是 TTSS 活性的必需蛋白质,主要作为靶标。一项研究的目的是开发通过作用于 PcrV 蛋白中和 TTSS 毒力的单克隆抗体 ([353])。在一项临床研究中,将 KB001-a(一种可抑制 PcrV 蛋白功能的聚乙二醇抗体)给予感染铜绿假单胞菌的囊性纤维化患者。虽然未达到临床疗效终点,但在这些患者中观察到调节感染和炎症的可能获益 ([354])。KBPA-101 是另一种从健康志愿者中获得的人单克隆抗体,给予其多糖结合疫苗与铜绿假单胞菌毒素 a([355])。该抗体在健康志愿者中呈线性药代动力学,无不良反应。因此,建议将来用作预防铜绿假单胞菌感染的替代方案 ([356])。另一种单克隆抗体 (V2L2MD) 在铜绿假单胞菌感染的几种小鼠模型中显示出非常好的预防性保护作用。在兔肺炎模型中,针对 PcrV 蛋白和 Psl 胞外多糖的选择性单克隆抗体 MEDI3902 对高致病性铜绿假单胞菌菌株表现出高度保护作用 ([357])。在另一项实验中观察到了这种保护活性,证明这种单克隆抗体对研究的大多数铜绿假单胞菌菌株的 PcrV 表位具有高特异性,并维持了其保护作用 ([358])。根据这些结果,在健康志愿者中开展了一项 I 期研究 ([359]),证实了这种药物的疗效和耐受性。
目前,该抗体已被纳入 II 期概念验证试验,用于评估铜绿假单胞菌定植患者的医院内肺炎预防 ([360])。
# 参考文献
Poole K. 2011. Pseudomonas aeruginosa: resistance to the max. Front Microbiol 2:65. doi: 10.3389/fmicb.2011.00065. 铜绿假单胞菌:最大耐药性。
Breidenstein EBM, de la Fuente-Núñez C, Hancock R. 2011. Pseudomonas aeruginosa: all roads lead to resistance. Trends Microbiol 19:419–426. doi: 10.1016/j.tim.2011.04.005. 铜绿假单胞菌:所有道路都导致耐药。
Oliver A, Mulet X, López-Causapé C, Juan C. 2015. The increasing threat of Pseudomonas aeruginosa high-risk clones. Drug Resist Updat 21–22:41–59. doi: 10.1016/j.drup.2015.08.002. 铜绿假单胞菌高危克隆的威胁越来越大。
Tacconelli E, Carrara E, Savoldi A, Harbarth S, Mendelson M, Monnet DL, Pulcini C, Kahlmeter G, Kluytmans J, Carmeli Y, Ouellette M, Outterson K, Patel J, Cavaleri M, Cox EM, Houchens CR, Grayson ML, Hansen P, Singh N, Theuretzbacher U, Magrini N, Aboderin AO, Al-Abri SS, Awang Jalil N, Benzonana N, Bhattacharya S, Brink AJ, Burkert FR, Cars O, Cornaglia G, Dyar OJ, Friedrich AW, Gales AC, Gandra S, Giske CG, Goff DA, Goossens H, Gottlieb T, Guzman Blanco M, Hryniewicz W, Kattula D, Jinks T, Kanj SS, Kerr L, Kieny M-P, Kim YS, Kozlov RS, Labarca J, Laxminarayan R, Leder K, Leibovici L, Levy-Hara G, Littman J, Malhotra-Kumar S, Manchanda V, Moja L, Ndoye B, Pan A, Paterson DL, Paul M, Qiu H, Ramon-Pardo P, Rodríguez-Baño J, Sanguinetti M, Sengupta S, Sharland M, Si-Mehand M, Silver LL, Song W, Steinbakk M, Thomsen J, Thwaites GE, van der Meer JW, Van Kinh N, Vega S, Villegas MV, Wechsler-Fördös A, Wertheim HFL, Wesangula E, Woodford N, Yilmaz FO, Zorzet A, WHO Pathogens Priority List Working Group. 2018. Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. Lancet Infect Dis 18:318–327. doi: 10.1016/S1473-3099(17)30753-3. 发现、研究和开发新型抗生素:WHO 抗生素耐药菌和结核病优先清单。
Pena C, Cabot G, Gomez-Zorrilla S, Zamorano L, Ocampo-Sosa A, Murillas J, Almirante B, Pomar V, Aguilar M, Granados A, Calbo E, Rodriguez-Bano J, Rodriguez-Lopez F, Tubau F, Martinez-Martinez L, Oliver A, Gurgui M, Sorde R, Larrosa N, Martin C, Fontanals D, de Cueto M, Navarro MD, Torre-Cisneros J, Casal M, Lara R, Natera C, Rivero A, Peña C, Cabot G, Gómez-Zorrilla S, Zamorano L, Ocampo-Sosa A, Murillas J, Almirante B, Pomar V, Aguilar M, Granados A, Calbo E, Rodríguez-Baño J, Rodríguez-López F, Tubau F, Martínez-Martínez L, Oliver A, Spanish Network for Research in Infectious Diseases (REIPI). 2015. Influence of virulence genotype and resistance profile in the mortality of Pseudomonas aeruginosa bloodstream infections. Clin Infect Dis 60:539–548. doi: 10.1093/cid/ciu866. 毒力基因型和耐药特征对铜绿假单胞菌血液感染死亡率的影响。
Walkty A, Lagace-Wiens P, Adam H, Baxter M, Karlowsky J, Mulvey MR, McCracken M, Zhanel GG. 2017. Antimicrobial susceptibility of 2906 Pseudomonas aeruginosa clinical isolates obtained from patients in Canadian hospitals over a period of 8 years: Results of the Canadian Ward surveillance study (CANWARD), 2008–2015. Diagn Microbiol Infect Dis 87:60–63. doi: 10.1016/j.diagmicrobio.2016.10.003. 8 年期间从加拿大医院患者中获得的 2906 株铜绿假单胞菌临床分离株的抗菌药物敏感性:2008 年 - 2015 年加拿大病房监测研究 (CANWARD) 的结果。
Sader HS, Castanheira M, Duncan LR, Flamm RK. 2018. Antimicrobial susceptibility of Enterobacteriaceae and Pseudomonas aeruginosa isolates from United States medical centers stratified by infection type: results from the International Network for Optimal Resistance Monitoring (INFORM) surveillance program. Diagn Microbiol Infect Dis 92:69–74. doi: 10.1016/j.diagmicrobio.2018.04.012. 根据感染类型分层的美国医疗中心肠杆菌科细菌和铜绿假单胞菌分离株的抗菌敏感性:来自国际最佳耐药监测网络 (INFORM) 监测计划的结果。
ECDC. 2015. Antimicrobial resistance surveillance in Europe 2015. Annual report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). European Centre for Disease Prevention and Control. 2015 年欧洲的抗微生物耐药性监测。
CDC. 2013. Antibiotic resistance threats in the United States, 2013. CDC, Atlanta, GA. 美国的抗生素耐药性威胁,2013。
Lister PD, Wolter DJ, Hanson ND. 2009. Antibacterial-resistant Pseudomonas aeruginosa: clinical impact and complex regulation of chromosomally encoded resistance mechanisms. Clin Microbiol Rev 22:582–610. doi: 10.1128/CMR.00040-09. 抗细菌耐药铜绿假单胞菌:染色体编码耐药机制的临床影响和复杂调节。
Skiada A, Markogiannakis A, Plachouras D, Daikos GL. 2011. Adaptive resistance to cationic compounds in Pseudomonas aeruginosa. Int J Antimicrob Agents 37:187–193. doi: 10.1016/j.ijantimicag.2010.11.019. 铜绿假单胞菌对阳离子化合物的适应性耐药。
Muller C, Plésiat P, Jeannot K. 2011. A two-component regulatory system interconnects resistance to polymyxins, aminoglycosides, fluoroquinolones, and β-lactams in Pseudomonas aeruginosa. Antimicrob Agents Chemother 55:1211–1221. doi: 10.1128/AAC.01252-10. 铜绿假单胞菌对多粘菌素、氨基糖苷类、氟喹诺酮类和 β- 内酰胺类的耐药性通过双组分调节系统相互连接。
Juan C, Torrens G, González-Nicolau M, Oliver A. 2017. Diversity and regulation of intrinsic β-lactamases from non-fermenting and other Gram-negative opportunistic pathogens. FEMS Microbiol Rev 41:781–815. doi: 10.1093/femsre/fux043. 非发酵和其他革兰氏阴性机会致病菌的内在 β- 内酰胺酶的多样性和调节。
Girlich D, Naas T, Nordmann P. 2004. Biochemical characterization of the naturally occurring oxacillinase OXA-50 of Pseudomonas aeruginosa. Antimicrob Agents Chemother 48:2043–2048. doi: 10.1128/AAC.48.6.2043-2048.2004. 铜绿假单胞菌天然存在的苯唑西林酶 OXA-50 的生化特征。
Kong K-F, Jayawardena SR, Del Puerto A, Wiehlmann L, Laabs U, Tümmler B, Mathee K. 2005. Characterization of poxB, a chromosomal-encoded Pseudomonas aeruginosa oxacillinase. Gene 358:82–92. doi: 10.1016/j.gene.2005.05.027. poxB 的特征,一种染色体编码的铜绿假单胞菌苯唑西林酶。
Fajardo A, Hernando-Amado S, Oliver A, Ball G, Filloux A, Martinez JL. 2014. Characterization of a novel Zn2+-dependent intrinsic imipenemase from Pseudomonas aeruginosa. J Antimicrob Chemother 69:2972–2978. doi: 10.1093/jac/dku267. 铜绿假单胞菌产生的一种新型的依赖于生理学的亚胺培南酶的特性。
Li X-Z, Plésiat P, Nikaido H. 2015. The challenge of efflux-mediated antibiotic resistance in Gram-negative bacteria. Clin Microbiol Rev 28:337–418. doi: 10.1128/CMR.00117-14. 革兰氏阴性细菌中流出液介导的抗生素耐药性的挑战。
Alvarez-Ortega C, Wiegand I, Olivares J, Hancock REW, Martinez JL. 2010. Genetic determinants involved in the susceptibility of Pseudomonas aeruginosa to beta-lactam antibiotics. Antimicrob Agents Chemother 54:4159–4167. doi: 10.1128/AAC.00257-10. 影响铜绿假单胞菌对 β- 内酰胺类抗生素敏感性的遗传决定因素。
Dötsch A, Becker T, Pommerenke C, Magnowska Z, Jänsch L, Häussler S. 2009. Genomewide identification of genetic determinants of antimicrobial drug resistance in Pseudomonas aeruginosa. Antimicrob Agents Chemother 53:2522–2531. doi: 10.1128/AAC.00035-09. 在全基因组范围内确定铜绿假单胞菌耐药性的遗传决定因素。
Cabot G, Ocampo-Sosa AA, Tubau F, Macia MD, Rodríguez C, Moya B, Zamorano L, Suárez C, Peña C, Martínez-Martínez L, Oliver A, Spanish Network for Research in Infectious Diseases (REIPI). 2011. Overexpression of AmpC and efflux pumps in Pseudomonas aeruginosa isolates from bloodstream infections: prevalence and impact on resistance in a Spanish multicenter study. Antimicrob Agents Chemother 55:1906–1911. doi: 10.1128/AAC.01645-10. 血液感染的铜绿假单胞菌分离株中 AmpC 和外排泵的过表达:一项西班牙多中心研究中患病率和对耐药性的影响。
Moya B, Dötsch A, Juan C, Blázquez J, Zamorano L, Haussler S, Oliver A. 2009. Beta-lactam resistance response triggered by inactivation of a nonessential penicillin-binding protein. PLoS Pathog 5:e1000353. doi: 10.1371/journal.ppat.1000353. 由非必需青霉素结合蛋白失活触发的 β 内酰胺耐药反应。
Juan C, Maciá MD, Gutiérrez O, Vidal C, Pérez JL, Oliver A. 2005. Molecular mechanisms of beta-lactam resistance mediated by AmpC hyperproduction in Pseudomonas aeruginosa clinical strains. Antimicrob Agents Chemother 49:4733–4738. doi: 10.1128/AAC.49.11.4733-4738.2005. 铜绿假单胞菌临床菌株中 AmpC 酶过度生成介导的 β- 内酰胺类抗生素耐药的分子机制。
Cabot G, Bruchmann S, Mulet X, Zamorano L, Moyà B, Juan C, Haussler S, Oliver A. 2014. Pseudomonas aeruginosa ceftolozane-tazobactam resistance development requires multiple mutations leading to overexpression and structural modification of AmpC. Antimicrob Agents Chemother 58:3091–3099. doi: 10.1128/AAC.02462-13. 假单胞菌对头孢洛扎 - 他唑巴坦产生耐药性需要多种突变,导致铜绿假单胞菌 pc 的过表达和结构修饰。
Lahiri SD, Alm RA. 2016. Identification of novel VEB β-lactamase enzymes and their impact on avibactam inhibition. Antimicrob Agents Chemother 60:3183–3186. doi: 10.1128/AAC.00047-16. 新型 VEBβ- 内酰胺酶的鉴定及其对 avibactam 抑制的影响。
Fraile-Ribot PA, Cabot G, Mulet X, Periañez L, Martín-Pena ML, Juan C, Pérez JL, Oliver A. 2018. Mechanisms leading to in vivo ceftolozane/tazobactam resistance development during the treatment of infections caused by MDR Pseudomonas aeruginosa. J Antimicrob Chemother 73:658–663. doi: 10.1093/jac/dkx424. 治疗多耐药铜绿假单胞菌引起的感染期间导致体内头孢洛扎 / 他唑巴坦耐药的机制。
Haidar G, Philips NJ, Shields RK, Snyder D, Cheng S, Potoski BA, Doi Y, Hao B, Press EG, Cooper VS, Clancy CJ, Nguyen MH. 2017. Ceftolozane-tazobactam for the treatment of multidrug-resistant Pseudomonas aeruginosa infections: clinical effectiveness and evolution of resistance. Clin Infect Dis 65:110–120. doi: 10.1093/cid/cix182. 头孢洛扎 - 他唑巴坦治疗多重耐药铜绿假单胞菌感染:临床有效性和耐药性演变。
Berrazeg M, Jeannot K, Ntsogo Enguéné VY, Broutin I, Loeffert S, Fournier D, Plésiat P. 2015. Mutations in β-lactamase AmpC increase resistance of Pseudomonas aeruginosa isolates to antipseudomonal cephalosporins. Antimicrob Agents Chemother 59:6248–6255. doi: 10.1128/AAC.00825-15. β- 内酰胺酶 AmpC 突变增加铜绿假单胞菌分离株对抗假单胞菌头孢菌素的耐药性。
Diaz Caballero J, Clark ST, Coburn B, Zhang Y, Wang PW, Donaldson SL, Tullis DE, Yau YCW, Waters VJ, Hwang DM, Guttman DS. 2015. Selective sweeps and parallel pathoadaptation drive Pseudomonas aeruginosa evolution in the cystic fibrosis lung. mBio 6:e00981-15. doi: 10.1128/mBio.00981-15. 选择性扫描和平行病理适应驱动囊性纤维化肺中铜绿假单胞菌的演变。
López-Causapé C, Sommer LM, Cabot G, Rubio R, Ocampo-Sosa AA, Johansen HK, Figuerola J, Cantón R, Kidd TJ, Molin S, Oliver A. 2017. Evolution of the Pseudomonas aeruginosa mutational resistome in an international cystic fibrosis clone. Sci Rep 7:5555. doi: 10.1038/s41598-017-05621-5. 国际囊性纤维化克隆中铜绿假单胞菌突变耐药组的演变。
Cabot G, López-Causapé C, Ocampo-Sosa AA, Sommer LM, Domínguez MÁ, Zamorano L, Juan C, Tubau F, Rodríguez C, Moyà B, Peña C, Martínez-Martínez L, Plesiat P, Oliver A. 2016. Deciphering the resistome of the widespread Pseudomonas aeruginosa sequence type 175 international high-risk clone through whole-genome sequencing. Antimicrob Agents Chemother 60:7415–7423. doi: 10.1128/AAC.01720-16. 通过全基因组测序破译广泛存在的铜绿假单胞菌序列 175 型国际高危克隆的抗性组。
del Barrio-Tofiño E, López-Causapé C, Cabot G, Rivera A, Benito N, Segura C, Montero MM, Sorlí L, Tubau F, Gómez-Zorrilla S, Tormo N, Durá-Navarro R, Viedma E, Resino-Foz E, Fernández-Martínez M, González-Rico C, Alejo-Cancho I, Martínez JA, Labayru-Echverria C, Dueñas C, Ayestarán I, Zamorano L, Martinez-Martinez L, Horcajada JP, Oliver A. 2017. Genomics and susceptibility profiles of extensively drug-resistant Pseudomonas aeruginosa isolates from Spain. Antimicrob Agents Chemother 61:e01589-17. doi: 10.1128/AAC.02352-17. 西班牙广泛耐药铜绿假单胞菌分离株的基因组学和敏感性特征。
Cabot G, Zamorano L, Moyà B, Juan C, Navas A, Blázquez J, Oliver A. 2016. Evolution of Pseudomonas aeruginosa antimicrobial resistance and fitness under low and high mutation rates. Antimicrob Agents Chemother 60:1767–1778. doi: 10.1128/AAC.02676-15. 低突变率和高突变率下铜绿假单胞菌耐药性和适合性的演变。
Cabot G, Florit-Mendoza L, Sánchez-Diener I, Zamorano L, Oliver A. 2018. Deciphering β-lactamase-independent β-lactam resistance evolution trajectories in Pseudomonas aeruginosa. J Antimicrob Chemother 73:3322–3331. doi: 10.1093/jac/dky364. 破译铜绿假单胞菌中不依赖 β- 内酰胺酶的 β- 内酰胺类抗生素耐药性的演变轨迹。
Han S, Zaniewski RP, Marr ES, Lacey BM, Tomaras AP, Evdokimov A, Miller JR, Shanmugasundaram V. 2010. Structural basis for effectiveness of siderophore-conjugated monocarbams against clinically relevant strains of Pseudomonas aeruginosa. Proc Natl Acad Sci U S A 107:22002–22007. doi: 10.1073/pnas.1013092107. 铁黄素共轭单碳酰胺对临床相关铜绿假单胞菌菌株有效性的结构基础。
Riera E, Cabot G, Mulet X, García-Castillo M, del Campo R, Juan C, Cantón R, Oliver A. 2011. Pseudomonas aeruginosa carbapenem resistance mechanisms in Spain: impact on the activity of imipenem, meropenem and doripenem. J Antimicrob Chemother 66:2022–2027. doi: 10.1093/jac/dkr232. 西班牙铜绿假单胞菌碳青霉烯类耐药机制:对亚胺培南、美罗培南和多利培南活性的影响。
Moyá B, Beceiro A, Cabot G, Juan C, Zamorano L, Alberti S, Oliver A. 2012. Pan-β-lactam resistance development in Pseudomonas aeruginosa clinical strains: molecular mechanisms, penicillin-binding protein profiles, and binding affinities. Antimicrob Agents Chemother 56:4771–4778. doi: 10.1128/AAC.00680-12. 铜绿假单胞菌临床菌株泛 β- 内酰胺耐药的发生:分子机制、青霉素结合蛋白特征和结合亲和力。
Hocquet D, Berthelot P, Roussel-Delvallez M, Favre R, Jeannot K, Bajolet O, Marty N, Grattard F, Mariani-Kurkdjian P, Bingen E, Husson M-O, Couetdic G, Plésiat P. 2007. Pseudomonas aeruginosa may accumulate drug resistance mechanisms without losing its ability to cause bloodstream infections. Antimicrob Agents Chemother 51:3531–3536. doi: 10.1128/AAC.00503-07. 铜绿假单胞菌可能在不丧失引起血液感染能力的情况下蓄积耐药机制。
Solé M, Fàbrega A, Cobos-Trigueros N, Zamorano L, Ferrer-Navarro M, Ballesté-Delpierre C, Reustle A, Castro P, Nicolás JM, Oliver A, Martínez JA, Vila J. 2015. In vivo evolution of resistance of Pseudomonas aeruginosa strains isolated from patients admitted to an intensive care unit: mechanisms of resistance and antimicrobial exposure. J Antimicrob Chemother 70:3004–3013. doi: 10.1093/jac/dkv228. 从重症监护室患者中分离出的铜绿假单胞菌菌株的耐药体内演变:耐药机制和抗生素暴露。
Guénard S, Muller C, Monlezun L, Benas P, Broutin I, Jeannot K, Plésiat P. 2014. Multiple mutations lead to MexXY-OprM-dependent aminoglycoside resistance in clinical strains of Pseudomonas aeruginosa. Antimicrob Agents Chemother 58:221–228. doi: 10.1128/AAC.01252-13. 多重突变导致铜绿假单胞菌临床菌株产生 MexXY-OprM 依赖性氨基糖苷类耐药。
Köhler T, Epp SF, Curty LK, Pechère JC. 1999. Characterization of MexT, the regulator of the MexE-MexF-OprN multidrug efflux system of Pseudomonas aeruginosa. J Bacteriol 181:6300–6305. 铜绿假单胞菌 MexE-MexF-OprN 多药外排系统的调节因子 MexT 的特征
Mulet X, Moyá B, Juan C, Macià MD, Pérez JL, Blázquez J, Oliver A. 2011. Antagonistic interactions of Pseudomonas aeruginosa antibiotic resistance mechanisms in planktonic but not biofilm growth. Antimicrob Agents Chemother 55:4560–4568. doi: 10.1128/AAC.00519-11. 铜绿假单胞菌抗生素耐药性机制在浮游生物而非生物膜生长中的拮抗相互作用。
Bruchmann S, Dötsch A, Nouri B, Chaberny IF, Häussler S. 2013. Quantitative contributions of target alteration and decreased drug accumulation to Pseudomonas aeruginosa fluoroquinolone resistance. Antimicrob Agents Chemother 57:1361–1368. doi: 10.1128/AAC.01581-12. 靶标改变和药物蓄积减少对铜绿假单胞菌氟喹诺酮耐药性的定量贡献。
Feng Y, Jonker MJ, Moustakas I, Brul S, ter Kuile BH. 2016. Dynamics of mutations during development of resistance by Pseudomonas aeruginosa against five antibiotics. Antimicrob Agents Chemother 60:4229–4236. doi: 10.1128/AAC.00434-16. 铜绿假单胞菌对五种抗生素产生耐药性期间的突变动力学。
López-Causapé C, Cabot G, Del Barrio-Tofiño E, Oliver A. 2018. The versatile mutational resistome of Pseudomonas aeruginosa. Front Microbiol 9:685. doi: 10.3389/fmicb.2018.00685. 铜绿假单胞菌的多功能突变抗性组。
Greipel L, Fischer S, Klockgether J, Dorda M, Mielke S, Wiehlmann L, Cramer N, Tümmler B. 2016. Molecular epidemiology of mutations in antimicrobial resistance loci of Pseudomonas aeruginosa isolates from airways of cystic fibrosis patients. Antimicrob Agents Chemother 60:6726–6734. doi: 10.1128/AAC.00724-16. 囊性纤维化患者气道铜绿假单胞菌分离株耐药基因突变的分子流行病学研究。
Bolard A, Plésiat P, Jeannot K. 2017. Mutations in Gene fusA1 as a novel mechanism of aminoglycoside resistance in clinical strains of Pseudomonas aeruginosa. Antimicrob Agents Chemother 62:e01835-17. doi: 10.1128/AAC.01835-17. 铜绿假单胞菌临床菌株氨基糖苷类耐药的新机制:基因 fusA1 突变。
Olaitan AO, Morand S, Rolain J-M. 2014. Mechanisms of polymyxin resistance: acquired and intrinsic resistance in bacteria. Front Microbiol 5:643. doi: 10.3389/fmicb.2014.00643. 多粘菌素耐药性的机制:细菌的获得性和固有耐药性。
Gutu AD, Sgambati N, Strasbourger P, Brannon MK, Jacobs MA, Haugen E, Kaul RK, Johansen HK, Høiby N, Moskowitz SM. 2013. Polymyxin resistance of Pseudomonas aeruginosa phoQ mutants is dependent on additional two-component regulatory systems. Antimicrob Agents Chemother 57:2204–2215. doi: 10.1128/AAC.02353-12. 铜绿假单胞菌 phoQ 突变体的多粘菌素耐药性取决于其他的双组分调节系统。
Patel G, Bonomo RA. 2011. Status report on carbapenemases: challenges and prospects. Expert Rev Anti Infect Ther 9:555–570. doi: 10.1586/eri.11.28. 碳青霉烯酶的现状报告:挑战和前景。
Juan C, Conejo MC, Tormo N, Gimeno C, Pascual Á, Oliver A. 2013. Challenges for accurate susceptibility testing, detection and interpretation of β-lactam resistance phenotypes in Pseudomonas aeruginosa: results from a Spanish multicentre study. J Antimicrob Chemother 68:619–630. doi: 10.1093/jac/dks439. 铜绿假单胞菌 β- 内酰胺类药物耐药表型的准确药敏试验、检测和解释的挑战:来自西班牙多中心研究的结果。
Diene SMM, Rolain J-M. 2014. Carbapenemase genes and genetic platforms in Gram-negative bacilli: Enterobacteriaceae, Pseudomonas and Acinetobacter species. Clin Microbiol Infect 20:831–838. doi: 10.1111/1469-0691.12655. 革兰氏阴性杆菌中的碳青霉烯酶基因和遗传平台:肠杆菌科、假单胞菌和不动杆菌属。
van der Zee A, Kraak WB, Burggraaf A, Goessens WHF, Pirovano W, Ossewaarde JM, Tommassen J. 2018. Spread of carbapenem resistance by transposition and conjugation among Pseudomonas aeruginosa. Front Microbiol 9:2057. doi: 10.3389/fmicb.2018.02057. 铜绿假单胞菌通过转位和共轭作用传播碳青霉烯类耐药。
Botelho J, Grosso F, Quinteira S, Mabrouk A, Peixe L. 2017. The complete nucleotide sequence of an IncP-2 megaplasmid unveils a mosaic architecture comprising a putative novel blaVIM-2-harbouring transposon in Pseudomonas aeruginosa. J Antimicrob Chemother 72:2225–2229. doi: 10.1093/jac/dkx143. IncP-2 巨型形体质粒的全核苷酸序列揭示了包含假定的铜绿假单胞菌中新型 blaVIM-2 携带转铁蛋白的嵌合体结构。
Botelho J, Grosso F, Peixe L. 2018. Unravelling the genome of a Pseudomonas aeruginosa isolate belonging to the high-risk clone ST235 reveals an integrative conjugative element housing a blaGES-6 carbapenemase. J Antimicrob Chemother 73:77–83. doi: 10.1093/jac/dkx337. 解开属于高危克隆 ST235 的铜绿假单胞菌分离株的基因组,发现包含 blaGES-6 碳青霉烯酶的整合接合元件。
Potron A, Poirel L, Nordmann P. 2015. Emerging broad-spectrum resistance in Pseudomonas aeruginosa and Acinetobacter baumannii: mechanisms and epidemiology. Int J Antimicrob Agents 45:568–585. doi: 10.1016/j.ijantimicag.2015.03.001. 铜绿假单胞菌和鲍曼不动杆菌新出现的广谱耐药:机制和流行病学。
del Barrio-Tofiño E, Zamorano L, Cortes-Lara S, López-Causapé C, Sánchez-Diener I, Cabot G, Bou G, Martínez-Martínez L, Oliver A, Galán F, Gracia I, Rodríguez MA, Martín L, Sánchez JM, Viñuela L, García MV, Lepe JA, Aznar J, López-Hernández I, Seral C, Javier Castillo-García F, López-Calleja AI, Aspiroz C, de la Iglesia P, Ramón S, Riera E, Cruz Pérez M, Gallegos C, Calvo J, Dolores Quesada M, Marco F, Hoyos Y, Pablo Horcajada J, Larrosa N, González JJ, Tubau F, Capilla S, Pérez-Moreno MO, Centelles MJ, Padilla E, Rivera A, Mirelis B, Elisa Rodríguez-Tarazona R, Arenal-Andrés N, del Pilar Ortega M, Megías G, García I, Colmenarejo C, González JC, Martínez NM, Gomila B, Giner S, Tormo N, Garduño E, Agulla JA, Seoane A, Pita J, Vidal IP, Guzmán DM, García M, Pérez del Molino ML, Barbeito G, Artiles F, Azcona-Gutiérrez JM, Sáenz Y, Antonio Oteo J, González A, Villa J, Chaves F, Cercenado E, Alarcón T, Zurita ND, Merino I, Morosini MI, Cantón R, Isabel Sánchez M, Moreno L, Yagüe G, Leiva J, Luis Barrios J, Canut A, Oteo J. 2019. Spanish nationwide survey on Pseudomonas aeruginosa antimicrobial resistance mechanisms and epidemiology. J Antimicrob Chemother 74:1825–1835. doi: 10.1093/jac/dkz147. 西班牙全国铜绿假单胞菌抗生素耐药机制和流行病学调查。
Chávez-Jacobo VM, Hernández-Ramírez KC, Romo-Rodríguez P, Pérez-Gallardo RV, Campos-García J, Gutiérrez-Corona JF, García-Merinos JP, Meza-Carmen V, Silva-Sánchez J, Ramírez-Díaz MI. 2018. CrpP is a novel ciprofloxacin-modifying enzyme encoded by the Pseudomonas aeruginosa pUM505 plasmid. Antimicrob Agents Chemother 62:e02629-17. doi: 10.1128/AAC.02629-17. CrpP 是一种新型环丙沙星修饰酶,由铜绿假单胞菌 pUM505 质粒编码。
Moya B, Zamorano L, Juan C, Perez JL, Ge Y, Oliver A. 2010. Activity of a new cephalosporin, CXA-101 (FR264205), against β-lactam-resistant Pseudomonas aeruginosa mutants selected in vitro and after antipseudomonal treatment of intensive care unit patients. Antimicrob Agents Chemother 54:1213–1217. doi: 10.1128/AAC.01104-09. 一种新型头孢菌素 CXA-101 (FR264205) 对重症监护室患者体外和抗假单胞菌治疗后选择的 β- 内酰胺耐药铜绿假单胞菌突变株的活性。
Torrens G, Cabot G, Ocampo-Sosa AA, Conejo MC, Zamorano L, Navarro F, Pascual Á, Martínez-Martínez L, Oliver A. 2016. Activity of ceftazidime-avibactam against clinical and isogenic laboratory Pseudomonas aeruginosa isolates expressing combinations of most relevant β-lactam resistance mechanisms. Antimicrob Agents Chemother 60:6407–6410. doi: 10.1128/AAC.01282-16. 头孢他啶 - 阿维巴坦对表达最相关 β- 内酰胺类耐药机制组合的临床和等基因实验室铜绿假单胞菌分离株的活性。
Sanz-García F, Hernando-Amado S, Martínez JL. 2018. Mutation-driven evolution of Pseudomonas aeruginosa in the presence of either ceftazidime or ceftazidime-avibactam. Antimicrob Agents Chemother 62:e01379-18. doi: 10.1128/AAC.01379-18. 存在头孢他啶或头孢他啶 - 阿维巴坦时铜绿假单胞菌的突变驱动演变。
Recio R, Villa J, Viedma E, Orellana MÁ, Lora-Tamayo J, Chaves F. 2018. Bacteraemia due to extensively drug-resistant Pseudomonas aeruginosa sequence type 235 high-risk clone: facing the perfect storm. Int J Antimicrob Agents 52:172–179. doi: 10.1016/j.ijantimicag.2018.03.018. 广泛耐药铜绿假单胞菌 235 型序列高危克隆导致的菌血症:面临完美风暴。
Díaz-Cañestro M, Periañez L, Mulet X, Martin-Pena ML, Fraile-Ribot PA, Ayestarán I, Colomar A, Nuñez B, Maciá M, Novo A, Torres V, Asensio J, López-Causapé C, Delgado O, Pérez JL, Murillas J, Riera M, Oliver A. 2018. Ceftolozane/tazobactam for the treatment of multidrug resistant Pseudomonas aeruginosa: experience from the Balearic Islands. Eur J Clin Microbiol Infect Dis 37:2191–2200. doi: 10.1007/s10096-018-3361-0. 头孢洛扎 / 他唑巴坦治疗多药耐药铜绿假单胞菌:来自巴利阿里群岛的经验。
Fraile-Ribot PA, Mulet X, Cabot G, del Barrio-Tofiño E, Juan C, Pérez JL, Oliver A. 2017. In vivo emergence of resistance to novel cephalosporin–β-lactamase inhibitor combinations through the duplication of amino acid D149 from OXA-2 β-lactamase (OXA-539) in sequence type 235 Pseudomonas aeruginosa. Antimicrob Agents Chemother 61:e01117-17. doi: 10.1128/AAC.01117-17. 通过在铜绿假单胞菌 235 型序列中复制 OXA-2β- 内酰胺酶 (OXA-539) 的 D149 氨基酸,体内出现对新型头孢菌素 -β- 内酰胺酶抑制剂组合的耐药性。
Magiorakos A-P, Srinivasan A, Carey RB, Carmeli Y, Falagas ME, Giske CG, Harbarth S, Hindler JF, Kahlmeter G, Olsson-Liljequist B, Paterson DL, Rice LB, Stelling J, Struelens MJ, Vatopoulos A, Weber JT, Monnet DL. 2012. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect 18:268–281. doi: 10.1111/j.1469-0691.2011.03570.x. 多重耐药、广泛耐药和泛耐药细菌:获得性耐药中期标准定义的国际专家提议。
Souli M, Galani I, Giamarellou H. 2008. Emergence of extensively drug-resistant and pandrug-resistant Gram-negative bacilli in Europe. Euro Surveill 13:19045. doi: 10.2807/ese.13.47.19045-en. 在欧洲出现广泛耐药和泛耐药的革兰氏阴性杆菌。
Viedma E, Juan C, Acosta J, Zamorano L, Otero JR, Sanz F, Chaves F, Oliver A. 2009. Nosocomial spread of colistin-only-sensitive sequence type 235 Pseudomonas aeruginosa isolates producing the extended-spectrum beta-lactamases GES-1 and GES-5 in Spain. Antimicrob Agents Chemother 53:4930–4933. doi: 10.1128/AAC.00900-09. 西班牙产超广谱 β- 内酰胺酶 GES-1 和 GES-5 的黏菌素唯一敏感序列 235 型铜绿假单胞菌分离株的院内传播。
Livermore DM, Meunier D, Hopkins KL, Doumith M, Hill R, Pike R, Staves P, Woodford N. 2018. Activity of ceftazidime/avibactam against problem Enterobacteriaceae and Pseudomonas aeruginosa in the UK, 2015–16. J Antimicrob Chemother 73:648–657. doi: 10.1093/jac/dkx438. 英国头孢他啶 / 阿维巴坦对问题肠杆菌科细菌和铜绿假单胞菌的活性,2015–16。
Giani T, Arena F, Pollini S, Di Pilato V, D’Andrea MM, Henrici De Angelis L, Bassetti M, Rossolini GM, Vismara C, Luzzaro F, Cavallo R, Dusi PA, Pagani E, Sarti M, Farina C, Rigoli R, Scarparo C, Pecile P, Cusi MG, Mencacci A, Manso E, Spanu T, Labonia M, Tassi V, Amato G, Stefani S, Giraldi C, Rassu M. 2018. Italian nationwide survey on Pseudomonas aeruginosa from invasive infections: activity of ceftolozane/tazobactam and comparators, and molecular epidemiology of carbapenemase producers. J Antimicrob Chemother 73:664–671. doi: 10.1093/jac/dkx453. 意大利全国侵袭性感染的铜绿假单胞菌调查:头孢洛扎 / 他唑巴坦和对照药物的活性和碳青霉烯酶产生者的分子流行病学。
Flamm RK, Farrell DJ, Sader HS, Jones RN. 2014. Ceftazidime/avibactam activity tested against Gram-negative bacteria isolated from bloodstream, pneumonia, intra-abdominal and urinary tract infections in US medical centres (2012). J Antimicrob Chemother 69:1589–1598. doi: 10.1093/jac/dku025. 在美国医疗中心,检测头孢他啶 / 阿维巴坦对从血流、肺炎、腹腔内和尿路感染中分离的革兰氏阴性细菌的活性(2012 年)。
Evans SR, Tran TTT, Hujer AM, Hill CB, Hujer KM, Mediavilla JR, Manca C, Domitrovic TN, Perez F, Farmer M, Pitzer KM, Wilson BM, Kreiswirth BN, Patel R, Jacobs MR, Chen L, Fowler VG, Chambers HF, Bonomo RA, Antibacterial Resistance Leadership Group (ARLG). 2018. Rapid molecular diagnostics to inform empiric use of ceftazidime/avibactam and ceftolozane/tazobactam against Pseudomonas aeruginosa: PRIMERS IV. Clin Infect Dis doi: 10.1093/cid/ciy801. 快速分子诊断告知经验性使用头孢他啶 / 阿维巴坦和头孢洛扎 / 他唑巴坦治疗铜绿假单胞菌:PRIMERS IV。
Woodford N, Turton JF, Livermore DM. 2011. Multiresistant Gram-negative bacteria: the role of high-risk clones in the dissemination of antibiotic resistance. FEMS Microbiol Rev 35:736–755. doi: 10.1111/j.1574-6976.2011.00268.x. 多重耐药革兰氏阴性菌:高危克隆在抗生素耐药性传播中的作用。
Cabot G, Ocampo-Sosa AA, Domínguez MA, Gago JF, Juan C, Tubau F, Rodríguez C, Moyà B, Peña C, Martínez-Martínez L, Oliver A, Spanish Network for Research in Infectious Diseases (REIPI). 2012. Genetic markers of widespread extensively drug-resistant Pseudomonas aeruginosa high-risk clones. Antimicrob Agents Chemother 56:6349–6357. doi: 10.1128/AAC.01388-12. 广泛耐药铜绿假单胞菌高危克隆的遗传标记。
Mulet X, Cabot G, Ocampo-Sosa AA, Domínguez MA, Zamorano L, Juan C, Tubau F, Rodríguez C, Moyà B, Peña C, Martínez-Martínez L, Oliver A, Spanish Network for Research in Infectious Diseases (REIPI). 2013. Biological markers of Pseudomonas aeruginosa epidemic high-risk clones. Antimicrob Agents Chemother 57:5527–5535. doi: 10.1128/AAC.01481-13. 铜绿假单胞菌流行高危克隆的生物学标记。
Croughs PD, Klaassen CHW, van Rosmalen J, Maghdid DM, Boers SA, Hays JP, Goessens WHF, Dutch Antibiotic Resistance Surveillance Group. 2018. Unexpected mechanisms of resistance in Dutch Pseudomonas aeruginosa isolates collected during 14 years of surveillance. Int J Antimicrob Agents 52:407–410. doi: 10.1016/j.ijantimicag.2018.05.009. 14 年监测期间收集的荷兰铜绿假单胞菌分离株的非预期耐药机制。
Castanheira M, Deshpande LM, Costello A, Davies TA, Jones RN. 2014. Epidemiology and carbapenem resistance mechanisms of carbapenem-non-susceptible Pseudomonas aeruginosa collected during 2009-11 in 14 European and Mediterranean countries. J Antimicrob Chemother 69:1804–1814. doi: 10.1093/jac/dku048. 2009-11 期间在 14 个欧洲和地中海国家收集的对碳青霉烯类不敏感的铜绿假单胞菌的流行病学和碳青霉烯类耐药机制。
Cholley P, Thouverez M, Hocquet D, van der Mee-Marquet N, Talon D, Bertrand X. 2011. Most multidrug-resistant Pseudomonas aeruginosa isolates from hospitals in eastern France belong to a few clonal types. J Clin Microbiol 49:2578–2583. doi: 10.1128/JCM.00102-11. 法国东部医院的大多数多药耐药铜绿假单胞菌分离株属于少数克隆类型。
Guzvinec M, Izdebski R, Butic I, Jelic M, Abram M, Koscak I, Baraniak A, Hryniewicz W, Gniadkowski M, Tambic Andrasevic A. 2014. Sequence types 235, 111, and 132 predominate among multidrug-resistant pseudomonas aeruginosa clinical isolates in Croatia. Antimicrob Agents Chemother 58:6277–6283. doi: 10.1128/AAC.03116-14. 在克罗地亚,多重耐药铜绿假单胞菌临床分离株的主要序列类型是 235、111 和 132。
Mano Y, Saga T, Ishii Y, Yoshizumi A, Bonomo RA, Yamaguchi K, Tateda K. 2015. Molecular analysis of the integrons of metallo-β-lactamase-producing Pseudomonas aeruginosa isolates collected by nationwide surveillance programs across Japan. BMC Microbiol 15:41. doi: 10.1186/s12866-015-0378-8. 日本全国监测项目收集的产金属 β- 内酰胺酶铜绿假单胞菌分离株整合子的分子分析。
Treepong P, Kos VN, Guyeux C, Blanc DS, Bertrand X, Valot B, Hocquet D. 2018. Global emergence of the widespread Pseudomonas aeruginosa ST235 clone. Clin Microbiol Infect 24:258–266. doi: 10.1016/j.cmi.2017.06.018. 广泛存在的铜绿假单胞菌 ST235 克隆在全球出现。
Chen Y, Sun M, Wang M, Lu Y, Yan Z. 2014. Dissemination of IMP-6-producing Pseudomonas aeruginosa ST244 in multiple cities in China. Eur J Clin Microbiol Infect Dis 33:1181–1187. doi: 10.1007/s10096-014-2063-5. IMP-6 产生菌铜绿假单胞菌 ST244 在中国多个城市的传播。
Petitjean M, Martak D, Silvant A, Bertrand X, Valot B, Hocquet D. 2017. Genomic characterization of a local epidemic Pseudomonas aeruginosa reveals specific features of the widespread clone ST395. Microb Genomics 3:e000129. doi: 10.1099/mgen.0.000129. 局部流行性铜绿假单胞菌的基因组分析显示了广泛克隆 ST395 的特异性特征。
Abdouchakour F, Aujoulat F, Licznar-Fajardo P, Marchandin H, Toubiana M, Parer S, Lotthé A, Jumas-Bilak E. 2018. Intraclonal variations of resistance and phenotype in Pseudomonas aeruginosa epidemic high-risk clone ST308: a key to success within a hospital? Int J Med Microbiol 308:279–289. doi: 10.1016/j.ijmm.2017.11.008. 铜绿假单胞菌流行高危克隆 ST308 的耐药和表型的克隆内变异:医院内获得成功的关键?国际医学微生物学 308:279–289。
Kos VN, Déraspe M, McLaughlin RE, Whiteaker JD, Roy PH, Alm RA, Corbeil J, Gardner H. 2015. The resistome of Pseudomonas aeruginosa in relationship to phenotypic susceptibility. Antimicrob Agents Chemother 59:427–436. doi: 10.1128/AAC.03954-14. 铜绿假单胞菌的耐药组与表型敏感性的关系。
Jaillard M, van Belkum A, Cady KC, Creely D, Shortridge D, Blanc B, Barbu EM, Dunne WM, Zambardi G, Enright M, Mugnier N, Le Priol C, Schicklin S, Guigon G, Veyrieras J-B. 2017. Correlation between phenotypic antibiotic susceptibility and the resistome in Pseudomonas aeruginosa. Int J Antimicrob Agents 50:210–218. doi: 10.1016/j.ijantimicag.2017.02.026. 铜绿假单胞菌表型抗生素敏感性与耐药组的相关性。
Juan C, Peña C, Oliver A. 2017. Host and pathogen biomarkers for severe Pseudomonas aeruginosa infections. J Infect Dis 215:S44–S51. doi: 10.1093/infdis/jiw299. 重度铜绿假单胞菌感染的宿主和病原体生物标志物。
Gómez-Zorrilla S, Juan C, Cabot G, Camoez M, Tubau F, Oliver A, Dominguez MA, Ariza J, Peña C. 2016. Impact of multidrug resistance on the pathogenicity of Pseudomonas aeruginosa: in vitro and in vivo studies. Int J Antimicrob Agents 47:368–374. doi: 10.1016/j.ijantimicag.2016.02.010. 多药耐药对铜绿假单胞菌致病性的影响:体外和体内研究。
Sánchez-Diener I, Zamorano L, López-Causapé C, Cabot G, Mulet X, Peña C, del Campo R, Cantón R, Doménech-Sánchez A, Martínez-Martínez L, Arcos SC, Navas A, Oliver A. 2017. Interplay among resistance profiles, high-risk clones, and virulence in the Caenorhabditis elegans Pseudomonas aeruginosa infection model. Antimicrob Agents Chemother 61:e01586-17. doi: 10.1128/AAC.01586-17. 铜绿假单胞菌感染模型中耐药性特征、高危克隆和毒力之间的相互作用。
Lee J-Y, Peck KR, Ko KS. 2013. Selective advantages of two major clones of carbapenem-resistant Pseudomonas aeruginosa isolates (CC235 and CC641) from Korea: antimicrobial resistance, virulence and biofilm-forming activity. J Med Microbiol 62:1015–1024. doi: 10.1099/jmm.0.055426-0. 韩国耐碳青霉烯类铜绿假单胞菌分离株(CC235 和 CC641)的两个主要克隆的选择性优势:抗微生物耐药性、毒力和生物膜形成活性。
Turton JF, Wright L, Underwood A, Witney AA, Chan Y-T, Al-Shahib A, Arnold C, Doumith M, Patel B, Planche TD, Green J, Holliman R, Woodford N. 2015. High-resolution analysis by whole-genome sequencing of an international lineage (sequence type 111) of Pseudomonas aeruginosa associated with metallo-carbapenemases in the United Kingdom. J Clin Microbiol 53:2622–2631. doi: 10.1128/JCM.00505-15. 通过全基因组测序对与英国金属碳青霉烯酶相关的铜绿假单胞菌国际谱系(序列类型 111)进行高分辨率分析。
Witney AA, Gould KA, Pope CF, Bolt F, Stoker NG, Cubbon MD, Bradley CR, Fraise A, Breathnach AS, Butcher PD, Planche TD, Hinds J. 2014. Genome sequencing and characterization of an extensively drug-resistant sequence type 111 serotype O12 hospital outbreak strain of Pseudomonas aeruginosa. Clin Microbiol Infect 20:O609–O618. doi: 10.1111/1469-0691.12528. 广泛耐药序列 111 型 oserotype 12 医院暴发铜绿假单胞菌菌株的基因组测序和鉴定。
Paterson DL, Rice LB. 2003. Empirical antibiotic choice for the seriously ill patient: are minimization of selection of resistant organisms and maximization of individual outcome mutually exclusive?. Clin Infect Dis 36:1006–1012. doi: 10.1086/374243. 危重患者的经验性抗生素选择:最大限度地减少耐药菌的选择和最大限度地提高个体结果互斥?
Guillamet CV, Vazquez R, Noe J, Micek ST, Kollef MH. 2016. A cohort study of bacteremic pneumonia. Medicine (Baltimore, MD) 95:e4708. doi: 10.1097/MD.0000000000004708. 菌血症性肺炎的队列研究。
Kang C, Kim S, Kim H, Park S, Choe Y, Oh M, Kim E, Choe K. 2003. Pseudomonas aeruginosa bacteremia: risk factors for mortality and influence of delayed receipt of effective antimicrobial therapy on clinical outcome. Clin Infect Dis 37:745–751. doi: 10.1086/377200. 铜绿假单胞菌菌血症:死亡的危险因素以及延迟接受有效抗菌治疗对临床结局的影响。
Micek ST, Lloyd AE, Ritchie DJ, Reichley RM, Fraser VJ, Kollef MH. 2005. Pseudomonas aeruginosa bloodstream infection: importance of appropriate initial antimicrobial treatment. Antimicrob Agents Chemother 49:1306–1311. doi: 10.1128/AAC.49.4.1306-1311.2005. 铜绿假单胞菌血液感染:适当的初始抗菌治疗的重要性。
Lodise TP, Patel N, Kwa A, Graves J, Furuno JP, Graffunder E, Lomaestro B, McGregor JC. 2007. Predictors of 30-day mortality among patients with Pseudomonas aeruginosa bloodstream infections: impact of delayed appropriate antibiotic selection. Antimicrob Agents Chemother 51:3510–3515. doi: 10.1128/AAC.00338-07. 铜绿假单胞菌血液感染患者 30 天死亡率的预测因素:延迟适当抗生素选择的影响。
Park S-Y, Park HJ, Moon SM, Park K-H, Chong YP, Kim M-N, Kim S-H, Lee S-O, Kim YS, Woo JH, Choi S-H. 2012. Impact of adequate empirical combination therapy on mortality from bacteremic Pseudomonas aeruginosa pneumonia. BMC Infect Dis 12:308. doi: 10.1186/1471-2334-12-308. 充分的经验性联合治疗对菌血症性铜绿假单胞菌肺炎死亡率的影响。
Hirsch EB, Tam VH. 2010. Impact of multidrug-resistant Pseudomonas aeruginosa infection on patient outcomes. Expert Rev Pharmacoecon Outcomes Res 10:441–451. doi: 10.1586/erp.10.49. 多重耐药铜绿假单胞菌感染对患者结局的影响。
Gómez-Zorrilla S, Morandeira F, Castro MJ, Tubau F, Periche E, Cañizares R, Dominguez MA, Ariza J, Peña C. 2017. Acute inflammatory response of patients with Pseudomonas aeruginosa infections: a prospective study. Microb Drug Resist 23:523–530. doi: 10.1089/mdr.2016.0144. 铜绿假单胞菌感染患者的急性炎症反应:一项前瞻性研究。
Planquette B, Timsit JF, Misset BY, Schwebel C, Azoulay E, Adrie C, Vesin A, Jamali S, Zahar JR, Allaouchiche B, Souweine B, Darmon M, Dumenil AS, Goldgran-Toledano D, Mourvillier BH, Bédos JP. 2013. Pseudomonas aeruginosa ventilator-associated pneumonia: predictive factors of treatment failure. Am J Respir Crit Care Med 188:69–76. doi: 10.1164/rccm.201210-1897OC. 铜绿假单胞菌呼吸机相关性肺炎:治疗失败的预测因素。
Kaminski C, Timsit JF, Dubois Y, Zahar JR, Garrouste-Orgeas M, Vesin A, Azoulay E, Feger C, Dumenil AS, Adrie C, Cohen Y, Allaouchiche B. 2011. Impact of ureido/carboxypenicillin resistance on the prognosis of ventilator-associated pneumonia due to Pseudomonas aeruginosa. Crit Care 15:R112. doi: 10.1186/cc10136. 尿苷酸 / 羧基青霉素耐药对铜绿假单胞菌引起的呼吸机相关性肺炎预后的影响。
Arvanitis M, Anagnostou T, Kourkoumpetis TK, Ziakas PD, Desalermos A, Mylonakis E. 2014. The impact of antimicrobial resistance and aging in VAP outcomes: experience from a large tertiary care center. PLoS One 9:e89984-17. doi: 10.1371/journal.pone.0089984. 抗生素耐药和老龄化对 VAP 结局的影响:来自大型三级医疗中心的经验。
Blot S, Vandewoude K, De Bacquer D, Colardyn F. 2002. Nosocomial bacteremia caused by antibiotic-resistant gram-negative bacteria in critically ill patients: clinical outcome and length of hospitalization. Clin Infect Dis 34:1600–1606. doi: 10.1086/340616. 重症患者中抗生素耐药性革兰氏阴性菌引起的院内菌血症:临床结局和住院时间。
Klevens RM, Edwards JR, Gaynes RP. 2008. The impact of antimicrobial‐resistant, health care–associated infections on mortality in the United States. Clin Infect Dis 47:927–930. doi: 10.1086/591698. 美国抗菌素耐药性医疗保健相关感染对死亡率的影响。
Vardakas KZ, Rafailidis PI, Konstantelias AA, Falagas ME. 2013. Predictors of mortality in patients with infections due to multi-drug resistant Gram negative bacteria: the study, the patient, the bug or the drug? J Infect 66:401–414. doi: 10.1016/j.jinf.2012.10.028. 多重耐药革兰氏阴性菌感染患者的死亡率预测因素:研究、患者、细菌或药物?J 感染 66:401–414。
Neidell MJ, Cohen B, Furuya Y, Hill J, Jeon CY, Glied S, Larson EL. 2012. Costs of healthcare-and community-associated infections with antimicrobial-resistant versus antimicrobial-susceptible organisms. Clin Infect Dis 55:807–815. doi: 10.1093/cid/cis552. 抗生素耐药与抗生素敏感微生物的医疗保健和社区相关感染的成本。
Cosgrove SE. 2006. The relationship between antimicrobial resistance and patient outcomes: mortality, length of hospital stay, and health care costs. Clin Infect Dis 42:S82–S89. doi: 10.1086/499406. 抗生素耐药性与患者结局:死亡率、住院时间和医疗保健费用之间的关系。
Peña C, Gómez-Zorrilla S, Oriol I, Tubau F, Dominguez MA, Pujol M, Ariza J. 2013. Impact of multidrug resistance on Pseudomonas aeruginosa ventilator-associated pneumonia outcome: predictors of early and crude mortality. Eur J Clin Microbiol Infect Dis 32:413–420. doi: 10.1007/s10096-012-1758-8. 多重耐药对铜绿假单胞菌呼吸机相关性肺炎结局的影响:早期和粗死亡率的预测因素。
McCarthy KL, Wailan AM, Jennison AV, Kidd TJ, Paterson DL. 2018. P. aeruginosa blood stream infection isolates: a “full house” of virulence genes in isolates associated with rapid patient death and patient survival. Microb Pathog 119:81–85. doi: 10.1016/j.micpath.2018.03.062. 铜绿假单胞菌血流感染分离株:与患者快速死亡和患者存活相关的分离株中毒力基因的 “全院”。
Gómez-Zorrilla S, Camoez M, Tubau F, Periche E, Cañizares R, Dominguez MA, Ariza J, Peña C. 2014. Antibiotic pressure is a major risk factor for rectal colonization by multidrug-resistant Pseudomonas aeruginosa in critically ill patients. Antimicrob Agents Chemother 58:5863–5870. doi: 10.1128/AAC.03419-14. 抗生素压力是重症患者多重耐药铜绿假单胞菌直肠定植的主要风险因素。
Peña C, Gómez-Zorrilla S, Suarez C, Dominguez MA, Tubau F, Arch O, Oliver A, Pujol M, Ariza J. 2012. Extensively drug-resistant Pseudomonas aeruginosa: risk of bloodstream infection in hospitalized patients. Eur J Clin Microbiol Infect Dis 31:2791–2797. doi: 10.1007/s10096-012-1629-3. 广泛耐药铜绿假单胞菌:住院患者血流感染的风险。
Peña C, Suarez C, Gozalo M, Murillas J, Almirante B, Pomar V, Aguilar M, Granados A, Calbo E, Rodríguez-Baño J, Rodríguez F, Tubau F, Martínez-Martínez L, Oliver A, Spanish Network for Research in Infectious Diseases (REIPI). 2012. Prospective multicenter study of the impact of carbapenem resistance on mortality in Pseudomonas aeruginosa bloodstream infections. Antimicrob Agents Chemother 56:1265–1272. doi: 10.1128/AAC.05991-11. 前瞻性多中心研究碳青霉烯类耐药对铜绿假单胞菌血液感染死亡率的影响。
McCarthy KL, Paterson DL. 2017. Long-term mortality following Pseudomonas aeruginosa bloodstream infection. J Hosp Infect 95:292–299. doi: 10.1016/j.jhin.2016.11.014. 铜绿假单胞菌血液感染后的长期死亡率。
Andersson DI. 2006. The biological cost of mutational antibiotic resistance: any practical conclusions? Curr Opin Microbiol 9:461–465. doi: 10.1016/j.mib.2006.07.002. 突变抗生素耐药性的生物学成本:任何实际结论?Curr Opin Microbiol 9:461–465。
Andersson DI, Hughes D. 2010. Antibiotic resistance and its cost: is it possible to reverse resistance? Nat Rev Microbiol 8:260–271. doi: 10.1038/nrmicro2319. 抗生素耐药性及其成本:逆转耐药性有可能吗?非修订版微生物 8:260–271。
Olivares Pacheco J, Alvarez-Ortega C, Alcalde Rico M, Martínez JL. 2017. Metabolic compensation of fitness costs is a general outcome for antibiotic-resistant Pseudomonas aeruginosa mutants overexpressing efflux pumps. mBio 8:e00500-17. doi: 10.1128/mBio.00500-17. 适应性成本的代谢补偿是过表达外排泵的抗生素耐药性铜绿假单胞菌突变体的一般结局。
Sun Z, Jiao X, Peng Q, Jiang F, Huang Y, Zhang J, Yao F. 2013. Antibiotic resistance in Pseudomonas aeruginosa is associated with decreased fitness. Cell Physiol Biochem 31:347–354. doi: 10.1159/000343372. 铜绿假单胞菌的抗生素耐药性与适应性下降有关。
Deptuła A, Gospodarek E. 2010. Reduced expression of virulence factors in multidrug-resistant Pseudomonas aeruginosa strains. Arch Microbiol 192:79–84. doi: 10.1007/s00203-009-0528-1. 多重耐药铜绿假单胞菌菌株中毒力因子的表达降低。
Skurnik D, Roux D, Cattoir V, Danilchanka O, Lu X, Yoder-Himes DR, Han K, Guillard T, Jiang D, Gaultier C, Guerin F, Aschard H, Leclercq R, Mekalanos JJ, Lory S, Pier GB. 2013. Enhanced in vivo fitness of carbapenem-resistant oprD mutants of Pseudomonas aeruginosa revealed through high-throughput sequencing. Proc Natl Acad Sci U S A 110:20747–20752. doi: 10.1073/pnas.1221552110. 高通量测序显示,铜绿假单胞菌耐碳青霉烯类 oprD 突变体的体内适应性增强。
Suárez C, Peña C, Gavaldà L, Tubau F, Manzur A, Dominguez MA, Pujol M, Gudiol F, Ariza J. 2010. Influence of carbapenem resistance on mortality and the dynamics of mortality in Pseudomonas aeruginosa bloodstream infection. Int J Infect Dis 14(Suppl 3):e73–e78. doi: 10.1016/j.ijid.2009.11.019. 碳青霉烯类耐药对铜绿假单胞菌血液感染死亡率和死亡率动态的影响。
Agnello M, Finkel SE, Wong-Beringer A. 2016. Fitness cost of fluoroquinolone resistance in clinical isolates of Pseudomonas aeruginosa differs by type III secretion genotype. Front Microbiol 7:907–912. doi: 10.3389/Ffmicb.2016.01591. 铜绿假单胞菌临床分离株对氟喹诺酮类耐药的适合成本因 III 型分泌基因型而异。
Engel J, Balachandran P. 2009. Role of Pseudomonas aeruginosa type III effectors in disease. Curr Opin Microbiol 12:61–66. doi: 10.1016/j.mib.2008.12.007. 铜绿假单胞菌 III 型效应物在疾病中的作用。
El-Solh AA, Hattemer A, Hauser AR, Alhajhusain A, Vora H. 2012. Clinical outcomes of type III Pseudomonas aeruginosa bacteremia. Crit Care Med 40:1157–1163. doi: 10.1097/CCM.0b013e3182377906. III 型铜绿假单胞菌菌血症的临床结局。
Hauser AR. 2014. Pseudomonas aeruginosa virulence and antimicrobial resistance: two sides of the same coin? Crit Care Med 42:201–202. doi: 10.1097/CCM.0b013e3182a120cd. 铜绿假单胞菌的毒力和耐药性:同一枚硬币的两面?重症医学 42:201–202。
Reboud E, Elsen S, Bouillot S, Golovkine G, Basso P, Jeannot K, Attrée I, Huber P. 2016. Phenotype and toxicity of the recently discovered exlA-positive Pseudomonas aeruginosa strains collected worldwide. Environ Microbiol 18:3425–3439. doi: 10.1111/1462-2920.13262. 最近发现的全球收集的 exlA 阳性铜绿假单胞菌菌株的表型和毒性。
Wood TL, Wood TK. 2016. The HigB/HigA toxin/antitoxin system of Pseudomonas aeruginosa influences the virulence factors pyochelin, pyocyanin, and biofilm formation. Microbiologyopen 5:499–511. doi: 10.1002/mbo3.346. 铜绿假单胞菌的 HigB/HigA 毒素 / 抗毒素系统影响毒力因子 pyochelin、绿脓素和生物膜形成。
Giamarellos-Bourboulis EJ, Koussoulas V, Panagou C, Adamis T, Baziaka F, Skiadas I, Perrea D, Dionyssiou-Asteriou A, Giamarellou H. 2004. Experimental sepsis using Pseudomonas aeruginosa: the significance of multi-drug resistance. Int J Antimicrob Agents 24:357–361. doi: 10.1016/j.ijantimicag.2004.03.025. 使用铜绿假单胞菌的实验性败血症:多重耐药的意义。
Giamarellos-Bourboulis EJ, Tzepi I, Tsovolou I, Spyridaki A, Tsaganos T, Vaki I, Kotsaki A, Polychronopoulos V. 2011. Impact of multidrug resistance on experimental empyema by Pseudomonas aeruginosa. Respiration 82:46–53. doi: 10.1159/000326893. 多药耐药对铜绿假单胞菌实验性脓胸的影响。
Giamarellos-Bourboulis EJ, Plachouras D, Tzivra A, Kousoulas V, Bolanos N, Raftogiannis M, Galani I, Dontas I, Dionyssiou-Asteriou A, Giamarellou H. 2004. Stimulation of innate immunity by susceptible and multidrug-resistant Pseudomonas aeruginosa: an in vitro and in vivo study. Clin Exp Immunol 135:240–246. doi: 10.1111/j.1365-2249.2003.02365.x. 敏感和多药耐药铜绿假单胞菌刺激先天免疫:体外和体内研究。
Abdelraouf K, Kabbara S, Ledesma KR, Poole K, Tam VH. 2011. Effect of multidrug resistance-conferring mutations on the fitness and virulence of Pseudomonas aeruginosa. J Antimicrob Chemother 66:1311–1317. doi: 10.1093/jac/dkr105. 多药耐药突变对铜绿假单胞菌适应性和毒力的影响。
Gómez-Zorrilla S, Camoez M, Tubau F, Cañizares R, Periche E, Dominguez MA, Ariza J, Peña C. 2015. Prospective observational study of prior rectal colonization status as a predictor for subsequent development of Pseudomonas aeruginosa clinical infections. Antimicrob Agents Chemother 59:5213–5219. doi: 10.1128/AAC.04636-14. 既往直肠定植状态作为铜绿假单胞菌临床感染后续发展预测因素的前瞻性观察性研究。
Di Pasquale M, Ferrer M, Esperatti M, Crisafulli E, Giunta V, Li Bassi G, Rinaudo M, Blasi F, Niederman M, Torres A. 2014. Assessment of severity of ICU-acquired pneumonia and association with etiology. Crit Care Med 42:303–312. doi: 10.1097/CCM.0b013e3182a272a2. 评估 ICU 获得性肺炎的严重程度及其与病因的相关性。
Drusano GL, Louie A, MacGowan A, Hope W. 2015. Suppression of emergence of resistance in pathogenic bacteria: keeping our powder dry, part 1. Antimicrob Agents Chemother 60:1183–1193. doi: 10.1128/AAC.02177-15. 抑制病原菌耐药性的产生:保持粉末干燥,第 1 部分。
Drusano GL. 2017. Pre-clinical in vitro infection models. Curr Opin Pharmacol 36:100–106. doi: 10.1016/j.coph.2017.09.011. 临床前体外感染模型。
Zusman O, Avni T, Leibovici L, Adler A, Friberg L, Stergiopoulou T, Carmeli Y, Paul M. 2013. Systematic review and meta-analysis of in vitro synergy of polymyxins and carbapenems. Antimicrob Agents Chemother 57:5104–5111. doi: 10.1128/AAC.01230-13. 多粘菌素和碳青霉烯类药物体外协同作用的系统综述和荟萃分析。
Petrosillo N, Ioannidou E, Falagas ME. 2008. Colistin monotherapy vs. combination therapy: evidence from microbiological, animal and clinical studies. Clin Microbiol Infect 14:816–827. doi: 10.1111/j.1469-0691.2008.02061.x. 粘菌素单药治疗 vs.
Gunderson BW, Ibrahim KH, Hovde LB, Fromm TL, Reed MD, Rotschafer JC. 2003. Synergistic activity of colistin and ceftazidime against multiantibiotic-resistant Pseudomonas aeruginosa in an in vitro pharmacodynamic model. Antimicrob Agents Chemother 47:905–909. doi: 10.1128/AAC.47.3.905-909.2003. 在体外药效学模型中,粘菌素和头孢他啶对多抗生素耐药性铜绿假单胞菌的协同作用。
Timurkaynak F, Can F, Azap OK, Demirbilek M, Arslan H, Karaman SO. 2006. In vitro activities of non-traditional antimicrobials alone or in combination against multidrug-resistant strains of Pseudomonas aeruginosa and Acinetobacter baumannii isolated from intensive care units. Int J Antimicrob Agents 27:224–228. doi: 10.1016/j.ijantimicag.2005.10.012. 非传统抗菌药物单用或联用对重症监护室分离的铜绿假单胞菌和鲍氏不动杆菌多重耐药菌株的体外活性。
Drusano GL, Bonomo RA, Bahniuk N, Bulitta JB, VanScoy B, DeFiglio H, Fikes S, Brown D, Drawz SM, Kulawy R, Louie A. 2012. Resistance emergence mechanism and mechanism of resistance suppression by tobramycin for cefepime for Pseudomonas aeruginosa. Antimicrob Agents Chemother 56:231–242. doi: 10.1128/AAC.05252-11. 妥布霉素对头孢吡肟抑制铜绿假单胞菌耐药性的产生机制和机制。
Almarzoky Abuhussain SS, Kuti JL, Nicolau DP. 2018. Antibacterial activity of human simulated epithelial lining fluid concentrations of ceftazidime-avibactam alone or in combination with amikacin inhale (BAY41-6551) against carbapenem-resistant Pseudomonas aeruginosa and Klebsiella pneumoniae. Antimicrob Agents Chemother 62:e00113-18. doi: 10.1128/AAC.00113-18. 头孢他啶 - 阿维巴坦单药或联合阿米卡星吸入 (BAY41-6551) 的人体模拟上皮衬液浓度对碳青霉烯类耐药铜绿假单胞菌和肺炎克雷伯菌的抗菌活性。
Bergen PJ, Tsuji BT, Bulitta JB, Forrest A, Jacob J, Sidjabat HE, Paterson DL, Nation RL, Li J. 2011. Synergistic killing of multidrug-resistant Pseudomonas aeruginosa at multiple inocula by colistin combined with doripenem in an in vitro pharmacokinetic/pharmacodynamic model. Antimicrob Agents Chemother 55:5685–5695. doi: 10.1128/AAC.05298-11. 在体外药代动力学 / 药效学模型中,粘菌素联合多利培南在多次接种时协同杀灭多药耐药铜绿假单胞菌。
Bergen PJ, Forrest A, Bulitta JB, Tsuji BT, Sidjabat HE, Paterson DL, Li J, Nation RL. 2011. Clinically relevant plasma concentrations of colistin in combination with imipenem enhance pharmacodynamic activity against multidrug-resistant Pseudomonas aeruginosa at multiple inocula. Antimicrob Agents Chemother 55:5134–5142. doi: 10.1128/AAC.05028-11. 多菌灵联合亚胺培南的临床相关血浆浓度增强了多次接种时抗多药耐药铜绿假单胞菌的药效学活性。
Mohamed AF, Kristoffersson AN, Karvanen M, Nielsen EI, Cars O, Friberg LE. 2016. Dynamic interaction of colistin and meropenem on a WT and a resistant strain of Pseudomonas aeruginosa as quantified in a PK/PD model. J Antimicrob Chemother 71:1279–1290. doi: 10.1093/jac/dkv488. 粘菌素和美罗培南对 WT 和耐药铜绿假单胞菌菌株的动态相互作用,在 PK/PD 模型中定量。
Louie A, Grasso C, Bahniuk N, Van Scoy B, Brown DL, Kulawy R, Drusano GL. 2010. The combination of meropenem and levofloxacin is synergistic with respect to both Pseudomonas aeruginosa kill rate and resistance suppression. Antimicrob Agents Chemother 54:2646–2654. doi: 10.1128/AAC.00065-10. 美罗培南和左氧氟沙星联合用药在杀灭铜绿假单胞菌和抑制耐药性方面具有协同作用。
Safarika A, Galani I, Pistiki A, Giamarellos-Bourboulis EJ. 2015. Time–kill effect of levofloxacin on multidrug-resistant Pseudomonas aeruginosa and Acinetobacter baumannii: synergism with imipenem and colistin. Eur J Clin Microbiol Infect Dis 34:317–323. doi: 10.1007/s10096-014-2231-7. 左氧氟沙星对多重耐药铜绿假单胞菌和鲍曼不动杆菌的时间 - 杀灭作用:与亚胺培南和黏菌素的协同作用。
Rees VE, Yadav R, Rogers KE, Bulitta JB, Wirth V, Oliver A, Boyce JD, Peleg AY, Nation RL, Landersdorfer CB. 2018. Meropenem combined with ciprofloxacin combats hypermutable Pseudomonas aeruginosa from respiratory infections of cystic fibrosis patients. Antimicrob Agents Chemother 62:e01150-18. doi: 10.1128/AAC.01150-18. 美罗培南联合环丙沙星治疗囊性纤维化患者呼吸道感染的高变铜绿假单胞菌。
Lin Y-W, Yu HH, Zhao J, Han M-L, Zhu Y, Akter J, Wickremasinghe H, Walpola H, Wirth V, Rao GG, Forrest A, Velkov T, Li J. 2018. Polymyxin B in combination with enrofloxacin exerts synergistic killing against extensively drug-resistant Pseudomonas aeruginosa. Antimicrob Agents Chemother 62:e00028-18. doi: 10.1128/AAC.00028-18. 多粘菌素 B 联合恩诺沙星对广泛耐药的铜绿假单胞菌发挥协同杀伤作用。
Sime FB, Johnson A, Whalley S, Santoyo-Castelazo A, Montgomery AB, Walters KA, Lipman J, Hope WW, Roberts JA. 2017. Pharmacodynamics of aerosolized fosfomycin and amikacin against resistant clinical isolates of Pseudomonas aeruginosa and Klebsiella pneumoniae in a hollow-fiber infection model: experimental basis for combination therapy. Antimicrob Agents Chemother 61:e01763-16. doi: 10.1128/AAC.01763-16. 磷霉素和阿米卡星雾化液在中空纤维感染模型中抗铜绿假单胞菌和肺炎克雷伯菌耐药临床分离株的药效学:联合治疗的实验基础。
Lister PD, Sanders WE, Sanders CC. 1998. Cefepime-aztreonam: a unique double beta-lactam combination for Pseudomonas aeruginosa. Antimicrob Agents Chemother 42:1610–1619. doi: 10.1128/AAC.42.7.1610. 头孢吡肟 - 氨曲南:铜绿假单胞菌的独特双 β- 内酰胺复方制剂。
Boucher HW, Talbot GH, Benjamin DK, Bradley J, Guidos RJ, Jones RN, Murray BE, Bonomo RA, Gilbert D. 2013. 10 x ’20 progress—development of new drugs active against Gram-negative bacilli: an update from the Infectious Diseases Society of America. Clin Infect Dis 56:1685–1694. doi: 10.1093/cid/cit152. 10 x'20 进展 - 抗革兰氏阴性杆菌新药的开发:美国传染病学会的更新。
Buehrle DJ, Shields RK, Chen L, Hao B, Press EG, Alkrouk A, Potoski BA, Kreiswirth BN, Clancy CJ, Nguyen MH. 2016. Evaluation of the in vitro activity of ceftazidime-avibactam and ceftolozane-tazobactam against meropenem-resistant Pseudomonas aeruginosa isolates. Antimicrob Agents Chemother 60:3227–3231. doi: 10.1128/AAC.02969-15. 评价头孢他啶 - 阿维巴坦和头孢洛扎 / 他唑巴坦对美罗培南耐药铜绿假单胞菌分离株的体外活性。
Craig WA, Andes DR. 2013. In vivo activities of ceftolozane, a new cephalosporin, with and without tazobactam against Pseudomonas aeruginosa and Enterobacteriaceae, including strains with extended-spectrum β-lactamases, in the thighs of neutropenic mice. Antimicrob Agents Chemother 57:1577–1582. doi: 10.1128/AAC.01590-12. 新型头孢菌素头孢洛扎加或不加他唑巴坦对中性粒细胞减少小鼠大腿中铜绿假单胞菌和肠杆菌科细菌(包括超广谱 β- 内酰胺酶菌株)的体内活性。
Farrell DJ, Flamm RK, Sader HS, Jones RN. 2013. Antimicrobial activity of ceftolozane-tazobactam tested against Enterobacteriaceae and Pseudomonas aeruginosa with various resistance patterns isolated in U.S. hospitals (2011–2012). Antimicrob Agents Chemother 57:6305–6310. doi: 10.1128/AAC.01802-13. 测试了头孢洛扎 - 他唑巴坦对肠杆菌科细菌和铜绿假单胞菌的抗菌活性,具有在 S. 医院分离的各种耐药模式(2011-2012 年)。
VanScoy BD, Mendes RE, Castanheira M, McCauley J, Bhavnani SM, Jones RN, Friedrich LV, Steenbergen JN, Ambrose PG. 2014. Relationship between ceftolozane-tazobactam exposure and selection for Pseudomonas aeruginosa resistance in a hollow-fiber infection model. Antimicrob Agents Chemother 58:6024–6031. doi: 10.1128/AAC.02310-13. 中空纤维感染模型中头孢洛扎 - 他唑巴坦暴露与铜绿假单胞菌耐药性选择之间的关系。
Rico Caballero V, Almarzoky Abuhussain S, Kuti JL, Nicolau DP. 2018. Efficacy of human-simulated exposures of ceftolozane-tazobactam alone and in combination with amikacin or colistin against multidrug-resistant Pseudomonas aeruginosa in an in vitro pharmacodynamic model. Antimicrob Agents Chemother 62:e02384-17. doi: 10.1128/AAC.02384-17. 在体外药效学模型中,人类模拟的头孢洛扎 - 他唑巴坦单药暴露和联合阿米卡星或黏菌素对多重耐药铜绿假单胞菌的有效性。
Noel AR, Bowker KE, Attwood M, MacGowan AP. 2018. Antibacterial effect of ceftolozane/tazobactam in combination with amikacin against aerobic Gram-negative bacilli studied in an in vitro pharmacokinetic model of infection. J Antimicrob Chemother 73:2411–2417. doi: 10.1093/jac/dky225. 在体外感染药代动力学模型中研究了头孢洛扎 / 他唑巴坦联合阿米卡星对需氧革兰阴性杆菌的抗菌作用。
Gomez-Junyent J, Benavent E, Sierra Y, El Haj C, Soldevila L, Torrejon B, Rigo-Bonnin R, Tubau F, Ariza J, Murillo O. 2019. Efficacy of ceftolozane/tazobactam, alone and in combination with colistin, against multidrug-resistant Pseudomonas aeruginosa in an in vitro biofilm pharmacodynamic model. Int J Antimicrob Agents 53:612–619. doi: 10.1016/j.ijantimicag.2019.01.010. 在体外生物膜药效学模型中,头孢洛扎 / 他唑巴坦单独用药和与黏菌素联合用药对多重耐药铜绿假单胞菌的疗效。
Montero M, VanScoy BD, López-Causapé C, Conde H, Adams J, Segura C, Zamorano L, Oliver A, Horcajada JP, Ambrose PG. 2018. Evaluation of ceftolozane-tazobactam in combination with meropenem against Pseudomonas aeruginosa sequence type 175 in a hollow-fiber infection model. Antimicrob Agents Chemother 62:e00026-18. doi: 10.1128/AAC.00026-18. 在中空纤维感染模型中评价头孢洛扎 - 他唑巴坦联合美罗培南对铜绿假单胞菌 (Pseudomonas sequence type 175) 的作用。
Aoki N, Tateda K, Kikuchi Y, Kimura S, Miyazaki C, Ishii Y, Tanabe Y, Gejyo F, Yamaguchi K. 2009. Efficacy of colistin combination therapy in a mouse model of pneumonia caused by multidrug-resistant Pseudomonas aeruginosa. J Antimicrob Chemother 63:534–542. doi: 10.1093/jac/dkn530. 多粘菌素联合治疗在多重耐药铜绿假单胞菌引起的肺炎小鼠模型中的疗效。
Yamagishi Y, Hagihara M, Kato H, Hirai J, Nishiyama N, Koizumi Y, Sakanashi D, Suematsu H, Nakai H, Mikamo H. 2017. In vitro and in vivo pharmacodynamics of colistin and aztreonam alone and in combination against multidrug-resistant Pseudomonas aeruginosa. Chemotherapy 62:105–110. doi: 10.1159/000449367. 粘菌素和氨曲南单药及联合用药抗多药耐药铜绿假单胞菌的体内外药效学。
Yadav R, Bulitta JB, Wang J, Nation RL, Landersdorfer CB. 2017. Evaluation of pharmacokinetic/pharmacodynamic model-based optimized combination regimens against multidrug-resistant Pseudomonas aeruginosa in a murine thigh infection model by using humanized dosing schemes. Antimicrob Agents Chemother 61:e01268-17. doi: 10.1128/AAC.01268-17. 使用人源化给药方案,在小鼠大腿感染模型中评价基于药代动力学 / 药效学模型的优化联合方案对多药耐药铜绿假单胞菌的作用。
Nichols WW, Stone GG, Newell P, Broadhurst H, Wardman A, MacPherson M, Yates K, Riccobene T, Critchley IA, Das S. 2018. Ceftazidime-avibactam susceptibility breakpoints against Enterobacteriaceae and Pseudomonas aeruginosa. Antimicrob Agents Chemother 62:e02590-17. doi: 10.1128/AAC.02590-17. 头孢他啶 - 阿维巴坦对肠杆菌科细菌和铜绿假单胞菌的敏感性折点。
Stone GG, Newell P, Gasink LB, Broadhurst H, Wardman A, Yates K, Chen Z, Song J, Chow JW. 2018. Clinical activity of ceftazidime/avibactam against MDR Enterobacteriaceae and Pseudomonas aeruginosa: pooled data from the ceftazidime/avibactam phase III clinical trial programme. J Antimicrob Chemother 73:2519–2523. doi: 10.1093/jac/dky204. 头孢他啶 / 阿维巴坦对 MDR 肠杆菌科细菌和铜绿假单胞菌的临床活性:来自头孢他啶 / 阿维巴坦 III 期临床试验项目的汇总数据。
Rodríguez-Núñez O, Ripa M, Morata L, de la Calle C, Cardozo C, Fehér C, Pellicé M, Valcárcel A, Puerta-Alcalde P, Marco F, García-Vidal C, Del Río A, Soriano A, Martínez-Martínez JA. 2018. Evaluation of ceftazidime/avibactam for serious infections due to multidrug-resistant and extensively drug-resistant Pseudomonas aeruginosa. J Glob Antimicrob Resist 15:136–139. doi: 10.1016/j.jgar.2018.07.010. 评价头孢他啶 / 阿维巴坦治疗多重耐药和广泛耐药铜绿假单胞菌引起的严重感染。
Monogue ML, Nicolau DP. 2018. Antibacterial activity of ceftolozane/tazobactam alone and in combination with other antimicrobial agents against MDR Pseudomonas aeruginosa. J Antimicrob Chemother 73:942–952. doi: 10.1093/jac/dkx483. 头孢洛扎 / 他唑巴坦单药及与其他抗菌药物联合对 MDR 铜绿假单胞菌的抗菌活性。
Xipell M, Paredes S, Fresco L, Bodro M, Marco F, Martínez JA, Soriano A. 2018. Clinical experience with ceftolozane/tazobactam in patients with serious infections due to resistant Pseudomonas aeruginosa. J Glob Antimicrob Resist 13:165–170. doi: 10.1016/j.jgar.2018.01.010. 头孢洛扎 / 他唑巴坦治疗耐药铜绿假单胞菌引起的严重感染的临床经验
Zavascki AP, Goldani LZ, Li J, Nation RL. 2007. Polymyxin B for the treatment of multidrug-resistant pathogens: a critical review. J Antimicrob Chemother 60:1206–1215. doi: 10.1093/jac/dkm357. 多粘菌素 B 治疗多药耐药病原体:评论性综述。
Li J, Nation RL, Turnidge JD, Milne RW, Coulthard K, Rayner CR, Paterson DL. 2006. Colistin: the re-emerging antibiotic for multidrug-resistant Gram-negative bacterial infections. Lancet Infect Dis 6:589–601. doi: 10.1016/S1473-3099(06)70580-1. 粘菌素:治疗多重耐药革兰阴性菌感染的重新出现的抗生素。
Nation RL, Velkov T, Li J. 2014. Colistin and polymyxin B: peas in a pod, or chalk and cheese? Clin Infect Dis 59:88–94. doi: 10.1093/cid/ciu213. 多粘菌素 B:豆荚中的豌豆,还是粉笔和奶酪?临床感染疾病 59:88–94。
Nation RL, Li J, Cars O, Couet W, Dudley MN, Kaye KS, Mouton JW, Paterson DL, Tam VH, Theuretzbacher U, Tsuji BT, Turnidge JD. 2015. Framework for optimisation of the clinical use of colistin and polymyxin B: the Prato polymyxin consensus. Lancet Infect Dis 15:225–234. doi: 10.1016/S1473-3099(14)70850-3. 粘菌素和多粘菌素 B 临床应用优化框架:Prato 多粘菌素共识。
Garonzik SM, Li J, Thamlikitkul V, Paterson DL, Shoham S, Jacob J, Silveira FP, Forrest A, Nation RL. 2011. Population pharmacokinetics of colistin methanesulfonate and formed colistin in critically ill patients from a multicenter study provide dosing suggestions for various categories of patients. Antimicrob Agents Chemother 55:3284–3294. doi: 10.1128/AAC.01733-10. 一项多中心研究提供了不同类别患者的甲磺酸多粘菌素和形成的多粘菌素在重症患者中的群体药代动力学。
Nation RL, Garonzik SM, Thamlikitkul V, Giamarellos-Bourboulis EJ, Forrest A, Paterson DL, Li J, Silveira FP. 2016. Dosing guidance for intravenous colistin in critically-ill patients. Clin Infect Dis 64:ciw839. doi: 10.1093/cid/ciw839. 危重患者中静脉注射粘菌素的剂量指导。
Nation RL, Garonzik SM, Li J, Thamlikitkul V, Giamarellos-Bourboulis EJ, Paterson DL, Turnidge JD, Forrest A, Silveira FP. 2016. Updated US and European dose recommendations for intravenous colistin: how do they perform? Clin Infect Dis 62:552–558. doi: 10.1093/cid/civ964. 更新美国和欧洲静脉注射粘菌素的剂量建议:如何实施?临床感染疾病 62:552–558。
Couet W, Grégoire N, Marchand S, Mimoz O. 2012. Colistin pharmacokinetics: the fog is lifting. Clin Microbiol Infect 18:30–39. doi: 10.1111/j.1469-0691.2011.03667.x. 粘菌素药代动力学:雾正在掀动。
Velkov T, Roberts KD, Nation RL, Thompson PE, Li J. 2013. Pharmacology of polymyxins: new insights into an ‘old’ class of antibiotics. Future Microbiol 8:711–724. doi: 10.2217/fmb.13.39. 多粘菌素的药理学:对 “旧” 类抗生素的新见解。
Velkov T, Thompson PE, Nation RL, Li J. 2010. Structure–activity relationships of polymyxin antibiotics. J Med Chem 53:1898–1916. doi: 10.1021/jm900999h. 多粘菌素类抗生素的结构 - 活性关系。
Poirel L, Jayol A, Nordmann P. 2017. Polymyxins: antibacterial activity, susceptibility testing, and resistance mechanisms encoded by plasmids or chromosomes. Clin Microbiol Rev 30:557–596. doi: 10.1128/CMR.00064-16. 多粘菌素类:抗菌活性、药敏试验和质粒或染色体编码的耐药机制。
Zhang L, Dhillon P, Yan H, Farmer S, Hancock RE. 2000. Interactions of bacterial cationic peptide antibiotics with outer and cytoplasmic membranes of Pseudomonas aeruginosa. Antimicrob Agents Chemother 44:3317–3321. doi: 10.1128/aac.44.12.3317-3321.2000. 细菌阳离子肽抗生素与铜绿假单胞菌外膜和细胞膜的相互作用。
Alhanout K, Malesinki S, Vidal N, Peyrot V, Rolain JM, Brunel JM. 2010. New insights into the antibacterial mechanism of action of squalamine. J Antimicrob Chemother 65:1688–1693. doi: 10.1093/jac/dkq213. 角胺抗菌作用机制的新见解。
O’Driscoll NH, Cushnie T, Matthews KHH, Lamb AJJ, O’Driscoll NHH, Cushnie T, Matthews KHH, Lamb AJJ, O’Driscoll NH, Cushnie T, Matthews KHH, Lamb AJJ, O’Driscoll NHH, Cushnie T, Matthews KHH, Lamb A. 2018. Colistin causes profound morphological alteration but minimal cytoplasmic membrane perforation in populations of Escherichia coli and Pseudomonas aeruginosa. Arch Microbiol 200:793–802. doi: 10.1007/s00203-018-1485-3. 在大肠杆菌和铜绿假单胞菌中,粘菌素引起明显的形态学变化,但细胞质膜穿孔极少。
Bergen PJ, Li J, Rayner CR, Nation RL. 2006. Colistin methanesulfonate is an inactive prodrug of colistin against Pseudomonas aeruginosa. Antimicrob Agents Chemother 50:1953–1958. doi: 10.1128/AAC.00035-06. 黏菌素甲磺酸酯是黏菌素抗铜绿假单胞菌的无活性前药。
Benattar YD, Omar M, Zusman O, Yahav D, Zak-Doron Y, Altunin S, Elbaz M, Daitch V, Granot M, Leibovici L, Paul M. 2016. The effectiveness and safety of high-dose colistin: prospective cohort study. Clin Infect Dis 63:1605–1612. doi: 10.1093/cid/ciw684. 高剂量粘菌素的有效性和安全性:前瞻性队列研究。
Montero M, Horcajada JP, Sorlí L, Alvarez-Lerma F, Grau S, Riu M, Sala M, Knobel H. 2009. Effectiveness and safety of colistin for the treatment of multidrug-resistant Pseudomonas aeruginosa infections. Infection 37:461–465. doi: 10.1007/s15010-009-8342-x. 黏菌素治疗多重耐药铜绿假单胞菌感染的有效性和安全性。
Sorlí L, Luque S, Grau S, Berenguer N, Segura C, Montero MM, Álvarez-Lerma F, Knobel H, Benito N, Horcajada JP. 2013. Trough colistin plasma level is an independent risk factor for nephrotoxicity: a prospective observational cohort study. BMC Infect Dis 13:380. doi: 10.1186/1471-2334-13-380. 血浆粘菌素谷浓度是肾毒性的独立风险因素:一项前瞻性观察性队列研究。
Plachouras D, Karvanen M, Friberg LE, Papadomichelakis E, Antoniadou A, Tsangaris I, Karaiskos I, Poulakou G, Kontopidou F, Armaganidis A, Cars O, Giamarellou H. 2009. Population pharmacokinetic analysis of colistin methanesulfonate and colistin after intravenous administration in critically ill patients with infections caused by gram-negative bacteria. Antimicrob Agents Chemother 53:3430–3436. doi: 10.1128/AAC.01361-08. 革兰阴性菌感染的危重患者静脉给药后,甲磺酸粘菌素和粘菌素的群体药代动力学分析。
Tsuji BT, Pogue JM, Zavascki AP, Paul M, Daikos GL, Forrest A, Giacobbe DR, Viscoli C, Giamarellou H, Karaiskos I, Kaye D, Mouton JW, Tam VH, Thamlikitkul V, Wunderink RG, Li J, Nation RL, Kaye KS. 2019. International consensus guidelines for the optimal use of the polymyxins: endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDS). Pharmacotherapy 39:10–39. doi: 10.1002/phar.2209. 多粘菌素最佳使用的国际共识指南:得到美国临床药学院 (ACCP)、欧洲临床微生物学和传染病学会 (ESCMID)、美国传染病学会 (IDS) 的认可。
Dalfino L, Puntillo F, Mosca A, Monno R, Spada ML, Coppolecchia S, Miragliotta G, Bruno F, Brienza N. 2012. High-dose, extended-interval colistin administration in critically ill patients: is this the right dosing strategy? A preliminary study. Clin Infect Dis 54:1720–1726. doi: 10.1093/cid/cis286. 高剂量、延长给药间隔的粘菌素在危重患者中的应用:这是正确的给药策略吗?初步研究。
Paul M, Daikos GL, Durante-Mangoni E, Yahav D, Carmeli Y, Benattar YD, Skiada A, Andini R, Eliakim-Raz N, Nutman A, Zusman O, Antoniadou A, Pafundi PC, Adler A, Dickstein Y, Pavleas I, Zampino R, Daitch V, Bitterman R, Zayyad H, Koppel F, Levi I, Babich T, Friberg LE, Mouton JW, Theuretzbacher U, Leibovici L. 2018. Colistin alone versus colistin plus meropenem for treatment of severe infections caused by carbapenem-resistant Gram-negative bacteria: an open-label, randomised controlled trial. Lancet Infect Dis 18:391–400. doi: 10.1016/S1473-3099(18)30099-9. 粘菌素单药治疗与粘菌素联合美罗培南治疗碳青霉烯类耐药革兰阴性菌引起的严重感染:一项开放标签、随机对照试验。
Sorlí L, Luque S, Segura C, Campillo N, Montero M, Esteve E, Herrera S, Benito N, Alvarez-Lerma F, Grau S, Horcajada JP. 2017. Impact of colistin plasma levels on the clinical outcome of patients with infections caused by extremely drug-resistant Pseudomonas aeruginosa. BMC Infect Dis 17:11. doi: 10.1186/s12879-016-2117-7. 粘菌素血浆水平对极度耐药铜绿假单胞菌引起的感染患者临床结局的影响。
Horcajada JP, Sorlí L, Luque S, Benito N, Segura C, Campillo N, Montero M, Esteve E, Mirelis B, Pomar V, Cuquet J, Martí C, Garro P, Grau S. 2016. Validation of a colistin plasma concentration breakpoint as a predictor of nephrotoxicity in patients treated with colistin methanesulfonate. Int J Antimicrob Agents 48:725–727. doi: 10.1016/j.ijantimicag.2016.08.020. 在接受甲磺酸粘菌素治疗的患者中验证粘菌素血浆浓度断点作为肾毒性预测因素。
Luque S, Escaño C, Sorli L, Li J, Campillo N, Horcajada JP, Salas E, Grau S. 2017. Urinary concentrations of colistimethate and formed colistin after intravenous administration in patients with multidrug-resistant Gram-negative bacterial infections. Antimicrob Agents Chemother 61:e02595-16. doi: 10.1128/AAC.02595-16. 多药耐药革兰阴性菌感染患者静脉给药后,尿中的粘菌酯浓度和形成的粘菌素浓度。
Hachem RY, Chemaly RF, Ahmar CA, Jiang Y, Boktour MR, Rjaili GA, Bodey GP, Raad II. 2007. Colistin is effective in treatment of infections caused by multidrug-resistant Pseudomonas aeruginosa in cancer patients. Antimicrob Agents Chemother 51:1905–1911. doi: 10.1128/AAC.01015-06. 粘菌素可有效治疗癌症患者中多重耐药铜绿假单胞菌引起的感染。
Markou N, Apostolakos H, Koumoudiou C, Athanasiou M, Koutsoukou A, Alamanos I, Gregorakos L. 2003. Intravenous colistin in the treatment of sepsis from multiresistant Gram-negative bacilli in critically ill patients. Crit Care 7:R78. doi: 10.1186/cc2358. 静脉注射粘菌素治疗重症患者多耐药革兰阴性杆菌败血症。
Linden PK, Kusne S, Coley K, Fontes P, Kramer DJ, Paterson D. 2003. Use of parenteral colistin for the treatment of serious infection due to antimicrobial-resistant Pseudomonas aeruginosa. Clin Infect Dis 37:e154–e160. doi: 10.1086/379611. 肠外粘菌素治疗耐药铜绿假单胞菌引起的严重感染。
Reina R, Estenssoro E, Sáenz G, Canales HS, Gonzalvo R, Vidal G, Martins G, Das Neves A, Santander O, Ramos C. 2005. Safety and efficacy of colistin in Acinetobacter and Pseudomonas infections: a prospective cohort study. Intensive Care Med 31:1058–1065. doi: 10.1007/s00134-005-2691-4. 粘菌素治疗不动杆菌和假单胞菌感染的安全性和有效性:前瞻性队列研究。
Michalopoulos AS, Tsiodras S, Rellos K, Mentzelopoulos S, Falagas ME. 2005. Colistin treatment in patients with ICU-acquired infections caused by multiresistant Gram-negative bacteria: the renaissance of an old antibiotic. Clin Microbiol Infect 11:115–121. doi: 10.1111/j.1469-0691.2004.01043.x. 粘菌素治疗由多耐药革兰氏阴性菌引起的 ICU 获得性感染:一种旧抗生素的复兴。
Cheng C-Y, Sheng W-H, Wang J-T, Chen Y-C, Chang S-C. 2010. Safety and efficacy of intravenous colistin (colistin methanesulphonate) for severe multidrug-resistant Gram-negative bacterial infections. Int J Antimicrob Agents 35:297–300. doi: 10.1016/j.ijantimicag.2009.11.016. 静脉内粘菌素(甲磺酸粘菌素)治疗重度多重耐药革兰阴性菌感染的安全性和疗效。
Falagas ME, Rafailidis PI, Ioannidou E, Alexiou VG, Matthaiou DK, Karageorgopoulos DE, Kapaskelis A, Nikita D, Michalopoulos A. 2010. Colistin therapy for microbiologically documented multidrug-resistant Gram-negative bacterial infections: a retrospective cohort study of 258 patients. Int J Antimicrob Agents 35:194–199. doi: 10.1016/j.ijantimicag.2009.10.005. 粘菌素治疗微生物证实的多重耐药革兰阴性菌感染:258 例患者的回顾性队列研究。
Durakovic N, Radojcic V, Boban A, Mrsic M, Sertic D, Serventi-Seiwerth R, Nemet D, Labar B. 2011. Efficacy and safety of colistin in the treatment of infections caused by multidrug-resistant Pseudomonas aeruginosa in patients with hematologic malignancy: a matched pair analysis. Intern Med 50:1009–1013. doi: 10.2169/internalmedicine.50.4270. 粘菌素治疗血液系统恶性肿瘤患者多重耐药铜绿假单胞菌感染的有效性和安全性:配对分析。
Naesens R, Vlieghe E, Verbrugghe W, Jorens P, Ieven M. 2011. A retrospective observational study on the efficacy of colistin by inhalation as compared to parenteral administration for the treatment of nosocomial pneumonia associated with multidrug-resistant Pseudomonas aeruginosa. BMC Infect Dis 11:317. doi: 10.1186/1471-2334-11-317. 一项比较多粘菌素吸入和肠外给药治疗多重耐药铜绿假单胞菌相关的院内获得性肺炎的回顾性观察性研究。
Vicari G, Bauer SR, Neuner EA, Lam SW. 2013. Association between colistin dose and microbiologic outcomes in patients with multidrug-resistant Gram-negative bacteremia. Clin Infect Dis 56:398–404. doi: 10.1093/cid/cis909. 多药耐药革兰氏阴性菌血症患者中粘菌素剂量与微生物学结果之间的相关性。
Samonis G, Vardakas KZ, Kofteridis DP, Dimopoulou D, Andrianaki AM, Chatzinikolaou I, Katsanevaki E, Maraki S, Falagas ME. 2014. Characteristics, risk factors and outcomes of adult cancer patients with extensively drug-resistant Pseudomonas aeruginosa infections. Infection 42:721–728. doi: 10.1007/s15010-014-0635-z. 广泛耐药铜绿假单胞菌感染的成人癌症患者的特征、风险因素和结局。
Zusman O, Altunin S, Koppel F, Dishon Benattar Y, Gedik H, Paul M. 2017. Polymyxin monotherapy or in combination against carbapenem-resistant bacteria: systematic review and meta-analysis. J Antimicrob Chemother 72:29–39. doi: 10.1093/jac/dkw377. 多粘菌素单药治疗或联合治疗对碳青霉烯类耐药细菌的作用:系统综述和荟萃分析。
Khawcharoenporn T, Chuncharunee A, Maluangnon C, Taweesakulvashra T, Tiamsak P. 2018. Active monotherapy and combination therapy for extensively drug-resistant Pseudomonas aeruginosa pneumonia. Int J Antimicrob Agents 52:828–834. doi: 10.1016/j.ijantimicag.2018.09.008. 广泛耐药铜绿假单胞菌肺炎的活性单药治疗和联合治疗。
Ribera A, Benavent E, Lora-Tamayo J, Tubau F, Pedrero S, Cabo X, Ariza J, Murillo O. 2015. Osteoarticular infection caused by MDR Pseudomonas aeruginosa: the benefits of combination therapy with colistin plus β-lactams. J Antimicrob Chemother 70:3357–3365. doi: 10.1093/jac/dkv281. MDR 铜绿假单胞菌引起的骨关节感染:粘菌素加 β- 内酰胺类联合治疗的获益。
Rigatto MH, Oliveira MS, Perdigão-Neto L V., Levin AS, Carrilho CM, Tanita MT, Tuon FF, Cardoso DE, Lopes NT, Falci DR, Zavascki AP. 2016. Multicenter prospective cohort study of renal failure in patients treated with colistin versus polymyxin B. Antimicrob Agents Chemother 60:2443–2449. doi: 10.1128/AAC.02634-15. 多粘菌素 B 与多粘菌素 B 治疗肾衰竭患者的多中心前瞻性队列研究。
Rigatto MH, Vieira FJ, Antochevis LC, Behle TF, Lopes NT, Zavascki AP. 2015. Polymyxin B in combination with antimicrobials lacking in vitro activity versus polymyxin B in monotherapy in critically ill patients with Acinetobacter baumannii or Pseudomonas aeruginosa infections. Antimicrob Agents Chemother 59:6575–6580. doi: 10.1128/AAC.00494-15. 多粘菌素 B 联合缺乏体外活性的抗菌药与多粘菌素 B 单药治疗鲍曼不动杆菌或铜绿假单胞菌感染的重症患者。
Nelson BC, Eiras DP, Gomez-Simmonds A, Loo AS, Satlin MJ, Jenkins SG, Whittier S, Calfee DP, Furuya EY, Kubin CJ. 2015. Clinical outcomes associated with polymyxin B dose in patients with bloodstream infections due to carbapenem-resistant Gram-negative rods. Antimicrob Agents Chemother 59:7000–7006. doi: 10.1128/AAC.00844-15. 多粘菌素 B 治疗碳青霉烯类耐药革兰氏阴性杆菌所致血液感染患者的临床结局。
Elias LS, Konzen D, Krebs JM, Zavascki AP. 2010. The impact of polymyxin B dosage on in-hospital mortality of patients treated with this antibiotic. J Antimicrob Chemother 65:2231–2237. doi: 10.1093/jac/dkq285. 多粘菌素 B 剂量对接受这种抗生素治疗的患者住院死亡率的影响。
Furtado GHC, d’Azevedo PA, Santos AF, Gales AC, Pignatari ACC, Medeiros EAS. 2007. Intravenous polymyxin B for the treatment of nosocomial pneumonia caused by multidrug-resistant Pseudomonas aeruginosa. Int J Antimicrob Agents 30:315–319. doi: 10.1016/j.ijantimicag.2007.05.017. 静脉注射多粘菌素 B 治疗多重耐药铜绿假单胞菌引起的院内获得性肺炎。
Dai C, Li J, Tang S, Li J, Xiao X. 2014. Colistin-induced nephrotoxicity in mice involves the mitochondrial, death receptor, and endoplasmic reticulum pathways. Antimicrob Agents Chemother 58:4075–4085. doi: 10.1128/AAC.00070-14. 粘菌素诱导的小鼠肾毒性涉及线粒体、死亡受体和内质网途径。
Azad MAK, Finnin BA, Poudyal A, Davis K, Li J, Hill PA, Nation RL, Velkov T, Li J. 2013. Polymyxin B induces apoptosis in kidney proximal tubular cells. Antimicrob Agents Chemother 57:4329–4335. doi: 10.1128/AAC.02587-12. 多粘菌素 B 诱导近端肾小管细胞凋亡。
Zavascki AP, Nation RL. 2017. Nephrotoxicity of polymyxins: is there any difference between colistimethate and polymyxin B? Antimicrob Agents Chemother 61:e02319-16. doi: 10.1128/AAC.02319-16. 多粘菌素的肾毒性:多黏菌素 B 和多黏菌素 B 之间是否存在差异?
Forrest A, Garonzik SM, Thamlikitkul V, Giamarellos-Bourboulis EJ, Paterson DL, Li J, Silveira FP, Nation RL. 2017. Pharmacokinetic/toxicodynamic analysis of colistin-associated acute kidney injury in critically ill patients. Antimicrob Agents Chemother 61:e01367-17. doi: 10.1128/AAC.01367-17. 危重患者中粘菌素相关急性肾损伤的药代动力学 / 毒代动力学分析。
Vardakas KZ, Voulgaris GL, Samonis G, Falagas ME. 2018. Inhaled colistin monotherapy for respiratory tract infections in adults without cystic fibrosis: a systematic review and meta-analysis. Int J Antimicrob Agents 51:1–9. doi: 10.1016/j.ijantimicag.2017.05.016. 吸入性粘菌素单药治疗无囊性纤维化成人呼吸道感染:一项系统综述和荟萃分析。
Vardakas KZ, Mavroudis AD, Georgiou M, Falagas ME. 2018. Intravenous plus inhaled versus intravenous colistin monotherapy for lower respiratory tract infections: a systematic review and meta-analysis. J Infect 76:321–327. doi: 10.1016/j.jinf.2018.02.002. 静脉内加吸入性与静脉内粘菌素单药治疗下呼吸道感染:系统综述和荟萃分析。
Athanassa ZE, Markantonis SL, Fousteri M-ZF, Myrianthefs PM, Boutzouka EG, Tsakris A, Baltopoulos GJ. 2012. Pharmacokinetics of inhaled colistimethate sodium (CMS) in mechanically ventilated critically ill patients. Intensive Care Med 38:1779–1786. doi: 10.1007/s00134-012-2628-7. 机械通气的重症患者中吸入粘菌酯钠 (CMS) 的药代动力学。
Lu Q, Luo R, Bodin L, Yang J, Zahr N, Aubry A, Golmard J-L, Rouby J-J, Nebulized Antibiotics Study Group. 2012. Efficacy of high-dose nebulized colistin in ventilator-associated pneumonia caused by multidrug-resistant Pseudomonas aeruginosa and Acinetobacter baumannii. Anesthesiology 117:1335–1347. doi: 10.1097/ALN.0b013e31827515de. 高剂量雾化黏菌素对多重耐药铜绿假单胞菌和鲍曼不动杆菌引起的呼吸机相关性肺炎的疗效。
Maskin LP, Setten M, Rodríguez PO, Bonelli I, Attie S, Stryjewski ME, Valentini R. 2015. Inhaled colistimethate sodium in ventilator-associated tracheobronchitis due to multidrug-resistant Gram-negative bacteria. Int J Antimicrob Agents 45:199–200. doi: 10.1016/j.ijantimicag.2014.09.010. 吸入多药耐药革兰阴性菌引起的呼吸机相关气管支气管炎中的可的松磺酸钠。
Lin Y-W, Zhou Q, Onufrak NJ, Wirth V, Chen K, Wang J, Forrest A, Chan H-K, Li J. 2017. Aerosolized polymyxin B for treatment of respiratory tract infections: determination of pharmacokinetic-pharmacodynamic indices for aerosolized polymyxin B against Pseudomonas aeruginosa in a mouse lung infection model. Antimicrob Agents Chemother 61:e00211-17. doi: 10.1128/AAC.00211-17. 雾化多粘菌素 B 治疗呼吸道感染:在小鼠肺部感染模型中测定雾化多粘菌素 B 抗铜绿假单胞菌的药代动力学 - 药效学指数。
Pereira GH, Muller PR, Levin AS. 2007. Salvage treatment of pneumonia and initial treatment of tracheobronchitis caused by multidrug-resistant Gram-negative bacilli with inhaled polymyxin B. Diagn Microbiol Infect Dis 58:235–240. doi: 10.1016/j.diagmicrobio.2007.01.008. 吸入多粘菌素 B 对多药耐药革兰阴性杆菌引起的肺炎进行挽救性治疗和气管支气管炎的初步治疗。
Kim B-N, Peleg AY, Lodise TP, Lipman J, Li J, Nation R, Paterson DL. 2009. Management of meningitis due to antibiotic-resistant Acinetobacter species. Lancet Infect Dis 9:245–245. doi: 10.1016/S1473-3099(09)70055-6. 抗生素耐药性不动杆菌属所致脑膜炎的管理。
Antachopoulos C, Karvanen M, Iosifidis E, Jansson B, Plachouras D, Cars O, Roilides E. 2010. Serum and cerebrospinal fluid levels of colistin in pediatric patients. Antimicrob Agents Chemother 54:3985–3987. doi: 10.1128/AAC.01799-09. 儿科患者中粘菌素的血清和脑脊液水平。
Ziaka M, Markantonis SL, Fousteri M, Zygoulis P, Panidis D, Karvouniaris M, Makris D, Zakynthinos E. 2013. Combined intravenous and intraventricular administration of colistin methanesulfonate in critically ill patients with central nervous system infection. Antimicrob Agents Chemother 57:1938–1940. doi: 10.1128/AAC.01461-12. 甲磺酸粘菌素在中枢神经系统感染重症患者中的静脉和脑室内联合给药。
Markantonis SL, Markou N, Fousteri M, Sakellaridis N, Karatzas S, Alamanos I, Dimopoulou E, Baltopoulos G. 2009. Penetration of colistin into cerebrospinal fluid. Antimicrob Agents Chemother 53:4907–4910. doi: 10.1128/AAC.00345-09. 粘菌素渗入脑脊液。
Velkov T, Dai C, Ciccotosto GD, Cappai R, Hoyer D, Li J. 2018. Polymyxins for CNS infections: pharmacology and neurotoxicity. Pharmacol Ther 181:85–90. doi: 10.1016/j.pharmthera.2017.07.012. 用于治疗 CNS 感染的多粘菌素:药理学和神经毒性。
Berlana D, Llop JM, Fort E, Badia MB, Jódar R. 2005. Use of colistin in the treatment of multiple-drug-resistant gram-negative infections. Am J Health Syst Pharm 62:39–47. doi: 10.1093/ajhp/62.1.39. 多粘菌素治疗多重耐药革兰氏阴性菌感染。
Gump WC, Walsh JW. 2005. Intrathecal colistin for treatment of highly resistant Pseudomonas ventriculitis. Case report and review of the literature. J Neurosurg 102:915–917. doi: 10.3171/jns.2005.102.5.0915. 鞘内粘菌素治疗高度耐药假单胞菌脑室炎。
Quinn AL, Parada JP, Belmares J, O’Keefe JP. 2005. Intrathecal colistin and sterilization of resistant Pseudomonas aeruginosa shunt infection. Ann Pharmacother 39:949–952. doi: 10.1345/aph.1E485. 鞘内粘菌素和抗铜绿假单胞菌分流感染的消毒。
Schina M, Spyridi E, Daoudakis M, Mertzanos E, Korfias S. 2006. Successful treatment of multidrug-resistant Pseudomonas aeruginosa meningitis with intravenous and intrathecal colistin. Int J Infect Dis 10:178–179. doi: 10.1016/j.ijid.2005.03.005. 静脉内和鞘内粘菌素成功治疗多重耐药铜绿假单胞菌脑膜炎。
Tsolaki V, Karvouniaris M, Manoulakas E, Kotlia P, Karadontas V, Fotakopoulos G, Zakynthinos E, Makris D. 2018. Intraventricular CNS treatment with colistin-tigecycline combination: a case series. J Crit Care 47:338–341. doi: 10.1016/j.jcrc.2018.07.025. 脑室内 CNS 治疗联合黏菌素 - 替加环素:一个病例系列。
Imberti R, Iotti GA, Regazzi M. 2014. Intraventricular or intrathecal colistin for the treatment of central nervous system infections caused by multidrug-resistant Gram-negative bacteria. Expert Rev Anti Infect Ther 12:471–478. doi: 10.1586/14787210.2014.896740. 脑室内或鞘内粘菌素治疗多重耐药革兰氏阴性菌引起的中枢神经系统感染。
Baiocchi M, Catena V, Zago S, Badolati L, Baccarin M. 2010. Intrathecal colistin for treatment of multidrug resistant (MDR) Pseudomonas aeruginosa after neurosurgical ventriculitis. Infez Med 18:182–186. 鞘内粘菌素治疗神经外科脑室炎后多药耐药 (MDR) 铜绿假单胞菌。
Gilbert B, Morrison C. 2017. Evaluation of intraventricular colistin utilization: a case series. J Crit Care 40:161–163. doi: 10.1016/j.jcrc.2017.04.010. 评价脑室内粘菌素的使用:一个病例系列。
Tunkel AR, Hasbun R, Bhimraj A, Byers K, Kaplan SL, Scheld WM, van de Beek D, Bleck TP, Garton HJL, Zunt JR. 2017. 2017 Infectious Diseases Society of America’s clinical practice guidelines for healthcare-associated ventriculitis and meningitis. Clin Infect Dis 64:e34–e65. doi: 10.1093/cid/ciw861. 2017 年美国传染病学会关于医疗相关脑室炎和脑膜炎的临床实践指南。
Craig WA. 1998. Pharmacokinetic/pharmacodynamic parameters: rationale for antibacterial dosing of mice and men. Clin Infect Dis 26:1–10. (Quiz, 26:11–12.) doi: 10.1086/516284. 药代动力学 / 药效学参数:小鼠和男性抗菌给药的依据。
Ong CT, Tessier PR, Li C, Nightingale CH, Nicolau DP. 2007. Comparative in vivo efficacy of meropenem, imipenem, and cefepime against Pseudomonas aeruginosa expressing MexA-MexB-OprM efflux pumps. Diagn Microbiol Infect Dis 57:153–161. doi: 10.1016/j.diagmicrobio.2006.06.014. 比较美罗培南、亚胺培南和头孢吡肟对表达 MexA-MexB-OprM 外排泵的铜绿假单胞菌的体内疗效。
Kuti JL, Dandekar PK, Nightingale CH, Nicolau DP. 2003. Use of Monte Carlo simulation to design an optimized pharmacodynamic dosing strategy for meropenem. J Clin Pharmacol 43:1116–1123. doi: 10.1177/0091270003257225. 使用 Monte Carlo 模拟设计美罗培南的优化药效学剂量策略。
Yadav R, Bulitta JB, Nation RL, Landersdorfer CB. 2017. Optimization of synergistic combination regimens against carbapenem- and aminoglycoside-resistant clinical Pseudomonas aeruginosa isolates via mechanism-based pharmacokinetic/pharmacodynamic modeling. Antimicrob Agents Chemother 61:e01011-16. doi: 10.1128/AAC.01011-16. 通过基于机制的药代动力学 / 药效学建模,优化抗碳青霉烯类和氨基糖苷类耐药临床铜绿假单胞菌分离株的协同联合治疗方案。
Lim T-P, Wang R, Poh GQ, Koh T-H, Tan T-Y, Lee W, Teo JQ-M, Cai Y, Tan T-T, Ee PLR, Kwa AL. 2018. Integrated pharmacokinetic-pharmacodynamic modeling to evaluate empiric carbapenem therapy in bloodstream infections. Infect Drug Resist 11:1591–1596. doi: 10.2147/IDR.S168191. 综合药代动力学 - 药效学模型评价经验性碳青霉烯类治疗血液感染。
Domenig C, Traunmüller F, Kozek S, Wisser W, Klepetko W, Steininger R, Spiss C, Thalhammer F. 2001. Continuous beta-lactam antibiotic therapy in a double-lung transplanted patient with a multidrug-resistant Pseudomonas aeruginosa infection. Transplantation 71:744–745. doi: 10.1097/00007890-200103270-00009. 持续 β- 内酰胺抗生素治疗多重耐药铜绿假单胞菌感染的双肺移植患者。
Zavascki AP, Barth AL, Goldani LZ. 2008. Nosocomial bloodstream infections due to metallo-β-lactamase-producing Pseudomonas aeruginosa. J Antimicrob Chemother 61:1183–1185. doi: 10.1093/jac/dkn082. 产金属 β- 内酰胺酶的铜绿假单胞菌引起的院内血液感染。
Sabuda DM, Laupland K, Pitout J, Dalton B, Rabin H, Louie T, Conly J. 2008. Utilization of colistin for treatment of multidrug-resistant Pseudomonas aeruginosa. Can J Infect Dis Med Microbiol 19:413–418. doi: 10.1155/2008/743197. 使用黏菌素治疗多重耐药铜绿假单胞菌。
Moriyama B, Henning SA, Childs R, Holland SM, Anderson VL, Morris JC, Wilson WH, Drusano GL, Walsh TJ. 2010. High-dose continuous infusion β-lactam antibiotics for the treatment of resistant Pseudomonas aeruginosa infections in immunocompromised patients. Ann Pharmacother 44:929–935. doi: 10.1345/aph.1M717. 大剂量持续输注 β- 内酰胺类抗生素治疗免疫功能低下患者的耐药铜绿假单胞菌感染。
Heil EL, Lowery A V., Thom KA, Nicolau DP. 2015. Treatment of multidrug-resistant Pseudomonas aeruginosa using extended-infusion antimicrobial regimens. Pharmacother J Hum Pharmacol Drug Ther 35:54–58. doi: 10.1002/phar.1514. 延长抗生素输注方案治疗多重耐药铜绿假单胞菌。
Pfaller MA, Shortridge D, Sader HS, Castanheira M, Flamm RK. 2018. Ceftolozane/tazobactam activity against drug-resistant Enterobacteriaceae and Pseudomonas aeruginosa causing healthcare-associated infections in the Asia-Pacific region (minus China, Australia and New Zealand): report from an Antimicrobial Surveillance Programme (2013-2015). Int J Antimicrob Agents 51:181–189. doi: 10.1016/j.ijantimicag.2017.09.016. 头孢洛扎 / 他唑巴坦对亚太地区(不包括中国、澳大利亚和新西兰)引起医疗保健相关感染的耐药肠杆菌科细菌和铜绿假单胞菌的活性:抗菌药物监测项目报告 (2013-2015)。
Walkty A, Adam H, Baxter M, Lagacé-Wiens P, Karlowsky JA, Hoban DJ, Zhanel GG. 2018. In vitro activity of ceftolozane/tazobactam versus antimicrobial non-susceptible Pseudomonas aeruginosa clinical isolates including MDR and XDR isolates obtained from across Canada as part of the CANWARD study, 2008–16. J Antimicrob Chemother 73:703–708. doi: 10.1093/jac/dkx468. 作为 CANWARD 研究的一部分,从加拿大各地获得的头孢洛扎 / 他唑巴坦对抗菌不敏感铜绿假单胞菌临床分离株(包括 MDR 和 XDR 分离株)的体外活性 2008–16。
Britt NS, Ritchie DJ, Kollef MH, Burnham C-AD, Durkin MJ, Hampton NB, Micek ST. 2018. Importance of site of infection and antibiotic selection in the treatment of carbapenem-resistant Pseudomonas aeruginosa sepsis. Antimicrob Agents Chemother 62:e02400-17. doi: 10.1128/AAC.02400-17. 碳青霉烯类耐药铜绿假单胞菌败血症治疗中感染部位和抗生素选择的重要性。
Craig WA, Redington J, Ebert SC. 1991. Pharmacodynamics of amikacin in vitro and in mouse thigh and lung infections. J Antimicrob Chemother 27(Suppl C):29–40. doi: 10.1093/jac/27.suppl_c.29. 阿米卡星在体外和小鼠大腿和肺部感染中的药效学。
Zelenitsky SA, Harding GKM, Sun S, Ubhi K, Ariano RE. 2003. Treatment and outcome of Pseudomonas aeruginosa bacteraemia: an antibiotic pharmacodynamic analysis. J Antimicrob Chemother 52:668–674. doi: 10.1093/jac/dkg403. 铜绿假单胞菌菌血症的治疗和结局:抗生素药效学分析。
Brasseur A, Hites M, Roisin S, Cotton F, Vincent J-L, De Backer D, Jacobs F, Taccone FS. 2016. A high-dose aminoglycoside regimen combined with renal replacement therapy for the treatment of MDR pathogens: a proof-of-concept study. J Antimicrob Chemother 71:1386–1394. doi: 10.1093/jac/dkv491. 高剂量氨基糖苷类方案联合肾脏替代疗法治疗多耐药病原体:一项概念验证研究。
Layeux B, Taccone FS, Fagnoul D, Vincent JL, Jacobs F. 2010. Amikacin monotherapy for sepsis caused by panresistant Pseudomonas aeruginosa. Antimicrob Agents Chemother 54:4939–4941. doi: 10.1128/AAC.00441-10. 阿米卡星单药治疗泛耐药铜绿假单胞菌引起的败血症。
Kalil AC, Metersky ML, Klompas M, Muscedere J, Sweeney DA, Palmer LB, Napolitano LM, O’Grady NP, Bartlett JG, Carratalà J, El Solh AA, Ewig S, Fey PD, File TM, Restrepo MI, Roberts JA, Waterer GW, Cruse P, Knight SL, Brozek JL. 2016. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis 63:e61–e111. doi: 10.1093/cid/ciw353. 成人医院获得性肺炎和呼吸机相关性肺炎的管理:美国传染病学会和美国胸科学会 2016 年临床实践指南。
Molinaro M, Morelli P, De Gregori M, De Gregori S, Giardini I, Tordato F, Monzillo V, Pocaterra D, Casari E. 2018. Efficacy of intraventricular amikacin treatment in pan-resistant Pseudomonas aeruginosa postsurgical meningitis. Infect Drug Resist 11:1369–1372. doi: 10.2147/IDR.S169271. 脑室内阿米卡星治疗泛耐药铜绿假单胞菌术后脑膜炎的疗效。
Falagas ME, Kastoris AC, Karageorgopoulos DE, Rafailidis PI. 2009. Fosfomycin for the treatment of infections caused by multidrug-resistant non-fermenting Gram-negative bacilli: a systematic review of microbiological, animal and clinical studies. Int J Antimicrob Agents 34:111–120. doi: 10.1016/j.ijantimicag.2009.03.009. 磷霉素治疗多重耐药不发酵革兰阴性杆菌引起的感染:微生物学、动物和临床研究的系统综述。
Michalopoulos AS, Livaditis IG, Gougoutas V. 2011. The revival of fosfomycin. Int J Infect Dis 15:e732–e739. doi: 10.1016/j.ijid.2011.07.007. 磷霉素的复兴。
Samonis G, Maraki S, Karageorgopoulos DE, Vouloumanou EK, Falagas ME. 2012. Synergy of fosfomycin with carbapenems, colistin, netilmicin, and tigecycline against multidrug-resistant Klebsiella pneumoniae, Escherichia coli, and Pseudomonas aeruginosa clinical isolates. Eur J Clin Microbiol Infect Dis 31:695–701. doi: 10.1007/s10096-011-1360-5. 磷霉素与碳青霉烯类、黏菌素、奈替米星和替加环素对多药耐药肺炎克雷伯菌、大肠埃希菌和铜绿假单胞菌临床分离株的协同作用。
Apisarnthanarak A, Mundy LM. 2010. Use of high-dose 4-hour infusion of doripenem, in combination with fosfomycin, for treatment of carbapenem-resistant Pseudomonas aeruginosa pneumonia. Clin Infect Dis 51:1352–1354. doi: 10.1086/657249. 使用大剂量 4 小时输注多利培南联合磷霉素治疗碳青霉烯类耐药铜绿假单胞菌肺炎。
Apisarnthanarak A, Mundy LM. 2012. Carbapenem-resistant Pseudomonas aeruginosa pneumonia with intermediate minimum inhibitory concentrations to doripenem: combination therapy with high-dose, 4-h infusion of doripenem plus fosfomycin versus intravenous colistin plus fosfomycin. Int J Antimicrob Agents 39:271–272. doi: 10.1016/j.ijantimicag.2011.11.012. 对多利培南具有中等最低抑菌浓度的碳青霉烯类耐药铜绿假单胞菌肺炎:多利培南加磷霉素与静脉内黏菌素加磷霉素高剂量、4h 输注联合治疗。
Pyrpasopoulou A, Pitsava G, Iosifidis E, Imvrios G, Massa E, Mouloudi E, Goulis I, Chatzidrosou E, Antachopoulos C, Fouzas I, Roilides E. 2018. Intravenous fosfomycin in patients with liver disease for extensively drug-resistant Gram-negative bacteria. J Infect 77:448–454. doi: 10.1016/j.jinf.2018.07.013. 广泛耐药革兰氏阴性菌肝病患者静脉注射磷霉素。
Winkler ML, Papp-Wallace KM, Hujer AM, Domitrovic TN, Hujer KM, Hurless KN, Tuohy M, Hall G, Bonomo RA. 2015. Unexpected challenges in treating multidrug-resistant Gram-negative bacteria: resistance to ceftazidime-avibactam in archived isolates of Pseudomonas aeruginosa. Antimicrob Agents Chemother 59:1020–1029. doi: 10.1128/AAC.04238-14. 治疗多重耐药革兰氏阴性细菌的非预期挑战:铜绿假单胞菌存档分离株对头孢他啶 - 阿维巴坦的耐药性。
Frattari A, Savini V, Polilli E, Cibelli D, Talamazzi S, Bosco D, Consorte A, Fazii P, Parruti G. 2018. Ceftolozane-tazobactam and fosfomycin for rescue treatment of otogenous meningitis caused by XDR Pseudomonas aeruginosa: case report and review of the literature. IDCases 14:e00451. doi: 10.1016/j.idcr.2018.e00451. 头孢洛扎 - 他唑巴坦与磷霉素对 XDR 铜绿假单胞菌引起的耳源性脑膜炎的抢救治疗:病例报告和文献回顾。
Asuphon O, Montakantikul P, Houngsaitong J, Kiratisin P, Sonthisombat P. 2016. Optimizing intravenous fosfomycin dosing in combination with carbapenems for treatment of Pseudomonas aeruginosa infections in critically ill patients based on pharmacokinetic/pharmacodynamic (PK/PD) simulation. Int J Infect Dis 50:23–29. doi: 10.1016/j.ijid.2016.06.017. 根据药代动力学 / 药效学 (PK/PD) 模拟,优化磷霉素静脉给药联合碳青霉烯类治疗铜绿假单胞菌感染的危重患者。
Maraolo AE, Cascella M, Corcione S, Cuomo A, Nappa S, Borgia G, De Rosa FG, Gentile I. 2017. Management of multidrug-resistant Pseudomonas aeruginosa in the intensive care unit: state of the art. Expert Rev Anti Infect Ther 15:861–871. doi: 10.1080/14787210.2017.1367666. 重症监护室中多重耐药铜绿假单胞菌的管理:最新技术水平。
Wright H, Bonomo RA, Paterson DL. 2017. New agents for the treatment of infections with Gram-negative bacteria: restoring the miracle or false dawn? Clin Microbiol Infect 23:704–712. doi: 10.1016/j.cmi.2017.09.001. 治疗革兰氏阴性细菌感染的新药:恢复奇迹还是虚假黎明?临床微生物感染 23:704–712。
Burrows LL. 2018. The therapeutic pipeline for Pseudomonas aeruginosa infections. ACS Infect Dis 4:1041–1047. doi: 10.1021/acsinfecdis.8b00112. 铜绿假单胞菌感染的治疗管线。
Koulenti D, Song A, Ellingboe A, Abdul-Aziz MH, Harris P, Gavey E, Lipman J. 2018. Infections by multidrug-resistant Gram-negative bacteria: what’s new in our arsenal and what’s in the pipeline? Int J Antimicrob Agents 53:211–224. doi: 10.1016/j.ijantimicag.2018.10.011. 多重耐药革兰氏阴性细菌感染:我们的新产品和正在开发的产品是什么?国际抗菌药杂志 53:211–224。
Goodlet KJ, Nicolau DP, Nailor MD. 2017. In vitro comparison of ceftolozane-tazobactam to traditional beta-lactams and ceftolozane-tazobactam as an alternative to combination antimicrobial therapy for Pseudomonas aeruginosa. Antimicrob Agents Chemother 61:e01350-17. doi: 10.1128/AAC.01350-17. 体外比较头孢洛扎 - 他唑巴坦与传统 β- 内酰胺类药物和头孢洛扎 - 他唑巴坦作为铜绿假单胞菌抗菌联合治疗的替代药物。
Papp-Wallace KM, Bonomo RA. 2016. New β-lactamase inhibitors in the clinic. Infect Dis Clin North Am 30:441–464. doi: 10.1016/j.idc.2016.02.007. 临床中的新型 β- 内酰胺酶抑制剂。
Sader HS, Farrell DJ, Castanheira M, Flamm RK, Jones RN. 2014. Antimicrobial activity of ceftolozane/tazobactam tested against Pseudomonas aeruginosa and Enterobacteriaceae with various resistance patterns isolated in European hospitals (2011-12). J Antimicrob Chemother 69:2713–2722. doi: 10.1093/jac/dku184. 检测头孢洛扎 / 他唑巴坦对欧洲医院分离的具有各种耐药模式的铜绿假单胞菌和肠杆菌科细菌的抗菌活性 (2011-12)。
Wasmuth E V, Lima CD. 2017. The Rrp6 C-terminal domain binds RNA and activates the nuclear RNA exosome. Nucleic Acids Res 45:846–860. doi: 10.1093/nar/gkw1152. Rrp6 C 末端结构域结合 RNA 并激活核 RNA 外泌体。
Humphries RM, Hindler JA, Wong-Beringer A, Miller SA. 2017. Activity of ceftolozane-tazobactam and ceftazidime-avibactam against beta-lactam-resistant Pseudomonas aeruginosa isolates. Antimicrob Agents Chemother 61:e01858-17. doi: 10.1128/AAC.01858-17. 头孢洛扎 - 他唑巴坦和头孢他啶 - 阿维巴坦对 β- 内酰胺类耐药铜绿假单胞菌分离株的活性。
Pfaller MA, Bassetti M, Duncan LR, Castanheira M. 2017. Ceftolozane/tazobactam activity against drug-resistant Enterobacteriaceae and Pseudomonas aeruginosa causing urinary tract and intraabdominal infections in Europe: report from an antimicrobial surveillance programme (2012–15). J Antimicrob Chemother 72:1386–1395. doi: 10.1093/jac/dkx009. 欧洲头孢洛扎 / 他唑巴坦对引起泌尿道和腹腔内感染的耐药肠杆菌科细菌和铜绿假单胞菌的活性:来自抗菌监测项目的报告 (2012–15)。
Grupper M, Sutherland C, Nicolau DP. 2017. Multicenter evaluation of ceftazidime-avibactam and ceftolozane-tazobactam inhibitory activity against meropenem-nonsusceptible Pseudomonas aeruginosa from blood, respiratory tract, and wounds. Antimicrob Agents Chemother 61:e00875-17. doi: 10.1128/AAC.00875-17. 多中心评价头孢他啶 - 阿维巴坦和头孢洛扎 / 他唑巴坦对来自血液、呼吸道和伤口的美罗培南不敏感铜绿假单胞菌的抑制活性。
Tato M, García-Castillo M, Bofarull AM, Cantón R. 2015. In vitro activity of ceftolozane/tazobactam against clinical isolates of Pseudomonas aeruginosa and Enterobacteriaceae recovered in Spanish medical centres: results of the CENIT study. Int J Antimicrob Agents 46:502–510. doi: 10.1016/j.ijantimicag.2015.07.004. 头孢洛扎 / 他唑巴坦对西班牙医学中心回收的铜绿假单胞菌和肠杆菌科临床分离株的体外活性:CENIT 研究结果。
Natesan S, Pai MP, Lodise TP. 2017. Determination of alternative ceftolozane/tazobactam dosing regimens for patients with infections due to Pseudomonas aeruginosa with MIC values between 4 and 32 mg/L. J Antimicrob Chemother 72:2813–2816. doi: 10.1093/jac/dkx221. 测定铜绿假单胞菌感染患者的替代头孢洛扎 / 他唑巴坦给药方案(MIC 值在 4-32 mg/L 之间)。
Xiao AJ, Miller BW, Huntington JA, Nicolau DP. 2016. Ceftolozane/tazobactam pharmacokinetic/pharmacodynamic-derived dose justification for phase 3 studies in patients with nosocomial pneumonia. J Clin Pharmacol 56:56–66. doi: 10.1002/jcph.566. 在医院获得性肺炎患者中开展的 iii 期研究中,基于头孢洛扎 / 他唑巴坦的药代动力学 / 药效学的剂量依据。
Melchers MJ, Mavridou E, Seyedmousavi S, van Mil AC, Lagarde C, Mouton JW. 2015. Plasma and epithelial lining fluid pharmacokinetics of ceftolozane and tazobactam alone and in combination in mice. Antimicrob Agents Chemother 59:3373–3376. doi: 10.1128/AAC.04402-14. 头孢洛扎和他唑巴坦单药和联合给药在小鼠中的血浆和上皮细胞衬液药代动力学。
Jones BM, Smith B, Bland CM. 2017. Use of continuous-infusion ceftolozane/tazobactam in a multidrug-resistant Pseudomonas aeruginosa urinary tract infection in the outpatient setting. Ann Pharmacother 51:715–716. doi: 10.1177/1060028017701938. 门诊患者连续输注头孢洛扎 / 他唑巴坦治疗多重耐药铜绿假单胞菌尿路感染。
Oliver WD, Heil EL, Gonzales JP, Mehrotra S, Robinett K, Saleeb P, Nicolau DP. 2016. Ceftolozane-tazobactam pharmacokinetics in a critically ill patient on continuous venovenous hemofiltration. Antimicrob Agents Chemother 60:1899–1901. doi: 10.1128/AAC.02608-15. 接受连续性静脉 - 静脉血液滤过的重症患者中的头孢洛扎 - 他唑巴坦药代动力学。
Stewart A, Roberts JA, Wallis SC, Allworth AM, Legg A, McCarthy KL. 2018. Evidence of clinical response and stability of ceftolozane/tazobactam used to treat a carbapenem-resistant Pseudomonas aeruginosa lung abscess on an outpatient antimicrobial program. Int J Antimicrob Agents 51:941–942. doi: 10.1016/j.ijantimicag.2018.02.008. 头孢洛扎 / 他唑巴坦治疗碳青霉烯类耐药铜绿假单胞菌肺脓肿门诊抗菌方案的临床疗效和稳定性证据。
Gallagher JC, Satlin MJ, Elabor A, Saraiya N, McCreary EK, Molnar E, El-Beyrouty C, Jones BM, Dixit D, Heil EL, Claeys KC, Hiles J, Vyas NM, Bland CM, Suh J, Biason K, McCoy D, King MA, Richards L, Harrington N, Guo Y, Chaudhry S, Lu X, Yu D. 2018. Ceftolozane-tazobactam for the treatment of multidrug-resistant Pseudomonas aeruginosa infections: a multicenter study. Open Forum Infect Dis 5:ofy280. doi: 10.1093/ofid/ofy280. 头孢洛扎 - 他唑巴坦治疗多重耐药铜绿假单胞菌感染:一项多中心研究。
Castón JJ, De la Torre Á, Ruiz-Camps I, Sorlí ML, Torres V, Torre-Cisneros J. 2017. Salvage therapy with ceftolozane-tazobactam for multidrug-resistant Pseudomonas aeruginosa infections. Antimicrob Agents Chemother 61:e02136-16. doi: 10.1128/AAC.02136-16. 对多重耐药铜绿假单胞菌感染采用头孢洛扎 - 他唑巴坦进行补救治疗。
Munita JM, Aitken SL, Miller WR, Perez F, Rosa R, Shimose LA, Lichtenberger PN, Abbo LM, Jain R, Nigo M, Wanger A, Araos R, Tran TT, Adachi J, Rakita R, Shelburne S, Bonomo RA, Arias CA. 2017. Multicenter evaluation of ceftolozane/tazobactam for serious infections caused by carbapenem-resistant Pseudomonas aeruginosa. Clin Infect Dis 65:158–161. doi: 10.1093/cid/cix014. 头孢洛扎 / 他唑巴坦治疗碳青霉烯类耐药铜绿假单胞菌引起的严重感染的多中心评价。
Hakki M, Lewis JS. 2018. Ceftolozane-tazobactam therapy for multidrug-resistant Pseudomonas aeruginosa infections in patients with hematologic malignancies and hematopoietic-cell transplant recipients. Infection 46:431–434. doi: 10.1007/s15010-018-1125-5. 头孢洛扎 - 他唑巴坦治疗血液恶性肿瘤患者和造血细胞移植受者的多重耐药铜绿假单胞菌感染。
Dinh A, Wyplosz B, Kernéis S, Lebeaux D, Bouchand F, Duran C, Béraud G, Lazaro P, Davido B, Hénard S, Canouï E, Ferry T, Wolff M. 2017. Use of ceftolozane/tazobactam as salvage therapy for infections due to extensively drug-resistant Pseudomonas aeruginosa. Int J Antimicrob Agents 49:782–783. doi: 10.1016/j.ijantimicag.2017.04.001. 使用头孢洛扎 / 他唑巴坦补救治疗广泛耐药铜绿假单胞菌引起的感染。
Escolà-Vergé L, Pigrau C, Los-Arcos I, Arévalo Á, Viñado B, Campany D, Larrosa N, Nuvials X, Ferrer R, Len O, Almirante B. 2018. Ceftolozane/tazobactam for the treatment of XDR Pseudomonas aeruginosa infections. Infection 46:461–468. doi: 10.1007/s15010-018-1133-5. 头孢洛扎 / 他唑巴坦治疗 XDR 铜绿假单胞菌感染。
Dietl B, Sánchez I, Arcenillas P, Cuchi E, Gómez L, González de Molina FJ, Boix-Palop L, Nicolás J, Calbo E. 2018. Ceftolozane/tazobactam in the treatment of osteomyelitis and skin and soft-tissue infections due to extensively drug-resistant Pseudomonas aeruginosa: clinical and microbiological outcomes. Int J Antimicrob Agents 51:498–502. doi: 10.1016/j.ijantimicag.2017.11.003. 头孢洛扎 / 他唑巴坦治疗广泛耐药铜绿假单胞菌引起的骨髓炎和皮肤及软组织感染:临床和微生物学结果。
Bassetti M, Castaldo N, Cattelan A, Mussini C, Righi E, Tascini C, Menichetti F, Mastroianni CM, Tumbarello M, Grossi P, Artioli S, Carrannante N, Cipriani L, Coletto D, Russo A, Digaetano M, Losito R, Peghin M, Capone A, Nicolè S, Vena A. 2018. Ceftolozane/tazobactam for the treatment of serious P. aeruginosa infections: a multicenter nationwide clinical experience. Int J Antimicrob Agents 53:408–415. doi: 10.1016/j.ijantimicag.2018.11.001. 头孢洛扎 / 他唑巴坦治疗严重 P。
Coleman K. 2011. Diazabicyclooctanes (DBOs): a potent new class of non-beta-lactam beta-lactamase inhibitors. Curr Opin Microbiol 14:550–555. doi: 10.1016/j.mib.2011.07.026. 二氮杂双环辛烷 (DBOs):一种新型强效非 β- 内酰胺 β- 内酰胺酶抑制剂。
Abboud MI, Damblon C, Brem J, Smargiasso N, Mercuri P, Gilbert B, Rydzik AM, Claridge TDW, Schofield CJ, Frère JM. 2016. Interaction of avibactam with class B metallo-β-lactamases. Antimicrob Agents Chemother 60:5655–5662. doi: 10.1128/AAC.00897-16. avibactam 与 B 类金属 β- 内酰胺酶的相互作用。
Sy SKB, Zhuang L, Beaudoin ME, Kircher P, Tabosa MAM, Cavalcanti NCT, Grunwitz C, Pieper S, Schuck VJ, Nichols WW, Derendorf H. 2017. Potentiation of ceftazidime by avibactam against β-lactam-resistant Pseudomonas aeruginosa in an in vitro infection model. J Antimicrob Chemother 72:1109–1117. 阿维巴坦增强头孢他啶对 β- 内酰胺类抗生素耐药性铜绿假单胞菌的体外感染模型。
Sader HS, Castanheira M, Flamm RK, Mendes RE, Farrell DJ, Jones RN. 2015. Ceftazidime/avibactam tested against Gram-negative bacteria from intensive care unit (ICU) and non-ICU patients, including those with ventilator-associated pneumonia. Int J Antimicrob Agents 46:53–59. doi: 10.1016/j.ijantimicag.2015.02.022. 针对重症监护室 (ICU) 和非 ICU 患者(包括呼吸机相关性肺炎患者)的革兰氏阴性细菌进行头孢他啶 / 阿维巴坦试验。
Sader HS, Castanheira M, Mendes RE, Flamm RK, Farrell DJ, Jones RN. 2015. Ceftazidime-avibactam activity against multidrug-resistant Pseudomonas aeruginosa isolated in U.S. medical centers in 2012 and 2013. Antimicrob Agents Chemother 59:3656–3659. doi: 10.1128/AAC.05024-14. 头孢他啶 - 阿维巴坦对 2012 年和 2013 年在 S. 医学中心分离的多重耐药铜绿假单胞菌的活性。
Sader HS, Castanheira M, Flamm RK. 2017. Antimicrobial activity of ceftazidime-avibactam against Gram-negative bacteria isolated from patients hospitalized with pneumonia in U.S. medical centers, 2011 to 2015. Antimicrob Agents Chemother 61:e02083-16. doi: 10.1128/AAC.02083-16. 头孢他啶 - 阿维巴坦对 2011-2015 年美国医疗中心因肺炎住院患者分离的革兰阴性菌的抗菌活性。
Sader HS, Castanheira M, Shortridge D, Mendes RE, Flamm RK. 2017. Antimicrobial activity of ceftazidime-avibactam tested against multidrug-resistant Enterobacteriaceae and Pseudomonas aeruginosa isolates from U.S. medical centers, 2013 to 2016. Antimicrob Agents Chemother 61:e01045-17. doi: 10.1128/AAC.01045-17. 2013 年至 2016 年,检测头孢他啶 - 阿维巴坦对 S 医学中心多重耐药肠杆菌科细菌和铜绿假单胞菌分离株的抗菌活性。
Kazmierczak KM, de Jonge BLM, Stone GG, Sahm DF. 2018. In vitro activity of ceftazidime/avibactam against isolates of Pseudomonas aeruginosa collected in European countries: INFORM global surveillance 2012–15. J Antimicrob Chemother 73:2777–2781. doi: 10.1093/jac/dky267. 头孢他啶 / 阿维巴坦对欧洲国家收集的铜绿假单胞菌分离株的体外活性:INFORM 全球监测 2012–15。
Sader HS, Castanheira M, Flamm RK, Jones RN. 2016. Antimicrobial activities of ceftazidime-avibactam and comparator agents against Gram-negative organisms isolated from patients with urinary tract infections in U.S. medical centers, 2012 to 2014. Antimicrob Agents Chemother 60:4355–4360. doi: 10.1128/AAC.00405-16. 2012 年至 2014 年头孢他啶 - 阿维巴坦和对照药物对分离自 S. 医学中心尿路感染患者的革兰氏阴性微生物的抗菌活性。
Nichols WW, de Jonge BLMM, Kazmierczak KM, Karlowsky JA, Sahm DF. 2016. In vitro susceptibility of global surveillance isolates of Pseudomonas aeruginosa to ceftazidime-avibactam (INFORM 2012 to 2014). Antimicrob Agents Chemother 60:4743–4749. doi: 10.1128/AAC.00220-16. 全球铜绿假单胞菌监测分离株对头孢他啶 - 阿维巴坦的体外敏感性 (INFORM 2012-2014)。
Stone GG, Bradford PA, Yates K, Newell P. 2017. In vitro activity of ceftazidime/avibactam against urinary isolates from patients in a phase 3 clinical trial programme for the treatment of complicated urinary tract infections. J Antimicrob Chemother 72:1396–1399. doi: 10.1093/jac/dkw561. 一项治疗复杂性尿路感染的 3 期临床试验项目中,头孢他啶 /avibactam 对患者尿液分离株的体外活性。
Berkhout J, Melchers MJ, van Mil AC, Seyedmousavi S, Lagarde CM, Schuck VJ, Nichols WW, Mouton JW. 2016. Pharmacodynamics of ceftazidime and avibactam in neutropenic mice with thigh or lung infection. Antimicrob Agents Chemother 60:368–375. doi: 10.1128/AAC.01269-15. 头孢他啶和阿维巴坦在中性粒细胞减少小鼠大腿或肺部感染中的药效学。
Coleman K, Levasseur P, Girard A-M, Borgonovi M, Miossec C, Merdjan H, Drusano G, Shlaes D, Nichols WW. 2014. Activities of ceftazidime and avibactam against β-lactamase-producing Enterobacteriaceae in a hollow-fiber pharmacodynamic model. Antimicrob Agents Chemother 58:3366–3372. doi: 10.1128/AAC.00080-14. 头孢他啶和阿维巴坦对中空纤维药效学模型中产 β- 内酰胺酶肠杆菌科细菌的活性。
Andes D, Craig WA. 2002. Animal model pharmacokinetics and pharmacodynamics: a critical review. Int J Antimicrob Agents 19:261–268. doi: 10.1016/S0924-8579(02)00022-5. 动物模型药代动力学和药效学:评论性综述。
Nichols WW, Newell P, Critchley IA, Riccobene T, Das S. 2018. Avibactam pharmacokinetic/pharmacodynamic targets. Antimicrob Agents Chemother 62:e02446-17. doi: 10.1128/AAC.02446-17. 阿维巴坦的药代动力学 / 药效学靶点。
Keepers TR, Gomez M, Celeri C, Nichols WW, Krause KM. 2014. Bactericidal activity, absence of serum effect, and time-kill kinetics of ceftazidime-avibactam against β-lactamase-producing Enterobacteriaceae and Pseudomonas aeruginosa. Antimicrob Agents Chemother 58:5297–5305. doi: 10.1128/AAC.02894-14. 头孢他啶 - 阿维巴坦对产 β- 内酰胺酶肠杆菌科细菌和铜绿假单胞菌的杀菌活性、无血清作用和时间 - 杀菌动力学。
Sy SKB, Zhuang L, Sy S, Derendorf H. 2018. Clinical pharmacokinetics and pharmacodynamics of ceftazidime–avibactam combination: a model-informed strategy for its clinical development. Clin Pharmacokinet 58:545. doi: 10.1007/s40262-018-0705-y. 头孢他啶 - 阿维巴坦复方制剂的临床药代动力学和药效学:临床开发的模型告知策略。
Li J, Lovern M, Green ML, Chiu J, Zhou D, Comisar C, Xiong Y, Hing J, MacPherson M, Wright JG, Riccobene T, Carrothers TJ, Das S. 2018. Ceftazidime-avibactam population pharmacokinetic modeling and pharmacodynamic target attainment across adult indications and patient subgroups. Clin Transl Sci 12:151–163. doi: 10.1111/cts.12585. 在成人适应症和患者亚组中的头孢他啶 - 阿维巴坦群体药代动力学建模和药效学达到目标。
Crandon JL, Schuck VJ, Banevicius MA, Beaudoin ME, Nichols WW, Tanudra MA, Nicolau DP. 2012. Comparative in vitro and in vivo efficacies of human simulated doses of ceftazidime and ceftazidime-avibactam against Pseudomonas aeruginosa. Antimicrob Agents Chemother 56:6137–6146. doi: 10.1128/AAC.00851-12. 比较人体模拟剂量头孢他啶和头孢他啶 - 阿维巴坦对铜绿假单胞菌的体外和体内疗效。
Carmeli Y, Armstrong J, Laud PJ, Newell P, Stone G, Wardman A, Gasink LB. 2016. Ceftazidime-avibactam or best available therapy in patients with ceftazidime-resistant Enterobacteriaceae and Pseudomonas aeruginosa complicated urinary tract infections or complicated intra-abdominal infections (REPRISE): a randomised, pathogen-directed. Lancet Infect Dis 16:661–673. doi: 10.1016/S1473-3099(16)30004-4. 头孢他啶 - 阿维巴坦或头孢他啶耐药肠杆菌科细菌和铜绿假单胞菌并发尿路感染或并发腹腔内感染患者的最佳可用疗法 (REPRISE):一项随机化、病原体导向研究。
Torres A, Zhong N, Pachl J, Timsit J, Kollef M, Chen Z, Song J, Taylor D, Laud PJ, Stone GG, Chow JW. 2018. Ceftazidime-avibactam versus meropenem in nosocomial pneumonia, including ventilator-associated pneumonia (REPROVE): a randomised, double-blind, phase 3 non-inferiority trial. Lancet Infect Dis 18:285–295. doi: 10.1016/S1473-3099(17)30747-8. 头孢他啶 - 阿维巴坦与美罗培南在包括呼吸机相关肺炎在内的院内获得性肺炎中的比较 (REPROVE):一项随机、双盲、3 期非劣效性试验。
Olsen I. 2015. New promising β-lactamase inhibitors for clinical use. Eur J Clin Microbiol Infect Dis 34:1303–1308. doi: 10.1007/s10096-015-2375-0. 新的有前景的 β- 内酰胺酶抑制剂临床应用。
Livermore DM, Warner M, Mushtaq S. 2013. Activity of MK-7655 combined with imipenem against Enterobacteriaceae and Pseudomonas aeruginosa. J Antimicrob Chemother 68:2286–2290. doi: 10.1093/jac/dkt178. MK-7655 联合亚胺培南对肠杆菌科细菌和铜绿假单胞菌的活性。
Karlowsky JA, Lob SH, Kazmierczak KM, Young K, Motyl MR, Sahm DF. 2018. In vitro activity of imipenem-relebactam against clinical isolates of Gram-negative bacilli isolated in hospital laboratories in the United States as part of the SMART 2016 program. Antimicrob Agents Chemother 62:e00169-18. doi: 10.1128/AAC.00169-18. 作为 SMART 2016 项目的一部分,亚胺培南释放杆菌对美国医院实验室分离的革兰氏阴性杆菌临床分离株的体外活性。
Lob SH, Hackel MA, Kazmierczak KM, Young K, Motyl MR, Karlowsky JA, Sahm DF, Sahm F, Sahm DF. 2017. In vitro activity of imipenem-relebactam against Gram-negative ESKAPE pathogens isolated by clinical laboratories in the United States in 2015 (results from the SMART global surveillance program). Antimicrob Agents Chemother 61:e02209-16. doi: 10.1128/AAC.02209-16. 2015 年美国临床实验室分离的革兰氏阴性 ESKAPE 病原体对亚胺培南释放杆菌的体外活性(SMART 全球监测项目的结果)。
Rhee EG, Rizk ML, Calder N, Nefliu M, Warrington SJ, Schwartz MS, Mangin E, Boundy K, Bhagunde P, Colon-Gonzalez F, Jumes P, Liu Y, Butterton JR. 2018. Pharmacokinetics, safety, and tolerability of single and multiple doses of relebactam, a β-lactamase inhibitor, in combination with imipenem and cilastatin in healthy participants. Antimicrob Agents Chemother 62:e00280-18. doi: 10.1128/AAC.00280-18. 在健康受试者中,relbactam(一种 β- 内酰胺酶抑制剂)与亚胺培南和西司他丁联合单次和多次给药的药代动力学、安全性和耐受性。
Lucasti C, Vasile L, Sandesc D, Venskutonis D, McLeroth P, Lala M, Rizk ML, Brown ML, Losada MC, Pedley A, Kartsonis NA, Paschke A. 2016. Phase 2, dose-ranging study of relebactam with imipenem-cilastatin in subjects with complicated intra-abdominal infection. Antimicrob Agents Chemother 60:6234–6243. doi: 10.1128/AAC.00633-16. 一项在复杂腹内感染受试者中评价注射用舒巴坦与亚胺培南 - 西司他丁的 2 期、剂量范围研究。
Ito-Horiyama T, Ishii Y, Ito A, Sato T, Nakamura R, Fukuhara N, Tsuji M, Yamano Y, Yamaguchi K, Tateda K. 2016. Stability of novel siderophore cephalosporin S-649266 against clinically relevant carbapenemases. Antimicrob Agents Chemother 60:4384–4386. doi: 10.1128/AAC.03098-15. 新型铁载体头孢菌素 S-649266 对临床相关碳青霉烯酶的稳定性。
Matsumoto S, Singley CM, Hoover J, Nakamura R, Echols R, Rittenhouse S, Tsuji M, Yamano Y. 2017. Efficacy of cefiderocol against carbapenem-resistant Gram-negative bacilli in immunocompetent-rat respiratory tract infection models recreating human plasma pharmacokinetics. Antimicrob Agents Chemother 61:e00700-17. doi: 10.1128/AAC.00700-17. 在重复人血浆药代动力学的免疫活性大鼠呼吸道感染模型中,头孢地尔对碳青霉烯类耐药革兰氏阴性杆菌的有效性。
Ito A, Nishikawa T, Ota M, Ito-Horiyama T, Ishibashi N, Sato T, Tsuji M, Yamano Y. 2018. Stability and low induction propensity of cefiderocol against chromosomal AmpC β-lactamases of Pseudomonas aeruginosa and Enterobacter cloacae. J Antimicrob Chemother 73:3049–3052. doi: 10.1093/jac/dky317. 头孢地尔对铜绿假单胞菌和阴沟肠杆菌染色体 AmpCβ- 内酰胺酶的稳定性和低诱导倾向。
Hackel MA, Tsuji M, Yamano Y, Echols R, Karlowsky JA, Sahm DF. 2018. In vitro activity of the siderophore cephalosporin, cefiderocol, against carbapenem-nonsusceptible and multidrug-resistant isolates of gram-negative bacilli collected worldwide in 2014 to 2016. Antimicrob Agents Chemother 62:e01968-17. doi: 10.1128/AAC.01968-17. 铁载体头孢菌素头孢地尔对 2014 年至 2016 年全球收集的碳青霉烯类抗生素不敏感和多药耐药革兰氏阴性杆菌分离株的体外活性。
Hsueh S-C, Lee Y-J, Huang Y-T, Liao C-H, Tsuji M, Hsueh P-R. 2018. In vitro activities of cefiderocol, ceftolozane/tazobactam, ceftazidime/avibactam and other comparative drugs against imipenem-resistant Pseudomonas aeruginosa and Acinetobacter baumannii, and Stenotrophomonas maltophilia, all associated with bloodstream infections in Taiwan. J Antimicrob Chemother 74:380–386. doi: 10.1093/jac/dky425. 头孢地尔、头孢洛扎 / 他唑巴坦、头孢他啶 / 阿维巴坦等对照药物对台湾血流感染相关的亚胺培南耐药铜绿假单胞菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌的体外活性。
Ghazi IM, Monogue ML, Tsuji M, Nicolau DP. 2018. Pharmacodynamics of cefiderocol, a novel siderophore cephalosporin, in a Pseudomonas aeruginosa neutropenic murine thigh model. Int J Antimicrob Agents 51:206–212. doi: 10.1016/j.ijantimicag.2017.10.008. 头孢地尔(一种新型铁载体头孢菌素)在铜绿假单胞菌中性粒细胞减少小鼠大腿模型中的药效学。
Henderson JC, Zimmerman SM, Crofts AA, Boll JM, Kuhns LG, Herrera CM, Trent MS. 2016. The power of asymmetry: architecture and assembly of the Gram-negative outer membrane lipid bilayer. Annu Rev Microbiol 70:255–278. doi: 10.1146/annurev-micro-102215-095308. 不对称的力量:革兰氏阴性外膜脂质双层的结构和组装。
Andolina G, Bencze LC, Zerbe K, Müller M, Steinmann J, Kocherla H, Mondal M, Sobek J, Moehle K, Malojčić G, Wollscheid B, Robinson JA. 2018. A peptidomimetic antibiotic interacts with the periplasmic domain of LptD from Pseudomonas aeruginosa. ACS Chem Biol 13:666–675. doi: 10.1021/acschembio.7b00822. 一种拟肽类抗生素与铜绿假单胞菌 LptD 的周质结构域相互作用。
Sader HS, Flamm RK, Dale GE, Rhomberg PR, Castanheira M. 2018. Murepavadin activity tested against contemporary (2016–17) clinical isolates of XDR Pseudomonas aeruginosa. J Antimicrob Chemother 73:2400–2404. doi: 10.1093/jac/dky227. 测试了 Murepavadin 对当代 (2016–17) XDR 铜绿假单胞菌临床分离株的活性。
Wach A, Dembowsky K, Dale GE. 2018. Pharmacokinetics and safety of intravenous murepavadin infusion in healthy adult subjects administered single and multiple ascending doses. Antimicrob Agents Chemother 62:e02355-17. doi: 10.1128/AAC.02355-17. 单次和多次递增剂量给药的健康成人受试者静脉输注莫帕他定的药代动力学和安全性。
Dale GE, Halabi A, Petersen-Sylla M, Wach A, Zwingelstein C. 2018. Pharmacokinetics, tolerability, and safety of murepavadin, a novel antipseudomonal antibiotic, in subjects with mild, moderate, or severe renal function impairment. Antimicrob Agents Chemother 62:e00490-18. doi: 10.1128/AAC.00490-18. 轻度、中度或重度肾功能损伤受试者中新型抗假单胞菌抗生素 murepavadin 的药代动力学、耐受性和安全性。
Armaganidis A, Zakynthinos S, Mandragos C. 2017. Efficacy of murepavadin coadministered with standard of care in a phase 2 study in patients with ventilator-associated pneumonia due to suspected or documented Pseudomonas aeruginosa infections, poster A459. In Abstr 37th Int Symp Intensive Care Emergency Med. ISICEM, Brussels, Belgium. 在一项 2 期研究中,对疑似或证实的铜绿假单胞菌感染所致的呼吸机相关性肺炎患者联合使用莫帕他定与标准治疗的疗效进行了评估,海报 A459。
Sader HS, Rhomberg PR, Flamm RK, Jones RN, Castanheira M. 2017. WCK 5222 (cefepime/zidebactam) antimicrobial activity tested against Gram-negative organisms producing clinically relevant β-lactamases. J Antimicrob Chemother 72:1696–1703. doi: 10.1093/jac/dkx050. 检测 WCK 5222(头孢吡肟 / 齐多巴巴坦)对产生临床相关 β- 内酰胺酶的革兰氏阴性微生物的抗菌活性。
Livermore DM, Mushtaq S, Warner M, Vickers A, Woodford N. 2017. In vitro activity of cefepime/zidebactam (WCK 5222) against Gram-negative bacteria. J Antimicrob Chemother 72:1373–1385. doi: 10.1093/jac/dkw593. 头孢吡肟 /zidebactam (WCK 5222) 对革兰氏阴性细菌的体外活性。
Sader HS, Castanheira M, Huband M, Jones RN, Flamm RK. 2017. WCK 5222 (cefepime-zidebactam) antimicrobial activity against clinical isolates of gram-negative bacteria collected worldwide in 2015. Antimicrob Agents Chemother 61:e00072-17. doi: 10.1128/AAC.00072-17. WCK 5222(头孢吡肟 - 唑巴坦)对 2015 年全球收集的革兰氏阴性菌临床分离株的抗菌活性。
Rodvold KA, Gotfried MH, Chugh R, Gupta M, Patel A, Chavan R, Yeole R, Friedland HD, Bhatia A. 2018. Plasma and intrapulmonary concentrations of cefepime and zidebactam following intravenous administration of WCK 5222 to healthy adult subjects. Antimicrob Agents Chemother 62:e00682-18. doi: 10.1128/AAC.00682-18. 健康成年受试者静脉内给予 WCK 5222 后,头孢吡肟和齐多巴巴坦的血浆和肺内浓度。
Hill C, Mills S, Ross RP. 2018. Phages & antibiotic resistance: are the most abundant entities on earth ready for a comeback?. Future Microbiol 13:711–726. doi: 10.2217/fmb-2017-0261. 噬菌体 & 抗生素耐药性:全球最丰富的实体是否准备好卷土重来?
Rossitto M, Fiscarelli EV, Rosati P. 2018. Challenges and promises for planning future clinical research into bacteriophage therapy against Pseudomonas aeruginosa in cystic fibrosis. An argumentative review. Front Microbiol 9:775. doi: 10.3389/fmicb.2018.00775. 计划针对铜绿假单胞菌囊性纤维化病的噬菌体疗法的未来临床研究的挑战和希望。
Forti F, Roach DR, Cafora M, Pasini ME, Horner DS, Fiscarelli EV, Rossitto M, Cariani L, Briani F, Debarbieux L, Ghisotti D. 2018. Design of a broad-range bacteriophage cocktail that reduces Pseudomonas aeruginosa biofilms and treats acute infections in two animal models. Antimicrob Agents Chemother 62:e02573-17. doi: 10.1128/AAC.02573-17. 在两种动物模型中设计一种可减少铜绿假单胞菌生物膜并治疗急性感染的宽范围抗菌鸡尾酒疗法。
Ferry T, Boucher F, Fevre C, Perpoint T, Chateau J, Petitjean C, Josse J, Chidiac C, L’hostis G, Leboucher G, Laurent F, Ferry T, Valour F, Perpoint T, Boibieux A, Biron F, Miailhes P, Ader F, Becker A, Roux S, Triffault-Fillit C, Conrad A, Bosch A, Daoud F, Lippman J, Braun E, Chidiac C, Lustig S, Servien E, Gaillard R, Schneider A, Gunst S, Batailler C, Fessy M-H, Herry Y, Viste A, Chaudier P, Courtin C, Louboutin L, Martres S, Trouillet F, Barrey C, Jouanneau E, Jacquesson T, Mojallal A, Braye F, Boucher F, Shipkov H, Chateau J, Gleizal A, Aubrun F, Dziadzko M, Macabéo C, Laurent F, Rasigade J-P, Dupieux C, Craighero F, Boussel L, Pialat J-B, Morelec I, Janier M, Giammarile F, Tod M, Gagnieu M-C, Goutelle S, Mabrut E. 2018. Innovations for the treatment of a complex bone and joint infection due to XDR Pseudomonas aeruginosa including local application of a selected cocktail of bacteriophages. J Antimicrob Chemother 73:2901–2903. doi: 10.1093/jac/dky263. 治疗由 XDR 铜绿假单胞菌引起的复杂骨和关节感染的创新药物包括局部应用选定的细菌噬菌体鸡尾酒疗法。
Latz S, Krüttgen A, Häfner H, Buhl EM, Ritter K, Horz HP. 2017. Differential effect of newly isolated phages belonging to PB1-like, phiKZ-like and LUZ24-like viruses against multi-drug resistant Pseudomonas aeruginosa under varying growth conditions. Viruses 9:315–319. doi: 10.3390/v9110315. 在不同生长条件下,新分离的 PB1 样、phiKZ 样和 LUZ24 样病毒噬菌体对多药耐药铜绿假单胞菌的不同作用。
Astudillo A, Leung SSY, Kutter E, Morales S, Chan HK. 2018. Nebulization effects on structural stability of bacteriophage PEV 44. Eur J Pharm Biopharm 125:124–130. doi: 10.1016/j.ejpb.2018.01.010. 雾化对噬菌体 PEV 44 结构稳定性的影响。
Chang RYK, Chen K, Wang J, Wallin M, Britton W, Morales S, Kutter E, Li J, Chan H-K. 2018. Proof-of-principle study in a murine lung infection model of antipseudomonal activity of phage PEV20 in a dry-powder formulation. Antimicrob Agents Chemother 62:e01714-17. doi: 10.1128/AAC.01714-17. 一项在小鼠肺部感染模型中开展的关于干粉制剂中抗炎性假单胞菌活性的原理验证研究。
Comeau AM, Tétart F, Trojet SN, Prère MF, Krisch HM. 2007. Phage-antibiotic synergy (PAS): β-lactam and quinolone antibiotics stimulate virulent phage growth. PLoS One 2:e799. doi: 10.1371/journal.pone.0000799. 噬菌体 - 抗生素协同作用 (PAS):β- 内酰胺和喹诺酮类抗生素刺激间质细胞增殖。
Uchiyama J, Shigehisa R, Nasukawa T, Mizukami K, Takemura-Uchiyama I, Ujihara T, Murakami H, Imanishi I, Nishifuji K, Sakaguchi M, Matsuzaki S. 2018. Piperacillin and ceftazidime produce the strongest synergistic phage–antibiotic effect in Pseudomonas aeruginosa. Arch Virol 163:1941–1948. doi: 10.1007/s00705-018-3811-0. 哌拉西林和头孢他啶在铜绿假单胞菌中产生最强的协同抗草药作用。
Karpiński TM, Szkaradkiewicz AK. 2013. Characteristic of bacteriocines and their application. Pol J Microbiol 62:223–235. 细菌素的特性及其应用。
Redero M, López-Causapé C, Aznar J, Oliver A, Blázquez J, Prieto AI. 2018. Susceptibility to R-pyocins of Pseudomonas aeruginosa clinical isolates from cystic fibrosis patients. J Antimicrob Chemother 73:2770–2776. doi: 10.1093/jac/dky261. 对囊性纤维化患者临床分离的铜绿假单胞菌 R-pyocins 的敏感性。
Dickey SW, Cheung GYC, Otto M. 2017. Different drugs for bad bugs: antivirulence strategies in the age of antibiotic resistance. Nat Rev Drug Discov 16:457–471. doi: 10.1038/nrd.2017.23. 针对有害细菌的不同药物:抗生素耐药性时代的抗病毒策略。
Heras B, Scanlon MJ, Martin JL. 2015. Targeting virulence not viability in the search for future antibacterials. Br J Clin Pharmacol 79:208–215. doi: 10.1111/bcp.12356. 靶向毒力在寻找未来抗菌剂中不可行。
Papenfort K, Bassler BL. 2016. Quorum sensing signal–response systems in Gram-negative bacteria. Nat Rev Microbiol 14:576–588. doi: 10.1038/nrmicro.2016.89. 革兰氏阴性细菌中的群体感应信号 - 应答系统。
Köhler T, Perron GG, Buckling A, van Delden C. 2010. Quorum sensing inhibition selects for virulence and cooperation in Pseudomonas aeruginosa. PLoS Pathog 6:e1000883. doi: 10.1371/journal.ppat.1000883. 群体感应抑制选择铜绿假单胞菌的毒力和协同作用。
Eibergen NR, Moore JD, Mattmann ME, Blackwell HE. 2015. Potent and selective modulation of the RhlR quorum sensing receptor by using non-native ligands: an emerging target for virulence control in Pseudomonas aeruginosa. Chembiochem 16:2348–2356. doi: 10.1002/cbic.201500357. 通过使用非天然配体对 RhlR 群体感应受体进行强效和选择性调节:铜绿假单胞菌毒力控制的新靶标。
Fleitas Martínez O, Rigueiras PO, Pires ÁDS, Porto WF, Silva ON, de la Fuente-Nunez C, Franco OL. 2018. Interference with quorum-sensing signal biosynthesis as a promising therapeutic strategy against multidrug-resistant pathogens. Front Cell Infect Microbiol 8:444. doi: 10.3389/fcimb.2018.00444. 干扰群体感应信号生物合成是对抗多药耐药病原体的一种有前景的治疗策略。
Wagner EK, Maynard JA. 2018. Engineering therapeutic antibodies to combat infectious diseases. Curr Opin Chem Eng 19:131–141. doi: 10.1016/j.coche.2018.01.007. 对抗传染病的工程化治疗性抗体。
Vincent J-L. 2014. Vaccine development and passive immunization for Pseudomonas aeruginosa in critically ill patients: a clinical update. Future Microbiol 9:457–463. doi: 10.2217/fmb.14.10. 重症患者中铜绿假单胞菌的疫苗开发和被动免疫:临床更新。
Rello J, Krenn C-G, Locker G, Pilger E, Madl C, Balica L, Dugernier T, Laterre P-F, Spapen H, Depuydt P, Vincent J-L, Bogár L, Szabó Z, Völgyes B, Máñez R, Cakar N, Ramazanoglu A, Topeli A, Mastruzzo MA, Jasovich A, Remolif CG, del Carmen Soria L, Andresen Hernandez MA, Ruiz Balart C, Krémer I, Molnár Z, von Sonnenburg F, Lyons A, Joannidis M, Burgmann H, Welte T, Klingler A, Hochreiter R, Westritschnig K. 2017. A randomized placebo-controlled phase II study of a Pseudomonas vaccine in ventilated ICU patients. Crit Care 21:22. doi: 10.1186/s13054-017-1601-9. 一项在 ICU 通气患者中开展的假单胞菌疫苗随机安慰剂对照 II 期研究。
Baer M, Sawa T, Flynn P, Luehrsen K, Martinez D, Wiener-Kronish JP, Yarranton G, Bebbington C. 2009. An engineered human antibody fab fragment specific for Pseudomonas aeruginosa PcrV antigen has potent antibacterial activity. Infect Immun 77:1083–1090. doi: 10.1128/IAI.00815-08. 针对铜绿假单胞菌 PcrV 抗原的特异性工程化人抗体 fab 片段具有强效抗菌活性。
Warrener P, Varkey R, Bonnell JC, DiGiandomenico A, Camara M, Cook K, Peng L, Zha J, Chowdury P, Sellman B, Stover CK. 2014. A novel anti-PcrV antibody providing enhanced protection against Pseudomonas aeruginosa in multiple animal infection models. Antimicrob Agents Chemother 58:4384–4391. doi: 10.1128/AAC.02643-14. 一种新型抗 PcrV 抗体,可在多种动物感染模型中增强抗铜绿假单胞菌的保护作用。
Jain R, Beckett VV, Konstan MW, Accurso FJ, Burns JL, Mayer-Hamblett N, Milla C, VanDevanter DR, Chmiel JF. 2018. KB001-A, a novel anti-inflammatory, found to be safe and well-tolerated in cystic fibrosis patients infected with Pseudomonas aeruginosa. J Cyst Fibros 17:484–491. doi: 10.1016/j.jcf.2017.12.006. KB001-A 是一种新型抗炎药,在铜绿假单胞菌感染的囊性纤维化患者中安全且耐受性良好。
Lang AB, Rudeberg A, Schoni MH, Que JU, Furer E, Schaad UB. 2004. Vaccination of cystic fibrosis patients against Pseudomonas aeruginosa reduces the proportion of patients infected and delays time to infection. Pediatr Infect Dis J 23:504–510. doi: 10.1097/01.inf.0000129688.50588.ac. 对囊性纤维化患者接种铜绿假单胞菌疫苗可降低患者感染比例,并延迟至感染时间。
Lazar H, Horn MP, Zuercher AW, Imboden MA, Durrer P, Seiberling M, Pokorny R, Hammer C, Lang AB. 2009. Pharmacokinetics and safety profile of the human anti-Pseudomonas aeruginosa serotype O11 immunoglobulin M monoclonal antibody KBPA-101 in healthy volunteers. Antimicrob Agents Chemother 53:3442–3446. doi: 10.1128/AAC.01699-08. 人抗铜绿假单胞菌 O11 血清型免疫球蛋白 M 单克隆抗体 KBPA-101 在健康志愿者中的药代动力学和安全性特征。
Le HN, Quetz JS, Tran VG, Le VTM, Aguiar-Alves F, Pinheiro MG, Cheng L, Yu L, Sellman BR, Stover CK, DiGiandomenico A, Diep BA. 2018. MEDI3902 correlates of protection against severe Pseudomonas aeruginosa pneumonia in a rabbit acute pneumonia model. Antimicrob Agents Chemother 62:e02565-17. doi: 10.1128/AAC.02565-17. MEDI3902 在兔急性肺炎模型中对严重铜绿假单胞菌肺炎的保护作用相关。
Tabor DE, Oganesyan V, Keller AE, Yu L, McLaughlin RE, Song E, Warrener P, Rosenthal K, Esser M, Qi Y, Ruzin A, Stover CK, DiGiandomenico A. 2018. Pseudomonas aeruginosa PcrV and Psl, the molecular targets of bispecific antibody MEDI3902, are conserved among diverse global clinical isolates. J Infect Dis 218:1983–1994. doi: 10.1093/infdis/jiy438. 铜绿假单胞菌 PcrV 和 Psl 是双特异性抗体 MEDI3902 的分子靶标,在全球不同的铜绿假单胞菌临床分离株中是保守的。
Ali SO, Yu XQ, Robbie GJ, Wu Y, Shoemaker K, Yu L, DiGiandomenico A, Keller AE, Anude C, Hernandez-Illas M, Bellamy T, Falloon J, Dubovsky F, Jafri HS. 2018. Phase 1 study of MEDI3902, an investigational anti-Pseudomonas aeruginosa PcrV and Psl bispecific human monoclonal antibody, in healthy adults. Clin Microbiol Infect 25:629.e1–629.e6. doi: 10.1016/j.cmi.2018.08.004. 在健康成人中进行的 MEDI3902 1 期研究,MEDI3902 是一种试验性抗铜绿假单胞菌 PcrV 和 Psl 双特异性人单克隆抗体。
François B, Chastre J, Eggiman P, Laterre PF, Torres A, Sanchez M, Esser MT, Bishop B, Bonten M, Goosens H, Jafri HS. 2016. The SAATELLITE and EVADE clinical studies within the COMBACTE consortium: a public-private collaborative effort in designing and performing clinical trials for novel antibacterial drugs to prevent nosocomial pneumonia. Clin Infect Dis 63:S46–S51. doi: 10.1093/cid/ciw245. COMBACTE 财团内的 SAATELLITE 和 EVADE 临床研究:设计和进行新型抗菌药物预防医院获得性肺炎临床试验的公私合作努力。
Ly NS, Bulitta JB, Rao GG, Landersdorfer CB, Holden PN, Forrest A, Bergen PJ, Nation RL, Li J, Tsuji BT. 2015. Colistin and doripenem combinations against Pseudomonas aeruginosa: profiling the time course of synergistic killing and prevention of resistance. J Antimicrob Chemother 70:1434–1442. doi: 10.1093/jac/dku567. 粘菌素和多利培南联合用药抗铜绿假单胞菌:分析协同杀菌和预防耐药的时间过程。
Landersdorfer CB, Rees VE, Yadav R, Rogers KE, Kim TH, Bergen PJ, Cheah S-E, Boyce JD, Peleg AY, Oliver A, Shin BS, Nation RL, Bulitta JB. 2018. Optimization of a meropenem-tobramycin combination dosage regimen against hypermutable and nonhypermutable Pseudomonas aeruginosa via mechanism-based modeling and the hollow-fiber infection model. Antimicrob Agents Chemother 62:e02055-17. doi: 10.1128/AAC.02055-17. 通过基于机制的模型和中空纤维感染模型优化美罗培南 - 妥布霉素联合给药方案对抗高度突变和非高度突变铜绿假单胞菌。
