 重症医学新视点2022-4中文
重症医学新视点2022-4中文
# 重症医学新视点 COCC 2022 年第 4 期
Atman 机器翻译,人工粗校
# 危重病的蛋白质代谢
审查目的
重症患者出现骨骼肌萎缩,可能导致那些在初始损伤后存活的患者出现明显的功能缺陷。增强型蛋白质输送有可能减轻肌肉损失,但饮食蛋白质改善患者预后的能力取决于有效的蛋白质代谢。这篇综述将讨论有关成人危重患者蛋白质转运和消化、氨基酸吸收以及肌肉蛋白质合成 (MPS) 的近期文献。
近期结果
重症患者的处方蛋白质剂量与国际推荐剂量相似,但实际输送剂量仍不充分。大多数采用较高蛋白质剂量的试验均未观察到对肌肉质量、力量或功能的影响。已经观察到重症患者在胃旁路给药时,蛋白质消化和氨基酸吸收的缺陷极少,但是餐后 MPS 受损。然而,由于直接测定蛋白质处理的复杂性,文献有限。
总结
重症患者的餐后 MPS 受损,可能加重这些患者的肌肉萎缩。在重症患者中实施的研究不仅需要评估蛋白质输送,还需要在实施增加的蛋白质剂量前进行评估。
关键词
危重病、肠内营养、肌肉消耗、蛋白质、恢复
# 要点
・向危重患者输送蛋白质仍低于国际建议。
・很少有研究表明较高的蛋白质输送量对肌肉质量、力量或功能有影响。
・重症患者在幽门后进食时,蛋白质消化和氨基酸吸收极少出现缺陷。
・危重病患者餐后肌肉蛋白合成受损。
# 引言
危重疾病幸存者会经历持续数年的相当大的功能缺陷,包括丧失独立性、延迟恢复工作的能力以及对医疗保健的依赖性增加 [1,2&]。一般认为这种功能恢复不佳的主要驱动因素是在重症监护室 (ICU) 中观察到的严重骨骼肌萎缩,患者在机械通气 10 天内失去了 30% 的四头肌骨骼肌质量 [3]。重症监护研究的重点是减轻这种肌肉损失,希望改善患者恢复 [4&](# 书签 6)。
全身而言,刺激可能有助于维持肌肉质量的肌肉蛋白质合成代谢依赖于通过摄入膳食蛋白质的前体氨基酸的持续可用性。在危重疾病中,肌肉蛋白质代谢调节受损,主要由增加的肌肉蛋白质分解驱动 [5&]。通过增加蛋白质递送刺激肌肉蛋白质合成 (MPS) 或减少肌肉蛋白质分解 (MPB) 可降低这些患者的肌肉丢失率。然而,饮食蛋白质减轻肌肉质量损失的能力取决于有效的蛋白质代谢。这篇综述的目的是描述蛋白质从处方和运输,到消化和吸收,以及肌肉蛋白质转换的代谢,以阐明蛋白质在危重疾病恢复中的作用(图 1)。
# 蛋白质处方和供给
国际重症监护营养指南推荐的蛋白质供给量为 1.2g 蛋白质 /kg 体重 / 天或更高 [6,7&](# 书签 12)。临床实践中大量遵循这些指南;实践调查表明,澳大利亚和新西兰 ICU 中的大多数营养师处方为 1.2-1.5 g 蛋白质 /kg/ 天,严重创伤、烧伤或接受连续肾脏替代治疗的患者使用更大剂量 [8&]。同样,在澳大利亚和新西兰 5 间 ICU 的 120 例患者中进行的一项观察性研究报告平均蛋白质处方为 1.46 g/kg/d [9&]。使用国际营养调查在全球水平报告了相似的蛋白质处方 1.3(四分位距 [IQR]:1.0-1.5)g/kg/d,数据来自 187 家 ICU [10]。然而,蛋白质处方并不总是等于蛋白质输送。
在澳大利亚和新西兰 5 间 ICU 的观察性研究中,与处方的 1.46 g/kg/d (60%) 相比,蛋白质输注仅为 0.88 g/kg/d [9&]]。同样,国际营养调查数据仅反映了 55% 处方蛋白质目标 [10] 的蛋白质充分性。虽然目前的实践明显未反映国际推荐,但应对临床试验结果进行评估,以真正了解增强蛋白质对患者预后的影响。
# 蛋白和预后
虽然重症患者的康复受损已有充分描述,但对于营养干预对康复的影响知之甚少。值得注意的是,近期一项大型观察性数据事后分析评价了 16489 例患者,以确定蛋白质摄入量与住院死亡率和存活出院之间的相关性,使用基于模拟喂养策略的先进 cox 回归模型。该 posthoc 报告,与低蛋白饮食相比,较晚(第 5-11 天)的标准蛋白质摄入(0.8-1.2 g/kg/ 天)与住院死亡率风险降低(最小 0.75(95% 置信区间 [CI] 0.64-0.87))和存活出院风险升高(最大 HR 1.98 (95% CI 1.72-2.28) 相关,而较早(第 1-11 天)的标准蛋白质摄入或高蛋白摄入与预后进一步改善无关 [11&&]。虽然许多非干预性研究报告增强蛋白质对预后的影响相互矛盾 [12&&,13&,14],但是很少进行随机对照试验 (RCT)。在对给予肠内蛋白质以满足国际指南推荐的研究进行的一项系统回顾中,与常规护理相比,RCT 的缺乏已经得到证实,该回顾显示 6 项确定的 RCT 中只有一项包括了肌肉质量或力量的测量 [15&],这在最近的一项系统回顾中被重复 [16&&]。
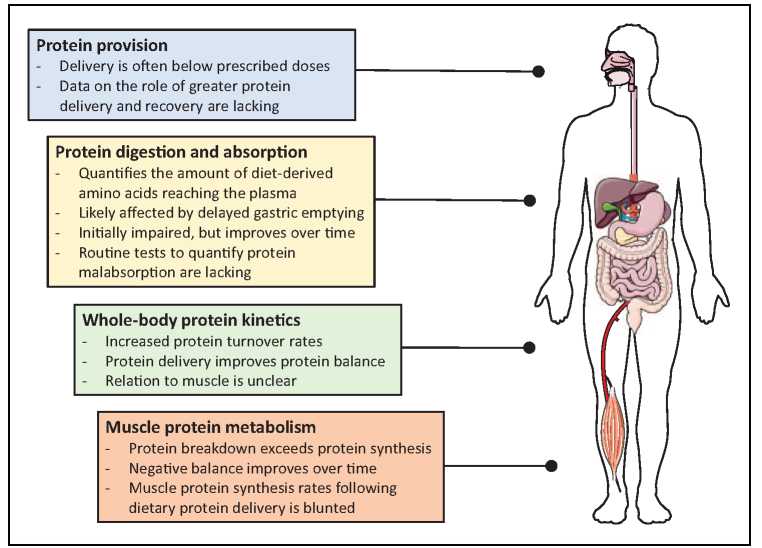
图 1. 危重病患者的蛋白质代谢要素概述。
在危重病患者中进行的膳食蛋白质干预的 RCT 包括肌肉质量或功能相关预后,见表 1。来自澳大利亚的两项 RCT 将患者随机分配至接受增强蛋白质静脉内给药(n = 119 例患者)[17] 或肠内给药联合增强卡路里给药(n = 60 例患者)[18],两者均报告随着蛋白质给药的增加,超声衍生的肌肉损失得到更大的改善。2020 年,McNelly 等 [19&&] 报告在 121 例患者中,间歇 EN 较连续 EN 方案改善了蛋白质充分性,但两组之间肌肉损失无后续差异。两个 RCT 评估了羟甲基丁酸 (HMB),亮氨酸的代谢产物,已知可减少健康状态下肌肉蛋白质分解,对计算机断层扫描衍生的股肌体积损失(n = 50 例患者)[20&&] 和超声衍生的四头肌横断面积 [21] 的影响,任一试验中均未观察到组间肌肉损失的差异。最近,Dresen et al.[22&&] 随机分配 42 例患者接受 1.8 或 1.2g 蛋白质 /kg/d,报告两组之间超声衍生的四头肌肌层厚度损失随时间的变化无差异。
在大多数 RCT 中,没有观察到蛋白质干预的影响,可能与蛋白质代谢有关,如果蛋白质消化、氨基酸吸收或肌肉蛋白质合成代谢途径受损,提供蛋白质不太可能减少肌肉损失。
# 危重病的蛋白质代谢
蛋白质消化吸收
EN 被认为是重症患者的首选给药途径 [6]。通过该途径提供的膳食蛋白质需要消化为氨基酸,随后在饮食衍生的氨基酸进入体循环并进入外周组织(如肌肉)之前,肠道吸收和内脏组织代谢 [23]。餐后循环必需氨基酸的升高尤其是驱动对饮食蛋白质的合成代谢反应。与健康对照相比,在重症患者中,幽门后给予混合营养推注后循环必需氨基酸的升高最初似乎减弱 [24&]。
蛋白消化和吸收率最好使用内标蛋白进行体内定量,内标蛋白在蛋白基质中含有同位素标记的氨基酸 [25]。消化和随后吸收内在标记的蛋白质后,可通过连续采血测量标记的饮食氨基酸释放到循环中 [23]。考虑到实施该方法所需的成本和广泛的基础设施和专业知识,迄今为止仅有两项研究在重症患者中使用了内在标记的蛋白质,观察到不同程度的消化和吸收障碍。Liebau 等人 [26] 报告,与健康志愿者相比,营养素连续胃内给药时,8 小时内食物氨基酸向循环中的释放受损。Chapple et al.[27&] 与健康志愿者相比,在幽门后给予蛋白质,并观察到食物氨基酸释放到循环中的初始损害,但在 6h 研究期间无差异,表明消化和吸收轻微延迟但完全。这表明,胃排空延迟可能是危重疾病期间消化和吸收受损的主要驱动因素。重症患者常见胃肠功能障碍,包括胃潴留、腹泻和外分泌胰腺功能不全,可能限制肠内提供的蛋白质的摄取和合成代谢 [28]。不幸的是,尚无临床可用的试验可对蛋白质消化和吸收进行常规定量,这意味着蛋白质吸收不良通常是隐匿性的,未在蛋白质处方中说明。我们最近使用一种单一同位素标记的氨基酸肠内输注来测量饮食中氨基酸释放到循环中,观察到即使连续喂养氨基酸也出现在中心循环中,具有周期性脉冲,这在一些危重患者中会丢失 [29]。需要阐明这种情况的代谢结果。
蛋白质动力学
蛋白质处于不断转换状态,不断合成和分解。在重症患者中,蛋白质合成与分解速率之间的不平衡导致分解代谢状态,机体蛋白质净损失。可采用氮平衡技术评估全身蛋白质平衡,氮是人体氨基酸的必需成分。通过从尿氮排泄测定的总氮损失中减去所有氮摄入量,可计算表示全身蛋白质损失或增加的净平衡。重症患者的特征为负氮平衡,累积氮平衡与 ICU 收治期间股骨肌肉体积的变化相关 [30]。虽然缺乏改善氮平衡效应的稳健前瞻性数据,但观察性数据表明,氮平衡更正的患者预后改善 [31,32]。测量氮平衡有一定的局限性,应谨慎解释。估计了除尿排泄外的氮损失(如粪便排泄或出汗损失),可能会发生变化,特别是在重症患者中。此外,氮平衡仅反映总体蛋白质净平衡,而不区分蛋白质合成或分解率。最后,建议在蛋白质摄入量不同的情况下,通过数天的适应期获得准确的平衡。
表 1. 在危重成人中评估饮食蛋白质干预对肌肉质量、力量或功能影响的随机对照试验
| 作者,年份 | 患者数量 | 干预 | 对照 | 肌肉质量或功能结果 | 蛋白质供给 | 结果 |
|---|---|---|---|---|---|---|
| Ferrie,2016[17] | 119 名患者 | 1.2 g/kg IV 氨基酸 | 0.8 g/kg IV 氨基酸 | 超声衍生的肌肉损失握力 | 前 7 天内的氨基酸摄入量;对照 0.90 士 0.21 vs. 干预 1.09 士 0.22;P < 0.001 | D7 时超声衍生前臂肌肉厚度越大,蛋白质越高(对照组:2.8±0.4 vs. 干预组 3.2±0.4 cm;P < 0.0001),ICU 出院时握力越大的趋势是蛋白质越高(对照组:15.8 士 10.3 vs. 干预:18.5 士 10.4 cm;P = 0.054) |
| Fetterplace,2018[18] | 60 名患者 | 增加热量和蛋白质干预 | 常规护理 | 从入住 ICU 至出院时超声衍生的四头肌肌层厚度的变化 | 对照 0.75 士 0.11 vs. 干预:i 1.2±0.30 g 蛋白质 /kg/ 天;平均差异 (95% CI):0.45 (0.33-0.56) g 蛋白质 /kg/ 天;P < 0.001 | 随着蛋白质水平升高,超声引导的肌肉损失改善幅度更大(减少 0.22 cm 的损失 (95% CI 0.06-0.38,P = 0.01)) |
| McNelly,2020 [19 和] | 121 名患者 | 间歇性 EN | 连续 EN | 10 天内超声衍生的股直肌横断面积的变化 | 蛋白质充分性与估计的要求相比:对照 69.9 (95% CI 66.6--73.1)% vs. 干预 80.3 (95% CI 77.3-83.4)%;P < 0.001) | 两组之间肌肉损失无差异(差异:-1.1 (95% CI-6.1-4.0)%;P = 0.676) |
| Nakamura,2020 年 [20&&] | 50 名患者 | 标准 EN + 3g HMB,14g 精氨酸,14g 谷氨酰胺 | 标准 EN | 从第 1 天至第 10 天 CT 衍生的股骨肌肉体积损失率 | 总蛋白输送无差异:control50.1 士 14.1 vs. 干预 54.5 士 10.8 g / 天;P = 0.31 | 组间 CT 衍生的股骨肌肉损失无差异(对照组:14.4 士 1.6 vs. 干预:11.4 士 1.6%; P = 0.18) |
| Viana, 2021[21] | 30 名患者 | HMB | 安慰剂(麦芽糊精) | 第 4 天至第 15 天超声衍生的四头肌横断面积的损失幅度 | 组间总蛋白质输送无差异:对照组 0.82 (95% CI 0.51-1.09) vs. 干预组 0.90 (95% CI 0.75--1.19) g/kg/ 天 | 组间肌肉损失无差异;平均骨骼肌面积(对照组 D1 114 (95% CI 43--185.8) 至 D14 100.4 (95% CI 32.6-168.2) cm2 vs. 干预组 D1 110.5 (95% CI 43.7--177.3) 至 D14 99.32 (95% CI 25.7--172.92) cm2,P = 0.86) |
| Dresen, 2021[22&&] | 42 名患者 | 1.8 g 蛋白质 /kg/ 天 | 1.2 g 蛋白质 /kg/ 天 | 从研究入选至第 2 周和第 4 周,超声引导下四头肌肌层厚度的变化 | 蛋白质递送;对照 1.0±0.5 vs 干预 1.5 士 0.5 g/kg/d | 组间肌肉损失无差异;对照组平均 QMLT 变化为 - 0.28 士 0.08 vs. 干预 - 0.15 士 0.08 mm;P = 0.368 |
CI,置信区间;EN,肠内营养;HMB,羟甲基丁酸;IV,静脉注射;kg,千克;pts,患者。
评估全身蛋白质周转的更直接方法是使用稳定同位素示踪剂。通过静脉输注同位素标记的氨基酸,可以确定这种氨基酸的全身转换率,并指示全身蛋白质合成和分解率。在重症患者中进行的稳定同位素研究表明,全身蛋白质周转率增加,蛋白质分解超过合成率,的确随时间改善 [5&]。在一项近期研究中,与仅 50% 的热量目标相比,在接受全目标肠内营养的重症患者中,全身蛋白质周转率改善更大 [33&]。改善全身蛋白质周转是否转化为患者的临床获益仍有待确定。
肌肉蛋白质合成
与全身蛋白质类似,危重疾病期间的骨骼肌损失是肌肉蛋白质分解超过 MPS 的结果 [34&]。尽管如上所述,可在全身水平相对容易地测量对饮食蛋白质的反应,但由于技术无法区分肌肉特异性蛋白质合成代谢,其解释受到限制 [35]。MPS 约占全身蛋白质合成的四分之一,这意味着全身蛋白质更新的变化不一定反映骨骼肌的变化。骨骼肌蛋白质合成可以通过两种方法评估:通过腿部或手臂的氨基酸动静脉 (AV) 平衡,使用或不使用稳定同位素示踪剂和稳定同位素示踪剂动力学结合肌肉活检采集和测量直接掺入肌肉蛋白质 [36]。
在成人和儿童重症患者中进行的 AV - 平衡研究显示,重症疾病急性期存在的净分解代谢状态确实随时间推移而改善 [37,38]。根据临床治疗,在接受连续 EN 的重症成人中,Gamrin-Gripenberg 等人 [37] 在腿部使用 AV 平衡,并进行单次骨骼肌活检;他们观察到在 ICU 住院期间 MPS 发生率增加,肌肉蛋白质分解无变化。
仅在一项研究中评估了稳定同位素示踪法,直接评估危重病患者中随饮食蛋白质变化的骨骼肌蛋白质周转。Chapple et al.[27&] 使用经十二指肠推注给药的内在标记的全脂牛奶蛋白,同时进行三次骨骼肌活检,比较 15 例重症患者与 10 例匹配的健康对照者的餐后 MPS 率。他们报告,两组中的 MPS 率均随着十二指肠饮食中蛋白质的摄入而从空腹时升高 (P = 0.046);但是,重症患者的餐后 MPS 率较低 (0.028±0.010 vs. 0.043±0.008%-h-1;P = 0.001),证实了对饮食中蛋白质的合成代谢抵抗 [27&]。
# 改善蛋白质利用以维持肌肉质量的未来策略
如上所述,更好地理解危重疾病中发生的蛋白质代谢改变有助于指导未来的策略,以改善蛋白质利用和维持骨骼肌质量。应通过高蛋白质肠内制剂 [39&] 或模块化蛋白质推注 [18] 等策略来解决危重患者的次优蛋白质输送。较高的蛋白质剂量可有效刺激健康受试者的 MPS [23],因此,目前正在 RCT 中研究增加蛋白质剂量刺激危重疾病患者较高 MPS 发生率的能力 [23]。https://www.anzctr.org.au](https://www.anzctr.org.au/);ACTRN12620000776909)。
通过提供不需要消化的游离氨基酸或寡肽作为饮食蛋白质来改善蛋白质的消化率,增加健康外周组织循环中氨基酸的可用性 [40]。这可能是重症患者的一种潜在策略,其中蛋白质被输送至胃中,胃排空延迟可能会损害饮食氨基酸的全身释放 [41]。
改善危重疾病患者蛋白质利用的其他未来靶点可能来自于在其他出现对饮食蛋白质合成代谢抵抗的人群中有效的策略,如高龄、肥胖和胰岛素抵抗。在危重疾病中进行挑战的体力活动,可以使用神经肌肉刺激或床上循环等策略实现 [42,43];目前正在进行一些关于该主题的试验(ClinicalTrials.gov:NCT04099108 和 NCT05197231)。目前正在研究使用已知能够刺激 MPS 的特定代谢物,如 β- 羟基 -β- 甲基丁酸 (HMB) 或损害肌肉蛋白分解(如酮体)的治疗,但目前缺乏支持其临床使用的有力证据 [44,45]。
最后,新方法如指示氨基酸氧化 (IAAO) 技术可用于评估输送较大量蛋白质不再有助于全身蛋白质合成的点,但该方法尚未在重症患者中应用 [35]。
# 结论
尽管国际推荐建议为重症患者提供更大的蛋白质剂量,但是增强蛋白质的随机对照试验未能显示肌肉质量的获益。最近采用先进的示踪方法评估蛋白质代谢的研究观察到,与健康相比,给予饮食蛋白质后,总蛋白质消化和氨基酸吸收最初延迟但完全。相反,在危重疾病中肌肉质量的损失可能是由于肌肉蛋白质分解急剧增加,并且可能会因现在描述的对饮食蛋白质合成反应受损的肌肉蛋白质而加剧。未来的研究应旨在解决这种蛋白质利用受损,以维持骨骼肌质量和改善患者恢复。
# REFERENCES
DETAILS
REFERENCES
- Deane AM, Little L, Bellomo R, et al. Outcomes six months after delivering 100% or 70% of enteral calorie requirements during critical illness (TARGET). A randomized controlled trial. Am J Respir Crit Care Med 2020; 201:814-822.
2[■]. van Gassel RJJ, Bels J, Remij L, et al. Functional outcomes and their association with physical performance in mechanically ventilated coronavirus disease 2019 survivors at 3 months following hospital discharge: a cohort study. Crit Care Med 2021; 49:1726-1738.
A comprehensive assessment of physical function, strength, and skeletal muscle architecture in critically ill survivors 3-months following admission to an ICU with COVID-19.
- Puthucheary ZA, Rawal J, McPhail M, et al. Acute skeletal muscle wasting in critical illness. JAMA 2013; 310:1591-1600.
4[■]. Chapple LS, Ridley EJ, Chapman MJ. Trial design in critical care nutrition: the past, present and future. Nutrients 2020; 12:3694.
An expert opinion piece that provides a critique on trial design features of past, present and future clinical trials in the field of critical care nutrition.
5[■]. Liebau F, Deane AM, Rooyackers O. Protein absorption and kinetics in critical illness. Curr Opin Clin Nutr Metab Care 2021; 24:71-78.
A recent review on the disturbances of protein metabolism that are related to the loss of muscle mass in the criticalli ill patient.
- Singer P, Blaser AR, Berger MM, et al. ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr 2019; 38:48-79.
7[■]. Compher C, Bingham AL, McCall M, et al. Guidelines for the provision of nutrition support therapy in the adult critically ill patient: the American Society for Parenteral and Enteral Nutrition. JPEN J Parenter Enteral Nutr 2021; 46:12-41.
An update to the ASPEN clinical nutrition guidelines for critically ill patients, with an indepth appraisal of recent evidence on the impact of protein delivery on outcomes in these patients.
8[■]. Lyons GCE, Summers MJ, Schultz TJ, et al. Protein prescription and delivery practices in critically ill adults: a survey of Australian and New Zealand intensive care dietitians. Aust Crit Care 2021; S1036-7314(21)00130-2.
A quantitative survey of 67 ICU dietitians from Australia and New Zealand that reports common protein prescriptions to the majority of critically ill patients of 1.2-1.5 g/kg/day.
9[■]. Arunachala Murthy T, Bellomo R, Chapman M, et al. Protein delivery in mechanically ventilated adults in australia and new zealand: current practice. Crit Care Resusc 2021; 23:386-393.
A prospective observational study of current protein delivery in 120 critically ill patients from 5 sites within Australia and New Zealand. This study reported the mean protein delivery to be 0.88 g/kg/day.
- Heyland DK, Weijs PJ, Coss-Bu JA, et al. Protein delivery in the intensive care unit: optimal or suboptimal? Nutr Clin Prac 2017; 32: (Suppl): 58S-571S.
11[■][■]. Hartl WH, Kopper P, Bender A, et al. Protein intake and outcome of critically ill patients: analysis of a large international database using piece-wise exponential additive mixed models. Crit Care 2022; 26:7.
This is one of the largest analyses of an international database that determined associations between both protein dose (low: <0.8 g/kg per day, standard: 0.8-1.2 g/kg per day, high: >1.2 g/kg per day) and timing of protein delivery (early: day 1-4, late: day 5-11) on outcomes in 16,489 critically ill patients. Late standard protein delivery was associated with a lower risk of in-hospital death when compared to a low protein delivery.
12[■][■]. Lambell KJ, Goh GS, Tierney AC, et al. Marked losses of computed tomography-derived skeletal muscle area and density over the first month of a critical illness are not associated with energy and protein delivery. Nutrition 2021; 82:111061.
This study provides a comprehensive assessment of skeletal muscle area and density using CT images over time in critically ill patients. Significant loss of skeletal muscle area was observed, yet the degree of muscle loss was not associated with the amount of energy or protein delivered to these patients.
13[■]. Looijaard W, Dekker IM, Beishuizen A, et al. Early high protein intake and mortality in critically ill icu patients with low skeletal muscle area and -density. Clin Nutr 2020; 39:2192-2201.
A retrospective analysis of CT-dervied skeletal muscle area and density from 739 critically ill patients that showed early high protein delivery was associated with lower mortality in those patients with low skeletal muscle area and density, but not in those patients with normal skeletal muscle.
- Gomes SM, Carvalho C, Borges F, et al. The impact of early protein intake and nutritional status in critically ill patients. Clin Nutr ESPEN 2020; 40:511.
15[■]. Fetterplace K, Gill BMT, Chapple LS, et al. Systematic review with meta-analysis of patient-centered outcomes, comparing international guideline-recommended enteral protein delivery with usual care. JPEN J Parenter Enteral Nutr 2020; 44:610-620.
A systematic review of randomised controlled trials in critically ill patients that reported enteral protein doses at <1.2 g/kg/day compared to levels recommended in international guidelines (>=1.2 g/kg/day). Of the 6 trials identified, insufficient data on outcomes of muscle mass, strength or function were available to enable meta-analysis.
16[■][■]. Lee ZY, Yap CSL, Hasan MS, et al. The effect of higher versus lower protein delivery in critically ill patients: a systematic review and meta-analysis of randomized controlled trials. Crit Care 2021; 25:260.
A recent systematic review and meta-analysis of 19 RCTs that provided higher versus lower protein doses. Higher protein delivery was not associated with improved clinical or patient-centred outcomes.
Ferrie S, Allman-Farinelli M, Daley M, et al. Protein requirements in the critically ill: a randomized controlled trial using parenteral nutrition. JPEN J Parenter Enteral Nutr 2016; 40:795-805.
Fetterplace K, Deane AM, Tierney A, et al. Targeted full energy and protein delivery in critically ill patients: a pilot randomized controlled trial (Feed trial). JPEN J Parenter Enteral Nutr 2018; 42:1252-1262.
19[■][■]. McNelly AS, Bear DE, Connolly BA, et al. Effect of intermittent or continuous feed on muscle wasting in critical illness: a phase 2 clinical trial. Chest 2020; 158:183-194.
A RCT comparing intermittent versus continuous delivery of enteral nutrition in critically ill patients in which the intermittent nutrition group received higher protein doses. There were no differences in ultrasound-derived muscle size between groups.
20[■][■]. Nakamura K, Kihata A, Naraba H, et al. Beta-hydroxy-beta-methylbutyrate, arginine, and glutamine complex on muscle volume loss in critically ill patients: a randomized control trial. JPEN J Parenter Enteral Nutr 2020; 44:205-212.
A 50 patient RCT exploring the effect of HMB on CT-derived femoral muscle volume loss, showing no difference between the intervention (HMB) and control groups.
- Viana MV, Becce F, Pantet O, et al. Impact of beta-hydroxy-beta-methylbutyrate (HMB) on muscle loss and protein metabolism in critically ill patients: a RCT. Clin Nutr 2021; 40:4878-4887.
22[■][■]. Dresen E, Weissbrich C, Fimmers R, et al. Medical high-protein nutrition therapy and loss of muscle mass in adult icu patients: a randomized controlled trial. Clin Nutr 2021; 40:1562-1570.
A RCT in 42 critically ill patients comparing delivery of 1.2 versus 1.8 g protein/kg/day on ultrasound-derived muscle loss, reporting greater protein delivery did not attenuate muscle loss.
- Gorissen SHM, Trommelen J, Kouw IWK, et al. Protein type, protein dose, and age modulate dietary protein digestion and phenylalanine absorption kinetics and plasma phenylalanine availability in humans. J Nutr 2020; 150:2041-2050.
24[■]. van Gassel RJJ, van de Poll MCG, Schaap FG, et al. Postprandial rise of essential amino acids is impaired during critical illness and unrelated to small-intestinal function. JPEN J Parenter Enteral Nutr 2021; 46:114-122.
A small physiological study comparing amino acid concentrations following a postpyloric mixed meal test in both healthy volunteers and critically ill patients in relation to small-intestinal function measured by 3-O-methyl glucose uptake.
Trommelen J, Holwerda AM, Nyakayiru J, et al. The intrinsically labeled protein approach is the preferred method to quantify the release of dietary protein-derived amino acids into the circulation. Am J Physiol Endocrinol Metab 2019; 317:E433-E434.
Liebau F, Wernerman J, van Loon LJ, et al. Effect of initiating enteral protein feeding on whole-body protein turnover in critically ill patients. Am J Clin Nutr 2015; 101:549-557.
27[■]. Chapple LS, Kouw IW, Summers MJ, et al. Muscle protein synthesis following protein administration in critical illness. Am J Resp Crit Care Med 2022; Online ahead of print, doi: 10.1164/rccm.202112-2780OC.
An innovative physiological trial reporting for the first time the comprehensive assessment of intraduodenally delivered dietary protein metabolism including protein digestion, amino acid absorption, and rates of both fasting and postprandial skeletal muscle protein synthesis.
Reintam Blaser A, Preiser JC, Fruhwald S, et al. Gastrointestinal dysfunction in the critically ill: a systematic scoping review and research agenda proposed by the section of metabolism, endocrinology and nutrition of the European Society of Intensive Care Medicine. Crit Care 2020; 24:224.
Liebau F, Kiraly E, Olsson D, et al. Uptake of dietary amino acids into arterial blood during continuous enteral feeding in critically ill patients and healthy subjects. Clin Nutr 2021; 40:912-918.
Nakano H, Hashimoto H, Mochizuki M, et al. Urine titin n-fragment as a biomarker of muscle injury for critical illness myopathy. Am J Respir Crit Care Med 2021; 203:515-518.
Kim TJ, Park SH, Jeong HB, et al. Optimizing nitrogen balance is associated with better outcomes in neurocritically ill patients. Nutrients 2020; 12:3137.
Dreydemy G, Coussy A, Lannou A, et al. Augmented renal clearance, muscle catabolism and urinary nitrogen loss: Implications for nutritional support in critically ill trauma patients. Nutrients 2021; 13:3554.
33[■]. Sundstrom Rehal M, Liebau F, Wernerman J, et al. Whole-body protein kinetics in critically ill patients during 50 or 100% energy provision by enteral nutrition: a randomized cross-over study. PLoS One 2020; 15:e0240045.
A small randomized trial showing that a reduced eneteral intake in critically ill patients leads to a larger loss of body protein.
34[■]. van Gassel RJJ, Baggerman MR, van de Poll MCG. Metabolic aspects of muscle wasting during critical illness. Curr Opin Clin Nutr Metab Care 2020; 23:96-101.
A recent review discusssing the mechanisms and metabolic drivers for the observed muscle loss in critically ill patients.
Trommelen J, van Loon LJC. Assessing the whole-body protein synthetic response to feeding in vivo in human subjects. Proc Nutr Soc 2021; 80:139-147.
Chapple LS, Dirks ML, Kouw IW. Stable isotope approaches to study muscle mass outcomes in clinical populations. Clin Nutr Open Sci 2021; (36):98-108.
Gamrin-Gripenberg L, Sundstrom-Rehal M, Olsson D, et al. An attenuated rate of leg muscle protein depletion and leg free amino acid efflux over time is seen in ICU long-stayers. Crit Care 2018; 22:13.
Malagaris I, Herndon DN, Polychronopoulou E, et al. Determinants of skeletal muscle protein turnover following severe burn trauma in children. Clin Nutr 2019; 38:1348-1354.
39[■]. Chapple LS, Summers MJ, Bellomo R, et al. Use of a high-protein enteral nutrition formula to increase protein delivery to critically ill patients: a randomized, blinded, parallel-group, feasibility trial. JPEN J Parenter Enteral Nutr 2020; 45:699-709.
One of the first RCTs of augmented protein delivery to critically ill patients while maintaining isocaloric and isovolumetric delivery.
Weijzen MEG, van Gassel RJJ, Kouw IWK, et al. Ingestion of free amino acids compared with an equivalent amount of intact protein results in more rapid amino acid absorption and greater postprandial plasma amino acid availability without affecting muscle protein synthesis rates in young adults in a double-blind randomized trial. J Nutr 2022; 152:59-67.
Chapple LS, Summers MJ, Weinel LM, et al. Effects of standard vs energy-dense formulae on gastric retention, energy delivery, and glycemia in critically ill patients. JPEN J Parenter Enteral Nutr 2021; 45:710-719.
Nickels MR, Aitken LM, Barnett AG, et al. Acceptability, safety, and feasibility of in-bed cycling with critically ill patients. Aust Crit Care 2020; 33:236-243.
Liu M, Luo J, Zhou J, et al. Intervention effect of neuromuscular electrical stimulation on ICU acquired weakness: a meta-analysis. Int J Nurs Sci 2020; 7:228-237.
Goossens C, Weckx R, Derde S, et al. Adipose tissue protects against sepsis-induced muscle weakness in mice: From lipolysis to ketones. Crit Care 2019; 23:236.
Supinski GS, Netzel PF, Westgate PM, et al. A randomized controlled trial to determine whether beta-hydroxy-beta-methylbutyrate and/or eicosapentaenoic acid improves diaphragm and quadriceps strength in critically ill mechanically ventilated patients. Crit Care 2021; 25:308.
# 危重病应用维生素 C 的更新
doi: 10.1097/MCC.0000000000000951
综述目的
最近几项研究探索了静脉注射维生素 C 在脓毒症中的作用。我们旨在总结他们的研究结果,为未来的研究提供视角。
近期结果
脓毒症试验评估了 6 g / 天静脉注射维生素 C 伴或不伴硫胺素(维生素 B1)和 / 或氢化可的松与安慰剂或氢化可的松对比。网络荟萃分析报告,未证实静脉维生素 C、硫胺素、氢化可的松或这些药物的联合给药可降低长期死亡率。然而,成分网络荟萃分析提示高剂量(> 6g / 天)和极高剂量维生素 C(> 12g / 天)与死亡率降低相关,但确定性较低。然而,临床前研究已经推进到更高剂量的静脉维生素 C 治疗,因为一项界定危害范围的综述报告称,给予了超大剂量的静脉维生素 C(50-100g / 天),没有任何结论性的不良反应。在革兰氏阴性绵羊模型中,给予超大剂量维生素 C(相当于 150 g / 天)后,肾组织灌注不足得到逆转,随后肾功能得到改善。
总结
在危重患者中静脉给予维生素 C 的作用尚未确定,可能具有剂量依赖性。临床前数据证实,对极高或极其超高剂量维生素 C 进行临床研究是合理的。
关键词
急性肾损伤、高钠血症、兆剂量、脓毒症、感染性休克、维生素 C
# 要点
・最初的临床研究表明,静脉注射维生素 C 对器官功能障碍具有剂量依赖性作用。
・最近的网络荟萃分析和成分网络荟萃分析提示,高剂量静脉注射维生素 C(> 12 g / 天)可能与感染性休克患者死亡率降低相关。
・近期在大型动物中进行的临床前研究表明,在脓毒性休克中给予超大剂量维生素 C 具有明显的生理学益处。
・许多评估 COVID-19 静脉维生素 C 治疗效果的试验正在进行中,尚未获得重要结果。
[注] 新英格兰杂志 2022.6 发表的《重症监护病房成人脓毒症患者静脉输入维生素 C 的试验》得出结论: (opens new window)在 ICU 接受血管加压药治疗的脓毒症成人患者中,接受维生素 C 静脉给药(剂量为 50 mg/kg)的患者与接受安慰剂的患者相比,28 日死亡或发生持续性器官功能障碍的风险较高。
# 引言
维生素 C 具有抗氧化特性,是儿茶酚胺合成的辅助因子 [1,2]。由于许多危重症都伴有氧化应激和全身血管张力降低,因此维生素 C 的生物学作用有望有助于逆转活性氧诱发的血管麻痹状态 [3,4]。观察性研究报告,感染性休克患者的内源性维生素 C 水平降低,为给予外源性维生素 C 提供了额外依据 [5,6]。通过在肠上皮的转运效率严格控制维生素 C 的血浆浓度不超过生理上限 [7],使得通过肠内途径的高剂量给药无效。因此,已经探索了维生素 C 静脉给药,以实现维生素 C 给药的可能获益,并快速起效,且用量足以应对危重疾病的极端氧化应激。在危重症中静脉给予维生素治疗的这种原理最近导致了几项临床试验。
# 临床研究中用于脓毒症的维生素 C:剂量可能有问题
一项 I 期试验,重点关注对重度脓毒症患者静脉给予维生素 C 的安全性,该试验是在达到超生理血浆浓度时检查其临床效应的首项试验 [8]。24 例患者随机分为 3 组,分别接受低剂量维生素 C (50 mg/kg/24 h) 或高剂量维生素 C (200 mg/kg/24 h) 静脉输注,或安慰剂(5% 右旋糖 / 水)。基线时血浆维生素 C 水平低于正常,采用低剂量或高剂量维生素 C 时迅速上升至超生理水平 [8]。这项 I 期试验没有观察到不良安全性事件。接受维生素 C 治疗的患者表现出 SOFA 评分呈剂量依赖性降低,而安慰剂组未表现出这种降低。结果表明,50 mg/kg/24 h 维生素 C 足以达到所需的超生理浓度。此外,临床预后的获益呈剂量依赖性,200 mg/kg/24 h 的耐受性也良好。
上述安全性试验之后进行 CIT-RIS-ALI 试验,入组 170 例感染性 ARDS 患者 [9]。干预组每天静脉给予 200 mg/kg(约 15 g / 日)维生素 C。主要预后 SOFA 评分和两种生物标志物 CRP 和血栓调节蛋白未显示统计学显著差异;但是,维生素 C 治疗组的 28 天全因死亡率降低 (29.8% vs. 46.3%,P = 0.03)。
# 包括静脉注射维生素 C 的联合治疗,6 g / 天
近期对维生素 C 治疗脓毒症的浓厚兴趣还涉及维生素 C(1.5 g,每 6h 一次)和硫胺素(200 mg,每 12h 一次)与氢化可的松(50 mg,每 6h 一次)的联合应用 [10]。第一项随机临床试验(维生素,N = 216)在脓毒性休克患者中研究了三联治疗与氢化可的松单药相比对休克缓解时间的影响 [11&&]。三联疗法组的亚群提供血浆样本检查 1.5 g 静脉注射维生素 C 的药代动力学,证明 1.5 g 静脉注射维生素 C 实现血浆维生素 C 浓度快速升高 [258 mmol/L (162-301)],高达给药前浓度的 10 倍 [28 mmol/L (11-44)][12]。此外,在首次给药后 6h,浓度仍高于生理范围 [132 mmol/L (103-239)][12]。
尽管维生素 C 的剂量明显充足,但在第 7 天之前的无血管加压素小时数无统计学显著性差异 [中位数,122.1h (IQR,76.3-145.4h) vs. 124.6h (82.1-147h),P = 0.83]。此外,90 天全因死亡率无差异(28.6% 对比 24.5%,P = 0.51)。探索至干预时间与死亡率之间相互作用的事后分析未显示早期干预的此类获益 [13&&]。
研究结果之后是另一项随机试验,在脓毒性休克患者中比较维生素 C(6 g / 天)和硫胺素(400 mg / 天)联合给药与安慰剂(ATESS 试验)[14&&]。试验设计与维生素类相似,因为其取消了氢化可的松在三联疗法中的作用,所以试验有效地检查了维生素 C 和硫胺素的作用 [15,16]。本试验在急诊科进行,使早期干预的实施成为可能。ATESS 试验未发现维生素 C 和硫胺素联合治疗在 72h SOFA 评分变化 [3(-1 至 5)vs. 3 (0-4),P = 0.96]、90 天死亡率 (32.1 vs. 27.6%,P = 0.61) 或无血管加压素天数 [11 天 (5-12) vs. 11 天 (10-12),P = 0.16] 方面优于安慰剂。
VICTAS 试验是比较相同的三联鸡尾酒疗法(维生素)与安慰剂的最大试验 [17&&]。本试验旨在招募 2000 例患者,但由于缺乏资金,当研究者招募了 501 例患者时提前停止。从 501 例患者中获得的数据显示,血管加压药和无呼吸机治疗天数无差异 [25 天(0-29 天)vs. 26 天(0-28 天),P = 0.85],180 天死亡率无获益 (40.5 vs. 37.8%,P = 0.53)。
# 从各种干预措施中发现有前景的维生素 C 剂量
当针对一种疾病研究 3 种或以上干预时,在单次分析中同时进行网络荟萃分析 (NMA) 比较 [18]。NMA 通过合并研究网络中的直接和间接证据计算任何一对干预之间的相对效应估计值。组分网络荟萃分析分别获得联合治疗中各组分的增量效应估计值,并将联合治疗的效应归因于各有效药物。
因此,进行了一项系统综述和 NMA 及组分网络荟萃分析,以评估不同剂量的维生素 C、氢化可的松和硫胺素单药或联合治疗是否改善患者预后 [19&&]。在这项 NMA 中,研究者比较了高剂量维生素 C(>12g / 天)、高剂量维生素 C(<12g / 天,>6g / 天)、维生素 C(<6g / 天)、低剂量糖皮质激素(<400 mg / 天的氢化可的松)、硫胺素(任何剂量)、任何联合用药、安慰剂或 43 项试验的常用药物,包括超过 10000 名参与者。在 10 项报告 90 天至 1 年内死亡的试验中,与安慰剂或常规治疗相比,NMA 未显示高剂量维生素 C、糖皮质激素和硫胺素联合用药、维生素 C 和硫胺素联合用药或低剂量糖皮质激素可降低长期死亡率的证据。
然而,从 NMA 来看,高剂量维生素 C 单药治疗和极高剂量维生素 C 与死亡率降低相关。但仍存在不确定性,因为接受极高剂量维生素 C 的研究人群数量较少 [高剂量维生素 C;死亡率的比值比 (OR):0.34 (95% CI 0.16-0.71;95% PrI,0.15-0.76);极高剂量维生素 C;死亡率的 OR:0.53 (95% CI 0.29-0.99;95% PrI 0.27-1.05)]。
当使用联合治疗和单药治疗的所有数据计算组成网络荟萃分析中每种药物的增量效应时,在最长随访时间没有药物显示可降低死亡率。然而,在这 10 年发表的研究中,添加极高剂量维生素 C 与死亡率降低相关 [死亡率的 OR 增加:0.5 (95% CI 0.27-0.92)]。
如前所述,NMA 和组分 NMA 表明高剂量可能不足以使维生素 C 起效。最近发表的两项双盲随机临床试验支持高剂量维生素 C 在脓毒性休克患者中不能提供临床获益 [20,21]。因此,极高剂量(至少超过 12 g / 天)是未来研究的合理候选剂量,需要进行适当的随机临床试验。在这方面,两项评估极高剂量维生素 C 对死亡率影响的主要试验 (NCT02735707、NCT03680274) 的结果正在等待中。此外,目前正在脓毒症患者中进行两项随机临床试验,研究给予更高剂量,即兆剂量的维生素 C(60 或 120 g)的安全性和可行性 (ACTRN12620000651987p;NCT04796636)。
# 维生素 C 的安全性问题
静脉给予高剂量或极高剂量维生素 C 时可能出现安全性问题。一项范围审查检索到血糖仪错误导致的草酸盐肾病、高钠血症、G6PD 缺乏症溶血性贫血和假性高血糖症的散发报告 [22&]。出现血糖仪错误的原因是维生素 C 是单电子供体,会干扰血糖仪的电子测量结果 [23]。由于重症患者中的数据有限,该审查也报告了关于大剂量静脉注射维生素 C 导致的不良事件的不确定性。
然而,此后发表的一项评估包括高剂量维生素 C 在内的三联治疗效果的随机临床试验由于干预组高钠血症增加而提前停止 (N = 80)(32.5 vs. 7.5%,P = 0.005)[24]。然而,其它近期的主要试验并未报告高剂量维生素 C 治疗相关不良事件的风险显著增加 [9,11&,17&&]。然而,应在密切监测临床试验环境中的实验室检查值的情况下给予更高剂量的静脉注射维生素 C。
# 临床前实验中用于脓毒症的维生素 C
极高剂量维生素 C(200 mg/kg;腹腔或静脉给药)的有效性已在临床前脓毒症模型中得到广泛证实(表 1)。在这些实验模型中报告的维生素 C 的多向获益似乎主要通过缓解脓毒症诱导的促炎反应失调介导 [25-27]。
# 脑
对盲肠结扎穿孔术 (CLP) 诱导的啮齿类动物多微生物脓毒症进行维生素 C 腹腔给药(200 mg/kg;抗坏血酸钠),通过减少全身炎症和神经炎症、血脑屏障破坏、氧化应激并通过增强中枢抗氧化防御途径改善认知功能 [28&]。
# 肺
在接受致死剂量脂多糖 (LPS) 诱导的内毒素血症的小鼠中,腹膜内维生素 C(抗坏血酸或脱氢抗坏血酸)处理通过减弱核因子 κB 的活化、趋化因子表达和微血管血栓形成改善了存活率,并保留了肺结构和内皮屏障功能 [29]。同样,在腹膜炎诱导的急性肺损伤小鼠模型中,亲代腹腔给予维生素 C 减轻了肺促炎反应,减少了凝血异常,并增强了肺上皮屏障功能和肺泡液体清除率 [30]。
表 1. 证实高剂量或兆剂量维生素 C 对多器官有益机制的脓毒症临床前模型
| 种属 | 脓毒症类型 | 维生素 C 剂量 | 维生素 C 的使用时间 | 关注的重要器官 | 关键结果 |
|---|---|---|---|---|---|
| 大鼠 (28) | CLP | 200 mg/kg;静脉推注,抗坏血酸钠 | CLP 后 12h | 脑 | 改善认知功能,↓血清水平和海马组织中炎性细胞因子 (TNF-a、IL-6) 的蛋白表达,↓氧化应激 (MDA) 和↑海马内抗氧化 / 抗炎蛋白表达(nad 和 HO-1)。 |
| 小鼠 (29) | LPS | 200 mg/kg;静脉推注抗坏血酸或脱氢抗坏血酸 | LPS 后 30 min(致死剂量;10 mg/g)肺 | 将生存率提高到 75%;↓中性粒细胞浸润并保留肺结构,↓中性粒细胞性毛细血管炎,↓肺血管渗漏,↓单核细胞趋化蛋白 - 1 和巨噬细胞蛋白 - 2,↓肺脏 NFkB 表达,↓全身性凝血病和↓微血管血栓形成。 | |
| 小鼠 | CLP | 200 mg/kg;静脉推注抗坏血酸钠 CLP 前 | 30 min 或 CLP 后 3h | 血管系统 | 预处理:↓eNOS 解偶联,↓iNOS 活性,↓Superoxide,↓3-NT,↓PP2A 活性和↓血管渗漏,维持比索蛋白磷酸化;处理后:↓血管渗漏。 |
| 小鼠 (30) | FIP | 200 mg/kg;FIP 后 | 30 min 推注抗坏血酸或脱氢抗坏血酸 | 肺 | ↓肺促炎趋化因子,↓多形核中性粒细胞浸润,↓血管渗漏,↑肺上皮离子转运蛋白表达,↑肺泡液清除并防止 Na +-K +-atp 酶泵下调。 |
| 小鼠 (32) | CLP | 200 mg/kg;静脉推注抗坏血酸钠 CLP 前 | 30 min | 血管系统 | ↓iNOS 蛋白在骨骼肌中的表达,↓iNOS 在内皮细胞中的基因表达,↓氧化应激(二氢可待因 123),↑微血管和动脉压对去甲肾上腺素的反应性。 |
| 绵羊 (36) | 大肠埃希菌活体静脉给药 | 抗坏血酸钠 0.5 g/kg 推注 30 min,之后 0.5 g/kg/h 静脉给药 6.5 h | 大肠埃希菌输注 24 h | 肾脏 | 与溶媒处理相比,巨量抗坏血酸,↓体温、↓去甲肾上腺素需求、↓血浆肌酐、↑肌酐清除率、↑尿流量和↑肾髓质组织灌注、↑肾髓质组织氧合、↑动脉血 PO2、↓血浆胆红素、↓血浆 AST,动物临床状态显著改善。 |
3-NT、3 - 硝基酪氨酸、AST、天冬氨酸转氨酶、CLP、盲肠结扎和穿刺、大肠杆菌、大肠杆菌、eNOS、内皮型一氧化氮合酶、FIP、向腹膜内注射的粪干溶液、HO-1、血红素氧化酶 - 1、IL-6、白细胞介素 - 6、iNOS、诱导型一氧化氮合酶、i.p.、腹腔内、i.v.、静脉内、LPS、脂多糖、MDA、丙二醛、NFkB、核因子 κB、cre、核因子红细胞 2 相关因子 2、PO2、氧分压、PP2A、蛋白磷酸酶 2A、TNF-A、肿瘤坏死因子 α。
# 血管系统
预先给予 CLP 小鼠静脉维生素 C(抗坏血酸钠)防止了内皮型一氧化氮合酶 (eNOS) 解偶联,并减少了诱导型一氧化氮合酶 (iNOS)、超氧阴离子、3 - 硝基酪氨酸和蛋白磷酸酶 2A 的生成,从而完全抑制了骨骼肌内的血管渗漏 [31]。在 CLP 诱导的多微生物脓毒症小鼠中,静脉给予维生素 C 通过减轻 iNOS 的表达和活性,保留了对外源输注去甲肾上腺素的微血管和动脉压反应性 [32,33]。
但是,尚未确定其在临床环境中的有效性(参见上文)。脓毒症的特征是由核因子 κB 通路驱动的压倒性全身炎症活化,在小鼠给予 LPS 后,该通路下调了细胞钠依赖性维生素 C 转运蛋白 [34,35]。因此,可能需要超大剂量才能使维生素 C 进入细胞并产生获益。因此,最近在与急性肾损伤 (AKI) 相关的革兰氏阴性高动力脓毒症羊模型中研究了静脉给予巨量维生素 C(150 g,抗坏血酸钠)的临床前安全性和有效性 [36&]。
# 肾脏
羊脓毒血症性 AKI 的特征是早期发生肾髓质组织低灌注和缺氧,之前已在该大型哺乳动物模型中证明,在 12-24h 血浆肌酐升高和少尿之前发生 [37-39]。确诊的革兰氏阴性脓毒症患者在 24 小时内给予大剂量抗坏血酸钠后,肾髓质组织灌注不足和组织缺氧逆转,如尿流量和肌酐清除率显著改善以及血浆肌酐有效正常化所示,与 AKI 完全逆转相关(图 1)。肾组织病理学检查显示,在用或不用兆剂量抗坏血酸钠处理的动物中,无急性肾小管坏死、间质纤维化,也无肾皮质、肾皮髓质连接处或肾髓质内的双折射草酸盐晶体。
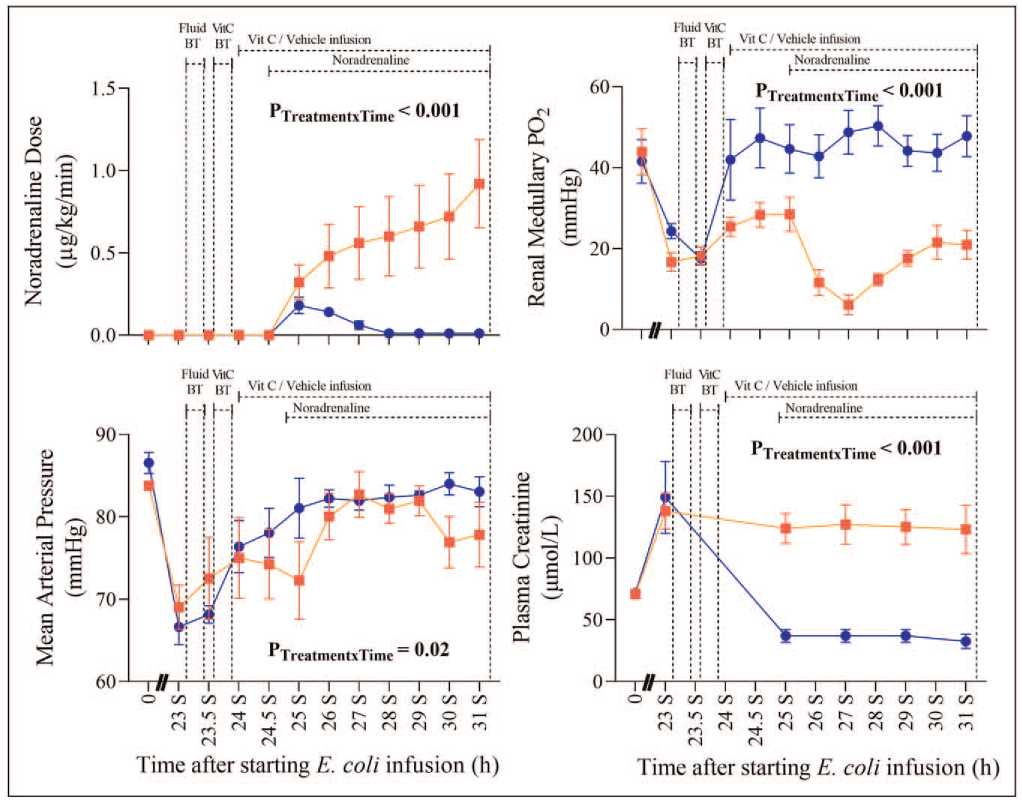
图 1. 在绵羊脓毒症和革兰氏阴性感染恢复期间,维生素 C(灰色方框,n = 5)或溶剂(黑色圆圈,n = 5)处理引起的去甲肾上腺素需求、血压、肾髓质氧合和血浆肌酐变化。脓毒症 0-31h 期间输注活大肠杆菌期间的去甲肾上腺素剂量平均动脉压、肾髓质氧分压 (PO2) 和血浆肌酐。从脓毒症 23.5h 至 24h,所有动物最初均通过液体推注疗法(液体 BT,30 mL/kg 平衡晶体液,30 min 内输注)复苏。然后,动物随机接受抗坏血酸钠 (0.5 g/kg) 或溶媒 - 晶体推注疗法 (VitC BT),脓毒症 24-24.5h,随后在脓毒症 24.5-31h 输注抗坏血酸钠 (0.5 g/kg/h) 或溶媒 - 晶体。脓毒症发生后 25-31h,滴定去甲肾上腺素剂量以维持平均动脉压在基线水平 (75-80 mmHg)。时间 0 为基线第 24h 的平均值,脓毒症 23-31h 的平均值为 0.5h。小时之前的字母 S 表示研究开始的时间 (S)。数据表示为治疗组特异性均值 ± 标准误。P 值代表革兰氏阴性脓毒症 23-31h 双向重复测量方差分析的治疗 - 时间相互作用。
在同一研究中,4/5 只脓毒症绵羊用抗坏血酸钠治疗以达到目标平均动脉压后去甲肾上腺素也完全戒断(图 1),这些动物降低了其动脉血乳酸盐水平,并显示肺和肝功能变量改善(表 1)。此外,败血性绵羊的临床状态发生了显著改善,从不适、嗜睡、发热、对外界刺激无反应、不吃或不喝变为警觉、有反应、吃或喝,并且体温恢复正常。根据临床结果 (vide supra),输注 150 g 抗坏血酸钠导致高钠血症(153.6 士 1.7 mmol/L)。总之,这些临床前研究表明,维生素 C 治疗的最佳剂量、时间和持续时间可能是决定其治疗脓毒症疗效的关键因素,但目前这些因素尚缺乏详细的研究。
# 维生素 C 治疗 2019 年其他重症间质性肺病和冠心病
2019 年 (COVID-19) 还检查了静脉注射维生素 C 对冠状病毒病的影响,预期获益,因为其作为抗氧化和免疫防御增强剂的作用 [40]。在这种全球大流行中,维生素 C 治疗具有吸引力,因为它容易获得,而且不昂贵。已经计划了 30 多项随机临床试验来研究维生素 C 通过肠内或肠外途径给药的影响。其中一项试验采用静脉注射高剂量维生素 C(200 mg/kg/ 天),旨在招募 800 例 COVID-19 (NCT04401150) 住院患者。主要预后为 28 天时死亡或持续性器官功能障碍。如果试验成功完成,试验结果将提供静脉注射高剂量维生素 C 是否对 COVID-19 有益的关键信息。
# 结论
过去几年中,脓毒症领域的维生素 C 研究出现了显著激增,在大量临床前获益证据的基础上,重点关注大剂量静脉给药。但是,无随机临床研究显示明确的以患者为中心的效应。然而,数千例接受维生素 C 静脉给药治疗的患者的 NMA 提示其获益于极高剂量。此外,最近使用兆剂量维生素 C 的大型动物临床前数据报告了重大获益。因此,维生素 C 在脓毒症中的研究领域现正转向研究大剂量维生素 C 治疗。未来几年将可能提供关于这种超大剂量对感染性休克影响的重要新证据。
# REFERENCES
DETAILS
Friedman S, Kaufman S. 3,4-dihydroxyphenylethylamine [beta]-hydroxylase. J Biol Chem 1965; 240:4763-4773.
Koekkoek WA, van Zanten AR. Antioxidant vitamins and trace elements in critical illness. Nutr Clin Pract 2016; 31:457-474.
Fujii T, Fowler R, Vincent JL. Vitamin C and thiamine for sepsis: time to go back to fundamental principles. Intensive Care Med 2020; 46:2061-2063.
Moskowitz A, Andersen LW, Huang DT, et al. Ascorbic acid, corticosteroids, and thiamine in sepsis: a review of the biologic rationale and the present state of clinical evaluation. Crit Care 2018; 22:283.
Carr AC, Rosengrave PC, Bayer S, et al. Hypovitaminosis C and vitamin C deficiency in critically ill patients despite recommended enteral and parenteral intakes. Crit Care 2017; 21:300.
Long CL, Maull KI, Krishnan RS, et al. Ascorbic acid dynamics in the seriously ill and injured. J Surg Res 2003; 109:144-148.
Padayatty SJ, Sun H, Wang Y, et al. Vitamin C pharmacokinetics: implications for oral and intravenous use. Ann Intern Med 2004; 140:533-537.
Fowler AA 3rd, Syed AA, Knowlson S, et al. Phase I safety trial of intravenous ascorbic acid in patients with severe sepsis. J Transl Med 2014; 12:32.
Fowler AA 3rd, Truwit JD, Hite RD, et al. Effect of vitamin C infusion on organ failure and biomarkers of inflammation and vascular injury in patients with sepsis and severe acute respiratory failure: the CITRIS-ALI Randomized Clinical Trial. JAMA 2019; 322:1261-1270.
Rubin R. Wide interest in a vitamin C drug cocktail for sepsis despite lagging evidence. JAMA 2019; 322:291-293.
11[■][■]. Fujii T, Luethi N, Young PJ, et al. Effect of vitamin C, hydrocortisone, and thiamine vs hydrocortisone alone on time alive and free of vasopressor support among patients with septic shock: the VITAMINS Randomized Clinical Trial. JAMA 2020; 323:423-431.
International multicenter randomized controlled trial combining high-dose intravenous vitamin C with thiamine and hydrocortisone vs. hydrocortisone alone.
- Hudson EP, Collie JT, Fujii T, et al. Pharmacokinetic data support 6-hourly dosing of intravenous vitamin C to critically ill patients with septic shock. Crit Care Resusc 2019; 21:236-242.
13[■][■]. Fujii T, Udy AA, Bellomo R. Vitamin C, hydrocortisone, and thiamine for septic shock-in reply. JAMA 2020; 323:2204-2205.
Key data on timing of intervention from the international multicenter randomized controlled trial combining high-dose intravenous vitamin C with thiamine and hydrocortisone vs. hydrocortisone alone.
14[■][■]. Hwang SY, Ryoo SM, Park JE, et al. Combination therapy of vitamin C and thiamine for septic shock: a multicentre, double-blinded randomized, controlled study. Intensive Care Med 2020; 46:2015-2025.
Important double-blind randomized controlled trial of high-dose vitamin C therapy in septic shock.
Fujii T, Udy AA, Deane AM, et al. Vitamin C, hydrocortisone and thiamine in patients with septic shock (VITAMINS) trial: study protocol and statistical analysis plan. Crit Care Resusc 2019; 21:119-125.
Hwang SY, Park JE, Jo IJ, et al. Combination therapy of vitamin C and thiamine for septic shock in a multicentre, double-blind, randomized, controlled study (ATESS): study protocol for a randomized controlled trial. Trials 2019; 20:420.
17[■][■]. Sevransky JE, Rothman RE, Hager DN, et al. Effect of vitamin c, thiamine, and hydrocortisone on ventilator- and vasopressor-free days in patients with sepsis: the VICTAS Randomized Clinical Trial. JAMA 2021; 325:742-750.
A multicenter, double-blind, randomized clinical trial assessing the effect of the triple combination therapy (including vitamin C 6 g/day) vs. placebo.
- Salanti G, Del Giovane C, Chaimani A, et al. Evaluating the quality of evidence from a network meta-analysis. PLoS One 2014; 9:e99682.
19[■][■]. Fujii T, Salanti G, Belletti A, et al. Effect of adjunctive vitamin C, glucocorticoids, and vitamin B1 on longer-term mortality in adults with sepsis or septic shock: a systematic review and a component network meta-analysis. Intensive Care Med 2022; 48:16-24.
A systematic review with network meta-analysis and component network meta-analysis last updated in September 2021, including all major trials.
Rosengrave P, Spencer E, Williman J, et al. Intravenous vitamin C administration to patients with septic shock: a pilot randomised controlled trial. Crit Care 2022; 26:26.
Wacker DA, Burton SL, Berger JP, et al. Evaluating vitamin C in septic shock: a randomized controlled trial of vitamin C monotherapy. Crit Care Med 2022; 50:e458-e467.
22[■]. Yanase F, Fujii T, Naorungroj T, et al. Harm of IV high-dose vitamin C therapy in adult patients: a scoping review. Crit Care Med 2020; 48:e620-e628.
Scoping review of the side effects of high -dose intravenous vitamin C.
Kahn SA, Lentz CW. Fictitious hyperglycemia: point-of-care glucose measurement is inaccurate during high-dose vitamin C infusion for burn shock resuscitation. J Burn Care Res 2015; 36:e67-e71.
Chang P, Liao Y, Guan J, et al. Combined treatment with hydrocortisone, vitamin C, and thiamine for sepsis and septic shock: a randomized controlled trial. Chest 2020; 158:174-182.
May CN, Bellomo R, Lankadeva YR. Therapeutic potential of megadose vitamin C to reverse organ dysfunction in sepsis and COVID-19. Br J Pharmacol 2021; 178:3864-3868.
Ow CPC, Trask-Marino A, Betrie AH, et al. Targeting oxidative stress in septic acute kidney injury: from theory to practice. J Clin Med 2021; 10:3798.
Wilson JX. Evaluation of vitamin C for adjuvant sepsis therapy. Antioxid Redox Signal 2013; 19:2129-2140.
28[■]. Zhang N, Zhao W, Hu ZJ, et al. Protective effects and mechanisms of high-dose vitamin C on sepsis-associated cognitive impairment in rats. Sci Rep 2021; 11:14511.
Important preclinical study of the effect of high-dose intravenous vitamin C on cognitive function in rats.
Fisher BJ, Seropian IM, Kraskauskas D, et al. Ascorbic acid attenuates lipopolysaccharide-induced acute lung injury. Crit Care Med 2011; 39:1454-1460.
Fisher BJ, Kraskauskas D, Martin EJ, et al. Mechanisms of attenuation of abdominal sepsis induced acute lung injury by ascorbic acid. Am J Physiol Lung Cell Mol Physiol 2012; 303:L20-L32.
Zhou G, Kamenos G, Pendem S, et al. Ascorbate protects against vascular leakage in cecal ligation and puncture-induced septic peritonitis. Am J Physiol Regul Integr Comp Physiol 2012; 302:R409-R416.
Wu F, Wilson JX, Tyml K. Ascorbate inhibits iNOS expression and preserves vasoconstrictor responsiveness in skeletal muscle of septic mice. Am J Physiol Regul Integr Comp Physiol 2003; 285:R50-R56.
Wu F, Wilson JX, Tyml K. Ascorbate protects against impaired arteriolar constriction in sepsis by inhibiting inducible nitric oxide synthase expression. Free Radic Biol Med 2004; 37:1282-1289.
Subramanian VS, Sabui S, Moradi H, et al. Inhibition of intestinal ascorbic acid uptake by lipopolysaccharide is mediated via transcriptional mechanisms. Biochim Biophys Acta Biomembr 2018; 1860:556-565.
Subramanian VS, Sabui S, Subramenium GA, et al. Tumor necrosis factor alpha reduces intestinal vitamin C uptake: a role for NF-[kappa]B-mediated signaling. Am J Physiol Gastrointest Liver Physiol 2018; 315:G241-G248.
36[■][■]. Lankadeva YR, Peiris RM, Okazaki N, et al. Reversal of the pathophysiological responses to gram-negative sepsis by megadose vitamin C. Crit Care Med 2021; 49:e179-e190.
Preclinical study of the physiological effects of mega-dose intravenous vitamin C in a large animal model of septic shock.
Calzavacca P, Evans RG, Bailey M, et al. Cortical and medullary tissue perfusion and oxygenation in experimental septic acute kidney injury. Crit Care Med 2015; 43:e431-e439.
Lankadeva YR, Kosaka J, Evans RG, et al. Intrarenal and urinary oxygenation during norepinephrine resuscitation in ovine septic acute kidney injury. Kidney Int 2016; 90:100-108.
Lankadeva YR, Kosaka J, Evans RG, et al. Urinary oxygenation as a surrogate measure of medullary oxygenation during angiotensin II therapy in septic acute kidney injury. Crit Care Med 2018; 46:e41-e48.
Carr AC, Maggini S. Vitamin C and immune function. Nutrients 2017; 9.
# 危重病的间歇喂养和昼夜节律
综述目的
昼夜节律,即内部生物过程的周期性振荡,调节代谢过程,如激素信号传导、营养吸收和异生物质解毒。进餐时间是各器官外周时钟的强吸引信号,昼夜节律以外的阶段进食会损害葡萄糖、胃肠道和肌肉代谢。危重疾病期间,睡眠 / 觉醒周期和昼夜节律极度紊乱。营养支持的时机可能有助于保持昼夜节律和改善重症监护室 (ICU) 后恢复。这篇综述总结了 ICU 住院期间的昼夜节律紊乱,并评价了间歇喂养对代谢和昼夜节律的潜在益处。
近期结果
危重病期间,核心时钟基因的节律性表达迅速紊乱,并持续数周。已将间歇、推注和循环肠内喂养与常规连续喂养直接比较,但未观察到对血糖控制、胃肠道耐受性和肌肉量的益处,昼夜节律钟的影响仍未检测。
总结
调整营养摄入、体力活动和 / 或药物治疗时间与昼夜节律是重置外周昼夜节律的潜在策略,可促进 ICU 恢复,但尚未证实有益。因此,选择间歇喂养而非持续喂养,必须与临床实践的利弊相平衡。
关键词
昼夜节律、肠内营养、代谢预后、时机
# 要点
・危重病期间昼夜节律迅速紊乱,入住 ICU 后数周内持续紊乱。
・昼夜节律期以外饮食会损害葡萄糖、胃肠道和肌肉代谢。
・间歇喂养可重置健康状态下失调的昼夜节律,可能是支持危重患者昼夜节律健康的潜在策略。
# 引言
尽管全球范围内重症患者的生存率不断升高,但入住重症监护室 (ICU) 后的长期预后通常较差,高达 80% 的患者出现了长期并发症,包括睡眠、身体功能以及认知和心理健康受损 [1]。昼夜节律,即 24h 周期,是生理、心理和行为过程的核心。昼夜节律紊乱与并发症相关,如免疫系统破坏、谵妄、长期心血管后果、神经退行性疾病、2 型糖尿病和死亡率增加 [2&,3&]。随着 ICU 环境与日常生活的显著不同以及持续的临床和环境变化,这些干扰物可能导致昼夜节律受损。支持重症患者的昼夜节律健康可能有助于改善代谢,减少 ICU 后恢复期的心理健康损害和谵妄。
因此,了解危重症如何影响昼夜节律,以便制定干预策略和时间疗法,尽量减少对 ICU 中患者昼夜节律的破坏,至关重要。
营养支持是重症患者标准临床护理的重要组成部分,从而改善临床预后。虽然现行营养指南 [4,5] 详细说明了提供的能量、大量营养素和微量营养素的数量和质量建议,但是有关喂养时间和模式的策略在很大程度上尚未得到充分研究。当食物被消耗时,会影响各种生理功能,包括睡眠 / 觉醒周期、核心体温、(骨骼肌)胰岛素敏感性、全身代谢健康和精神警觉。这被称为 “时间营养学”,即进食与身体产生的昼夜节律同步,这导致了时间限制性饮食的巨大科学和公众兴趣;一种饮食策略,改变进餐时间,并在饮食中加入更长时间的每日空腹,而不限制总能量摄入。已证明限制进食时间可减少 2 型糖尿病和心血管疾病的风险因素 [2&,6&]。
在 ICU 中,连续和间歇喂养(间歇、推注或循环)是最常见的肠内营养给药策略。连续喂养是标准实践,因为营养物质缓慢释放到胃中被认为可增强喂养耐受性、降低反流风险和下呼吸道并发症,并且方便。相反,间歇喂养更符合生理,因为它模拟日常生活中的进食模式,从而维持规律的胃肠激素分泌和消化,并使患者有更大的移动性。在动物和健康人体中的研究 [7-11] 表明,与持续喂养相比,间歇喂养可改善胰岛素敏感性,增加肌肉蛋白质合成,激活禁食诱导的细胞增殖和酮体生成,并保存昼夜节律。但是,在重症患者中,仅有少数研究直接比较了间歇性喂养与连续喂养对临床预后的影响,这些研究已在早期综述中进行了讨论 [12-17]。本综述旨在提供最近 18 个月发表的关于营养支持时机对重症患者代谢预后影响的研究概述,特别关注 ICU 期间和入院后昼夜节律。
# 循环节律调节
外周组织如胃肠道功能、肌肉和其他重要器官的多个生理过程均处于昼夜节律调节下。主要调节者在下丘脑视交叉上核,主要由明 / 暗周期控制。在分子水平上,昼夜节律钟是基于蛋白质的转录 / 转功能反馈回路,如隐花色素 (CRY)、周期 (PER)、脑和肌肉 Arnt-like 蛋白 (BMAL) 以及昼夜节律运动输出周期 Kaput (clock),这些蛋白需要 24h 才能完成。然而,营养信号分子直接调节时钟基因;胰岛素 - mTOR 通路的激活增加了 PER 蛋白的稳定性和翻译 [18,19,20&&],而空腹激活 AMP 活化蛋白激酶 (AMPK) 和烟酰胺磷酸核糖转移酶 (NAMPT) 通路降低了 CRY 和 PER 的稳定性和转录 [21-23]。因此,进餐时间错误导致的胰岛素和 cAMP 变化将影响负责代谢过程(包括胃肠道功能、血糖控制和肌肉代谢)的外周组织中的数百个下游 “时钟控制” 基因。
环境提示(如明 / 暗期、温度变化和体力活动)可使生物钟与外部环境同步,食物消耗是外周时钟最有效的夹带者。在肠道中,营养摄取、胃动力、胃酸和胃肠激素产生、营养吸收和肠道微生物群处于昼夜节律调节下 [24&&,25&&]。葡萄糖代谢也受昼夜节律控制 [26];肝时钟调节葡萄糖生成,而胰腺时钟根据白天的时间调节胰岛素分泌,夜间的分泌能力小得多。相反,与白天相比,肌肉时钟通过减少夜间葡萄糖转运蛋白转位来调节葡萄糖摄取 [27&]。此外,昼夜节律紊乱可通过损害 β 细胞功能和外周胰岛素敏感性急性影响血糖控制 [26]。
# 重症监护病房环境和循环泵
重症患者在 ICU 住院期间,体温、血压、心率和睡眠模式等中心相标志物的昼夜节律受到高度干扰 [28-30],并在出院后数周内持续中断 [29,31&,32]。危重疾病的病理生理反应可能主要驱动昼夜节律的这种破坏,而非生理临床因素,如机械通气、药物和镇静,可能会进一步导致这种破坏。此外,危重疾病伴随疼痛、疲劳、压力和认知功能障碍如谵妄,这可能进一步加剧昼夜节律紊乱 [3&]。ICU 患者暴露于频繁的患者护理相互作用、噪音、持续光照,并经常持续接受肠内喂养,这是可能缓解昼夜节律紊乱的潜在可改变因素。因此,需要进一步了解 ICU 患者中昼夜节律紊乱和昼夜节律健康的程度。
一些研究评估了危重患者中时钟基因的节律性表达 [28,33-35],最近 18 个月发表的研究总结见表 1。在入住 ICU 早期量化危重患者中时钟基因昼夜节律的研究显示,与健康对照相比,关键时钟基因无节律性表达 [28,33]。然而,这些研究因患者人群而异,仅限于神经病学患者和伴有或不伴有脓毒症的患者(未指明患者类型)。入院后,由于快速发生昼夜节律紊乱,在评估昼夜节律健康时,入组时间至关重要 [34]。此外,基线昼夜节律健康(即,在家中或病房)可能是可变的,并且是一个重要的混杂因素。对于昼夜节律紊乱(即节律性)的评估,血液样本的频率对于建模分析至关重要,在已发表的研究中 24h 内每 2 至 6h 变化一次,建议为每 2h 一次,至少每 4h 一次 [36],以免分析效能不足。
危重病中昼夜节律紊乱与临床和环境因素之间的关系在很大程度上尚未被探讨。Maas 等人发表了另外两篇论文(使用 n = 112 例重症患者的原始较大数据集 [33]),将时钟基因的变化与褪黑素水平、明 / 暗期、营养摄入和体力活动水平相关联 [37&&,38&&]。未发现时钟基因振幅与疾病严重程度(SOFA 评分)、脑病(Glasgow 昏迷评分)、静息 - 活动节律性(日常活动和休息模式)和褪黑素水平之间存在相关性。低日间光强水平、频繁护理和夜间噪音非常普遍。营养摄入(仅 n = 43/112 患者有营养摄入)不足,39% 接受了一些餐时喂养(肠内或口服);但是,未报告详细的营养摄入数据。重症患者的体力活动水平显著低于卧床和非卧床健康对照者。进食方案和 / 或体力活动水平与时钟基因表达之间无相关性,因此光、噪音、营养和 / 或体力活动等干扰物如何影响 ICU 患者的昼夜节律仍不确定。
# 重症患者的间歇性进食和代谢预后
重症患者的最佳喂养模式已成为重症护理营养中持续存在的争议。如前所述,在危重症患者中开展的多数连续性与间歇性喂养 [12-17] 研究旨在改善营养摄入目标。迄今为止,已进行的少数研究纳入了相对较小的患者队列,未显示明确的临床获益;比较改变膳食时间对重症患者代谢影响的良好对照 RCT 仍然很少。下文讨论了了解间歇性喂养对重症患者葡萄糖、胃肠道和肌肉代谢可能影响的支持性证据。
# 血糖控制和胃肠功能
在重症患者中,已证实间歇性喂养可增加血糖变异性 [39] 或不影响每日血糖水平 [40,41],而在间歇性喂养后观察到胰岛素需求降低 [39,42,43]。胃肠道不耐受(例如,胃排空延迟)在重症患者中很常见,导致营养吸收受损和误吸风险增加;间歇性喂养可能增加肠蠕动和餐后胃肠激素的释放。迄今为止的研究仅评估了胃肠道功能障碍的替代指标,尚无定论,报告间歇性喂养后无 [39] 或更高 [44,45,46&] 的胃容量差异。由于糖调节和食欲激素在血糖控制和胃排空中发挥重要作用,需要在重症患者中进一步研究评估进餐时间对血糖控制和胃肠功能的影响。
表 1. 在过去 18 个月内评估 ICU 患者昼夜节律紊乱的研究
| 研究 | 设计 | 患者人群 | 方法学 | 主要结果 |
|---|---|---|---|---|
| Maas 等人 [33] | 横断面观察性研究急诊科就诊后 24h 内入组健康志愿者在临床研究机构接受相似情况的研究 | n=15 名 ICU 患者(10 名脓毒症患者和 5 名脑出血患者)vs n=11 名健康志愿者 | ** 主要预后:**Cry1-2、Per1-3、RORa、NR1D1、Bmal1、CLOCK 和 TIMELESS 的 mRNA 表达。次要预后:褪黑素浓度(幅度)样本分析:24h 内每 2h 采集血样,节律分析:每个基因的个体 consinor 拟合以及群体平均 cosinor 拟合和 TimeSignature(一种经验证的基于 41 个基因的算法来评估节律转录组的整体相干性) | 在 ICU 患者的任何相干点基因中均未观察到节律性表达,而在健康对照中观察到昼夜节律性(Bmal1、TIMELESS、Cry1、NR1D1 和 Per1 中显著 cosinor 节律拟合)。 |
| Diaz 等人 [34] | 入住 ICU 后第一天和 1 周后的前瞻性观察研究。 | n=11 例神经 ICU 患者(n=7 例蛛网膜下腔或颅内出血和 n=4 例创伤性脑损伤) | ** 主要预后:**CLOCK、Bmal1、Cry1 和 Per2 的 mRNA 表达。样本分析:24h 内(入院后 6、12、18、24h)每 6h 血样 1 次节律分析:傅里叶级数与曲线拟合 | 所有时钟基因在入 ICU 第 1 天即观察到节律性,一周后节律性完全消失。 |
| Acuña-Ferná ndez 等人 [28] | 前瞻性观察性研究(时间范围未知) | n=24 名非脓毒症 ICU 患者,n=20 名脓毒症 ICU 患者,n=12 名健康对照 | ** 主要预后:**CLOCK、Bmal1、Cry1 和 per2 的 mRNA 表达次要预后:6-SM(6 - 磺酰氧基褪黑素)和降钙素原水平的尿排泄。样本分析:24h 内(08:00、13:00、18:00 和 23:00)采集 4 份血样。节律分析:基因表达的相对变化。 | 在 Bmal1 和 CLOCK 表达中未检测到差异,而与健康对照相比,Per2 和 Cry1 在 ICU 患者中显示出更高的峰值。脓毒症患者的 Bmal1 和 CLOCK 表达减弱。 |
# 肌肉代谢
由于增加了血浆氨基酸可用性,间歇喂养较连续喂养可在更大程度上刺激肌肉蛋白质合成,因此,可作为减轻患者肌肉消耗的有效策略。McNelly 等 [39] 针对肌肉进行的最大型研究(n = 127 例患者)观察到,与标准连续喂养相比,间歇喂养 10 天后,肌肉横断面积的变化(平均变化:—1.1%)无差异。本研究的次要分析 [47&] 显示,与持续进食患者相比,间歇进食患者的尿素 - 肌酐比值轨迹减弱(作为肌肉消耗的标志物),表明间歇进食可能阻止分解代谢。但是,这项多中心 RCT 中,仅有 n = 63/127 例患者的主要预后可用(第 10 天),几个混杂因素,包括间歇性喂养组中较高的蛋白质和能量摄入以及用于评估肌肉质量的方法,可能解释了缺乏观察到的获益。在一个包含 59 名 ICU 患者的较小患者队列中 [40](仅提供摘要),在 7 天间歇喂养与连续喂养期间,未观察到股直肌厚度和横截面积的变化差异;但是,由于本研究提供的信息有限,难以进行评价。迄今为止,尚无研究评估间歇喂养与持续喂养对重症患者肌肉蛋白合成率的影响,这需要进一步研究以了解改变进餐时间对肌肉代谢的影响。
# 进餐时机和循环节律:对重症监护病房有预期的影响吗?
环境参与者,如睡眠 / 觉醒期、食物摄入和体力活动可以重置或调整外周组织中的生物钟 [2&]。在动物的非活动期进食完全逆转了核心时钟基因在肌肉、脂肪组织和肝脏中的表达 [48]。迄今为止,尚未在人体中进行充分研究。最近只有两项研究通过重复的健康组织采样研究了限制进餐时间对昼夜节律钟的影响。Lundell 等 [49&&] 表明,限时进食不会改变肌肉中的时钟基因,但可观察到包括氨基酸在内的代谢产物昼夜节律调节的变化。Zhao et al.[27&] 在 24h 内重复进行 4 次脂肪组织活检,观察到时间限制进食使脂肪组织中基线时心律失常的 12 个时钟基因中的 3 个恢复到 450 个基因的节律(个人交流,手稿接受,预印)。另外两项研究报告了时间限制性进食诱导不同时间点的时钟基因变化:8 am 和 2 pM 之间的时间限制性进食使 8 pM 时的 PER1 降低,并使 8 am 和 8 pM 时的 CRY1/2 和 RORa 升高 [50]。在 2 型糖尿病患者中,12h 三餐和 15h 六餐的白细胞中也报告了 BMAL1、CRY1、PER2 和 RORa 的振幅增加 [51]。
尚未进行评估危重病患者营养摄入时间对昼夜节律影响的研究。然而,对于健康成人以及超重或肥胖成人,每日进餐时间会影响餐后血糖反应,将膳食摄入量调整为每日较早时间可改善一天内的糖耐量 [52,53]。与持续喂养相比,间歇喂养可减少葡萄糖不耐受和胰岛素抵抗,这与重症患者的治疗相关,因为高达 75% 的患者出现应激诱导的高血糖 [54]。目前 ICU 中葡萄糖浓度升高的临床管理是外源性胰岛素给药联合持续肠内营养。然而,强化外源性胰岛素治疗与不良后果相关,包括低血糖事件、胰岛素给药增加和死亡率增加 [55]。此外,有限的证据支持连续肠内营养管理葡萄糖水平。胰岛素(和 IGF-1)最近被公认为是一种昼夜节律的调节者,因此可以作为全身细胞时钟进食时间的主要信号 [19]。因此,除优化血糖控制外,间歇喂养可能是维持或重新调整昼夜节律的有效策略。此外,研究表明禁食过夜对代谢是有效的,因为在健康个体中的研究已经表明禁食期激活了酮体生成和细胞增殖 [50]。最近的一项初步研究 [56&&] 在 70 名长期危重患者中测试了禁食期(12h 喂养与 12h 禁食交替)的可行性,显示 12h 营养中断可通过增加血清胆红素和血浆 β- 羟丁酸以及降低胰岛素需求和血清 IGF-I 启动代谢性禁食反应。尽管需要进一步研究间歇性或周期性喂养对危重患者代谢和临床预后的影响,但包括过夜禁食期在内的间歇性喂养方案可能与保留或甚至复位昼夜节律失调相关。ICU 患者中昼夜节律的其他潜在可改变的临床和环境干扰因素,包括光线、温度、体力活动、噪音、睡眠药物以及护理和医疗干预,汇总于图 1 [57&,58]。
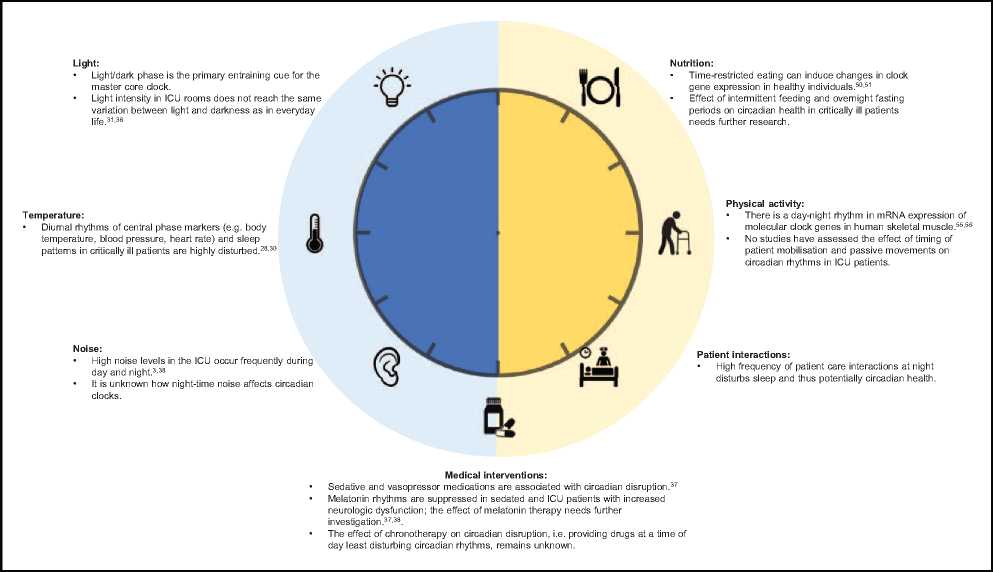
图 1. ICU 中影响昼夜节律的临床和环境因素。
# 结论
过去 18 个月的研究进一步表明,间歇喂养可增加营养摄入。与连续喂养相比,提示对改善血糖控制、胃不耐受和肌肉量维持的影响极小,且是基于低质量证据。胃肠道、葡萄糖和肌肉代谢中昼夜节律失调的分支突出了不同组织受影响的程度,健康研究显示,时间限制性进食可诱导外周时钟基因的变化。时间疗法,即对准进餐时间、体力活动和 / 或药物,是保存或重置外周昼夜节律的潜在策略;但是,尚不清楚这些策略如何影响 ICU 患者的昼夜节律。保护昼夜节律健康的干预策略可能包括在 ICU 住院期间和入院后使用眼罩和耳塞、间歇性或周期性日间喂养、日常活动、光照和 / 或褪黑素治疗。但是,尚不清楚对代谢和临床预后的影响。
# REFERENCES
DETAILS
- Rousseau AF, Prescott HC, Brett SJ, et al. Long-term outcomes after critical illness: recent insights. Crit Care 2021; 25:108.
2[■]. Regmi P, Heilbronn LK. Time-restricted eating: benefits, mechanisms, and challenges in translation. iScience 2020; 23:101161.
This review provides an overview on the effect of meal timing on circadian rhythmns and summarises the mechanisms of action on the proposed metabolic health benefits of time-restricted eating in preclinical models and humans.
3[■]. Daou M, Telias I, Younes M, et al. Abnormal sleep, circadian rhythm disruption, and delirium in the ICU: are they related? Front Neurol 2020; 11:549908.
Review on the physiological consequences of poor sleep quality circadian dysrhythmia, delirium and critical illness.
Kreymann KG, Berger MM, Deutz NE, et al. ESPEN guidelines on enteral nutrition: intensive care. Clin Nutr 2006; 25:210-223.
McClave SA, Taylor BE, Martindale RG, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). J Parenter Enteral Nutr 2016; 40:159-211.
6[■]. Parr EB, Heilbronn LK, Hawley JA. A time to eat and a time to exercise. Exerc Sport Sci Rev 2020; 48:4-10.
Perspective paper summarising the effects of time-restricted eating and exercise training on metabolic health.
Bohe J, Low JF, Wolfe RR, et al. Latency and duration of stimulation of human muscle protein synthesis during continuous infusion of amino acids. J Physiol 2001; 532 (Pt 2):575-579.
Gazzaneo MC, Suryawan A, Orellana RA, et al. Intermittent bolus feeding has a greater stimulatory effect on protein synthesis in skeletal muscle than continuous feeding in neonatal pigs. J Nutr 2011; 141:2152-2158.
Evans DC, Forbes R, Jones C, et al. Continuous versus bolus tube feeds: Does the modality affect glycemic variability, tube feeding volume, caloric intake, or insulin utilization? Int J Crit Illn Inj Sci 2016; 6:9-15.
Chowdhury AH, Murray K, Hoad CL, et al. Effects of bolus and continuous nasogastric feeding on gastric emptying, small bowel water content, superior mesenteric artery blood flow, and plasma hormone concentrations in healthy adults: a randomized crossover study. Ann Surg 2016; 263:450-457.
Dirks ML, Smeets JSJ, Holwerda AM, et al. Dietary feeding pattern does not modulate the loss of muscle mass or the decline in metabolic health during short-term bed rest. Am J Physiol Endocrinol Metab 2019; 316:E536-E545.
Pletschette Z, Preiser JC. Continuous versus intermittent feeding of the critically ill: have we made progress? Curr Opin Crit Care 2020; 26:341-345.
Puthucheary Z, Gunst J. Are periods of feeding and fasting protective during critical illness? Curr Opin Clin Nutr Metab Care 2021; 24:183-188.
Di Girolamo FG, Situlin R, Fiotti N, et al. Intermittent vs. continuous enteral feeding to prevent catabolism in acutely ill adult and pediatric patients. Curr Opin Clin Nutr Metab Care 2017; 20:390-395.
Bear DE, Hart N, Puthucheary Z. Continuous or intermittent feeding: pros and cons. Curr Opin Crit Care 2018; 24:256-261.
Van Dyck L, Casaer MP. Intermittent or continuous feeding: any difference during the first week? Curr Opin Crit Care 2019; 25:356-362.
Patel JJ, Rosenthal MD, Heyland DK. Intermittent versus continuous feeding in critically ill adults. Curr Opin Clin Nutr Metab Care 2018; 21:116-120.
Zheng X, Sehgal A. AKT and TOR signaling set the pace of the circadian pacemaker. Curr Biol 2010; 20:1203-1208.
Crosby P, Hamnett R, Putker M, et al. Insulin/IGF-1 drives PERIOD synthesis to entrain circadian rhythms with feeding time. Cell 2019; 177:896-909 e20.
20[■][■]. Tuvia N, Pivovarova-Ramich O, Murahovschi V, et al. Insulin directly regulates the circadian clock in adipose tissue. Diabetes 2021; 70:1985-1999.
One of the first human studies to show insulin as the primary mechanism of feeding-induced entrainment of peripheral circadian clocks in adipose tissue (through transcriptional changes in PER leading to the phase shift of circadian oscillations).
Lamia KA, Sachdeva UM, DiTacchio L, et al. AMPK regulates the circadian clock by cryptochrome phosphorylation and degradation. Science 2009; 326:437-440.
Ramsey KM, Yoshino J, Brace CS, et al. Circadian clock feedback cycle through NAMPT-mediated NAD+ biosynthesis. Science 2009; 324:651-654.
Nakahata Y, Sahar S, Astarita G, et al. Circadian control of the NAD+ salvage pathway by CLOCK-SIRT1. Science 2009; 324:654-657.
24[■][■]. Zeb F, Wu X, Chen L, et al. Effect of time-restricted feeding on metabolic risk and circadian rhythm associated with gut microbiome in healthy males. Br J Nutr 2020; 123:1216-1226.
This study is one of the first to demonstrate that time-restricted eating increases gut microbiome diversity and alters Sirt1 and clock genes Bmal1 and Clock mRNA expression in humans.
25[■][■]. Mindikoglu AL, Abdulsada MM, Jain A, et al. Intermittent fasting from dawn to sunset for 30 consecutive days is associated with anticancer proteomic signature and upregulates key regulatory proteins of glucose and lipid metabolism, circadian clock, DNA repair, cytoskeleton remodeling, immune system and cognitive function in healthy subjects. J Proteomics 2020; 217:103645.
This is the first human serum proteomics study assessing the effect of 30-day intermittent fasting with simultaneous assessment of clinical metabolic parameters, serum biomarkers, and faecal microbiota.
- Mason IC, Qian J, Adler GK, et al. Impact of circadian disruption on glucose metabolism: implications for type 2 diabetes. Diabetologia 2020; 63:462-472.
27[■]. Zhao L, Hutchison AT, Wittert GA, et al. Intermittent fasting does not uniformly impact genes involved in circadian regulation in women with obesity. Obesity 2020; 28 Suppl 1:S63-S67.
This is one of the few human studies to examine the impact of intermittent fasting on peripheral clocks by analysing clock gene expression in human muscle and adipose fat tissue biopsies following an 8-week intermittent fasting intervention in 37 women with obesity.
Acuna-Fernandez C, Marin JS, Diaz-Casado ME, et al. Daily changes in the expression of clock genes in sepsis and their relation with sepsis outcome and urinary excretion of 6-sulfatoximelatonin. Shock 2020; 53:550-559.
Diaz E, Diaz I, Del Busto C, et al. Clock genes disruption in the intensive care unit. J Intensive Care Med 2019; 885066619876572.
Davidson S, Villarroel M, Harford M, et al. Day-to-day progression of vital-sign circadian rhythms in the intensive care unit. Crit Care 2021; 25:156.
31[■][■]. Okutan B, Kjer CKW, Poulsen LM, et al. Sleep-wake rhythms determined by actigraphy during in-hospital stay following discharge from an intensive care unit. Acta Anaesthesiol Scand 2021; 65:801-808.
Prospective cohort study that quantified sleep-wake patterns using accelerometry in ICU patients in the first week after ICU discharge.
Yang PL, Ward TM, Burr RL, et al. Sleep and circadian rhythms in survivors of acute respiratory failure. Front Neurol 2020; 11:94.
2020; Maas MB, Iwanaszko M, Lizza BD, et al. Circadian gene expression rhythms during critical illness. crit care med. 48:e1294-e1299.
Diaz E, Diaz I, Del Busto C, et al. Clock genes disruption in the intensive care unit. J Intensive Care Med 2020; 35:1497-1504.
Coiffard B, Diallo AB, Culver A, et al. Circadian rhythm disruption and sepsis in severe trauma patients. Shock 2019; 52:29-36.
Hughes ME, Abruzzi KC, Allada R, et al. Guidelines for genome-scale analysis of biological rhythms. J Biol Rhythms 2017; 32:380-393.
37[■][■]. Maas MB, Lizza BD, Kim M, et al. Stress-induced behavioral quiescence and abnormal rest-activity rhythms during critical illness. Crit Care Med 2020; 48:862-871.
Large observational study in 112 critically ill patients quantifying rest-activity rhythms compared with 101 control patients (age-matched community-dwelling volunteers, hospital bedrest volunteers, and sleep deprived volunteers) using 24 h accelerometry.
38[■][■]. Maas MB, Lizza BD, Abbott SM, et al. Factors disrupting melatonin secretion rhythms during critical illness. Crit Care Med 2020; 48:854-861.
Large observational study observing melatonin rhythms in 112 ICU patients for 24-48 h within the first day of ICU admission in combination with the assessment of environmental entrainers including light intensity, nutritional intake, physical activity levels, medication, encephalopathy, and multiple organ system function.
McNelly AS, Bear DE, Connolly BA, et al. Effect of intermittent or continuous feed on muscle wasting in critical illness: A phase II clinical trial. Chest 2020.
Dong J, Liu R, Li L, et al. [Effects of intermittent feeding and continuous feeding on muscle atrophy and nutritional status in critically ill patients]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue 2021; 33:844-848.
Ren CJ, Yao B, Tuo M, et al. Comparison of sequential feeding and continuous feeding on the blood glucose of critically ill patients: a noninferiority randomized controlled trial. Chin Med J (Engl) 2021; 134:1695-1700.
Sjulin TJ, Strilka RJ, Huprikar NA, et al. Intermittent gastric feeds lower insulin requirements without worsening dysglycemia: a pilot randomized crossover trial. Int J Crit Illn Inj Sci 2020; 10:200-205.
Seyyedi J, Rooddehghan Z, Mohammadi M, et al. Comparison of the effect of enteral feeding through the bolus and continuous methods on serum phosphorus and glucose levels in patients with mechanical ventilation: a randomized clinical trial. J Nutr Metab 2020; 2020:6428418.
Zhu W, Jiang Y, Li J. Intermittent versus continuous tube feeding in patients with hemorrhagic stroke: a randomized controlled clinical trial. Eur J Clin Nutr 2020; 74:1420-1427.
Satinsky I, Richtarova J. Intermittent feeding in intensive care - the theory and practice. Rozhl Chir 2021; 100:66-73.
46[■]. Ma Y, Cheng J, Liu L, et al. Intermittent versus continuous enteral nutrition on feeding intolerance in critically ill adults: a meta-analysis of randomized controlled trials. Int J Nurs Stud 2021; 113:103783.
Latest meta-analysis on the effects of intermittent versus continuous enteral feeding on feeding intolerance in critically ill adults.
47[■][■]. Flower L, Haines RW, McNelly A, et al. Effect of intermittent or continuous feeding and amino acid concentration on urea-to-creatinine ratio in critical illness. J Parenter Enteral Nutr 2021.
Sub study on one of the largest multicentre RCT that compared 10 days of intermittent feeding with continuous feeding on muscle mass changes. This secondary analysis assessed urea-to-creatinine ratio trajectory, as a marker of muscle wasting, during intermittent vs continuous feeding.
- Abe T, Kazama R, Okauchi H, et al. Food deprivation during active phase induces skeletal muscle atrophy via IGF-1 reduction in mice. Arch Biochem Biophys 2019; 677:108160.
49[■][■]. Lundell LS, Parr EB, Devlin BL, et al. Time-restricted feeding alters lipid and amino acid metabolite rhythmicity without perturbing clock gene expression. Nat Commun 2020; 11:4643.
One of the few diet-controlled human studies that investigated the effect of 5 days of time-restricted eating on clock gene expression in vivo in skeletal muscle.
Jamshed H, Beyl RA, Della Manna DL, et al. Early time-restricted feeding improves 24-h glucose levels and affects markers of the circadian clock, aging, and autophagy in humans. Nutrients 2019; 11:1234.
Jakubowicz D, Landau Z, Tsameret S, et al. Reduction in glycated hemoglobin and daily insulin dose alongside circadian clock upregulation in patients with type 2 diabetes consuming a three-meal diet: a randomized clinical trial. Diabetes Care 2019.
Davis R, Bonham MP, Nguo K, et al. Glycaemic response at night is improved after eating a high protein meal compared with a standard meal: a cross-over study. Clin Nutr 2020; 39:1510-1516.
Parr EB, Devlin BL, Radford BE, et al. A delayed morning and earlier evening time-restricted feeding protocol for improving glycemic control and dietary adherence in men with overweight/obesity: a randomized controlled trial. Nutrients 2020; 12:505.
Plummer MP, Bellomo R, Cousins CE, et al. Dysglycaemia in the critically ill and the interaction of chronic and acute glycaemia with mortality. Intensive Care Med 2014; 40:973-980.
Investigators N-SS, Finfer S, Chittock DR, et al. Intensive versus conventional glucose control in critically ill patients. N Engl J Med 2009; 360:1283-1297.
56[■][■]. Van Dyck L, Vanhorebeek I, Wilmer A, et al. Towards a fasting-mimicking diet for critically ill patients: the pilot randomized crossover ICU-FM-1 study. Crit Care 2020; 24:249.
This pilot study in critically ill patients shows that 24-h macronutrient restriction can initiate a metabolic fasting response.
57[■]. Held NM, Wefers J, van Weeghel M, et al. Skeletal muscle in healthy humans exhibits a day-night rhythm in lipid metabolism. Mol Metab 2020; 37:100989.
Clinical study in humans showing that skeletal muscle lipid content and composition displays day-night rhythmicity in healthy, lean volunteers.
- van Moorsel D, Hansen J, Havekes B, et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity. Mol Metab 2016; 5:635-645.
# 病危期间及之后血糖控制的进展
综述目的
危重症与糖代谢紊乱之间存在复杂的双向关系。本综述旨在通过需要入住重症监护室 (ICU) 的急性疾病之前、期间和之后的不同阶段,对近期有关危重症与葡萄糖代谢紊乱之间关系的证据进行全面总结。
近期结果
最近的数据表明,在危重疾病期间,预先存在的葡萄糖代谢会影响最佳的血糖目标,初步数据表明,应根据预先存在的血糖 “个性化” 血糖目标。由于危重症和葡萄糖代谢紊乱之间存在密切关联,因此需要在 ICU 床边通过快速、精确和经济有效的测量来优化血糖监测。近期研究对各种方法的使用进行了评价,重点关注近连续血糖监测的使用。对于那些在 ICU 存活下来的已有糖尿病的患者,夜间低血糖可能是一个未被识别的重要问题,当他们出院进入病房时。越来越多的证据表明,急性疾病期间伴有高血糖(即所谓的 “应激性高血糖”)的患者在从刺激事件中恢复后数年内发生糖尿病的风险升高。COVID-19 重症患者的风险似乎更高。
总结
最近对危重病期间血糖监测方法和血糖目标、离开 ICU 时降糖药物的监测和给药以及应激性高血糖患者的纵向随访有了重要的见解。
关键词
血糖、危重症、糖尿病、肠内营养、低血糖
# 要点
・近动态血糖监测和闭环血糖控制已显示出治疗潜力,但尚未被纳入主流临床实践。 ・尽管直观可行,但高质量证据不支持基于既存血糖的个性化血糖目标。 ・应激性高血糖是危重疾病幸存者随后发生 2 型糖尿病的公认风险因素。
# 引言
危重疾病期间的血糖浓度与预后之间有很强的相关性。可采用多种度量指标报告血糖;包括但不限于高血糖、低血糖和血糖浓度变异性,称为血糖变异性 [1,2]。所有这些血糖指标紊乱的严重程度与死亡率增加密切相关 [3]。
# 血糖监测更新
为了治疗高血糖并限制低血糖和血糖变异性,重症监护室 (ICU) 的医务工作者需要监测血糖。理想的监测方法是快速提供结果,涉及最小失血量以方便重复测量,在广泛的血糖浓度范围和临床状况下是精确的,尤其是在低血糖值下,并且不需要过多的护理或其他医护人员时间。
可采用动脉、静脉或毛细血管血液以及间质液测量血糖 [4]。由于需要快速和精确的结果,以及 ICU 随时可用的动脉血气分析仪,我们认为血气分析仪测量的葡萄糖是重症患者的 “金标准”[5]。根据我们单独使用动脉血气分析仪获得血糖的经验,如果不需要监测血气分析仪提供的其他变量,可能会占用医护工作者的时间,因为这确实涉及远离床边。此外,频繁采血确实会增加失血和环境浪费。因此,在大多数 ICU 中,使用床旁检测方法通过毛细血管血间歇性检测进行监测 [6,7]。虽然在群体水平,使用床旁检测测量的外周血血糖浓度与 “金标准” 测量结果密切相关,尤其是极端值阶段(即,显著低血糖和高血糖)以平均值、个体结果为中心的值缺乏一致性 [8]。这一点很重要,因为这是可能导致伤害的极值,需要精确定量。危重患者床旁检测的不精确来源是由于代谢和心血管(休克)异常,以及同时给药的直接化学干扰 [4]。
所谓的 “连续血糖监测仪”,在对多个变量(例如心率、血压和脉搏血氧饱和度)进行实时连续测量的 ICU 环境中,被更准确地称为近连续血糖监测仪(近 CGM),满足理想血糖方法的几个标准 [9]。Near-CGM 可通过经皮或皮下导管与全血、动脉内或静脉 (IV) 导管或组织液一起使用 [4,10,11]。不同专利设备之间定量葡萄糖浓度的方法和报告葡萄糖浓度的频率不同,但通常在 5-10 min 的滞后间隔内运行 [4,12]。
近期在 ICU 评估近 CGM 的研究包括一项在单个 ICU 内 4 个 “pods” 的群组随机交叉研究 [10]。在该试验中,在 IV 胰岛素给药期间,将 pod 随机分配为使用接近 CGM,或在使用 IV 胰岛素时以 “设盲” 模式操作接近 CGM。将近 CGM 传感器放置在专用的外周 20 号插管中,将其插入前臂静脉。目标血糖范围为 90-150 mg/dL (5.0-8.3 mmol/L)[10]。作者招募了 77 例患者,并报告当使用近 CGM 时,低血糖(定义为 < 70 mg/dL,3.9 mmol/L)的发生率大约减半(21% 对比 40%)[10]。近期报告的 ICU 中接近 CGM 的其他方法包括使用光谱测定法(应用于专用的中心静脉导管腔),每 15 min 自动采集 0.17 mL 血样 [13]。虽然这种新方法看起来很精确,但是危重患者需要接受多种 IV 治疗,并且这种技术的采用可能会受到仅用于监测血糖的中心静脉导管腔的实际损失的阻碍。在 COVID-19 大流行的早期阶段,使用近 CGM 进行 “远程” 监测的积极性相当高 [14,15]。在传染性感染患者中减少针头和血液采样在理论上具有优势,但在 ICU 中实施近 CGM 的成本效益尚不清楚。
大多数评估近 CGM 的研究使用某种形式的 “决策支持工具”,这需要临床医生输入来调整胰岛素给药。此类决策支持工具包括基于纸质算法和基于计算机算法,并包括变量如当前 / 既往血糖、胰岛素给药和卡路里输送 [4,16]。纳入一个闭环决策支持工具直观地吸引人,该工具利用最近的近 CGM 结果来滴定胰岛素给药,因此不再需要医务工作者的输入 [17]。然而,最近的研究是单中心研究,通常偏好基于计算机的决策支持工具,而不是完整的闭环系统 [18]。据我们所知,唯一的闭环系统(带有自动 IV 胰岛素给药的近 CGM)仅限于在日本使用。10 年前,在对入住 5 床 ICU 的 208 例患者的稽查中首次报告了这种闭环系统的使用 [19]。作者报告完全没有低血糖发作。闭环系统已被用于重症患者,包括接受体外膜肺氧合的患者 [20]。对该闭环系统的全面解释见其他地方 [21]。
如下所述,根据既存血糖控制,对 “个性化” 血糖目标的关注日益增加。因此,采用糖化血红蛋白 (HbA1c) 快速估计既存血糖是合理的。初步的单中心证据表明,HbA1c 的床旁检测可靠,并与正式的实验室测量一致 [22]。
# 葡萄糖目标的更新
观察性数据一致报告,死亡与高血糖之间的关联受到了既存血糖控制的显著影响 [23-26]。此外,治疗诱发的低血糖风险(死亡率升高的强预测因素)在既存高血糖患者中最大 [27,28]。最近对 3,625 名至少进行了 4 次血糖测量和 HbA1c 测量的患者进行的一项单中心回顾性队列研究报告,对于 HbA1c > 8.0% 的患者,如果血糖水平在 180 至 250 mg/dL(10 至 14 mmol/L)之间的时间比例较大,则死亡率较低 [29&]。此类数据支持以下假设:在无糖尿病的患者中,被认为是安全和理想的血糖浓度 (108-180 mg/dL) 在既存血糖不耐受的患者中实际上可能是不理想和有害的,这证实了血糖目标应基于既存血糖 “个体化” 的概念 [29&,30,31]。评价糖尿病患者血糖目标更自由方法的前瞻性研究仅限于单中心研究,各研究均存在实质性的方法学缺陷 [29&,30,31]。尽管如此,这些研究的信号是,在开始胰岛素治疗前允许适度的高血糖,并且目标血糖浓度在 180 至 250 mg/dL(10 至 14 mmol/L)之间似乎耐受良好,有减少低血糖发作的趋势 [29&,30,31,32]。
最近,一项重要的多中心试验(CONTROLLING 试验)试图解决以下问题:基于入院时糖化血红蛋白的 “个体化” 血糖控制目标方法是否可降低 90 天全因死亡率?在平行组设计中,危重成人患者随机 (1:1) 接受 “个体化” 或 “常规” 血糖控制目标方法 [33&&]。预期在 ICU 住院 48h 且不能摄入食物的重症患者在 ICU 入院 96h 内测量 HbA1c。对于分配至个体化血糖控制的患者,HbA1c 确定了血糖目标,而对于分配至常规控制的患者,血糖目标为 180 mg/dL (10 mmol/L) 或更低。与上述仅纳入既存糖尿病患者的研究不同,本研究中 2/3 的患者未患糖尿病。这导致对照试验中大部分患者的血糖目标与 “严格血糖控制”(81-108 mg/dL 或 4.56.0 mmol/L)相似,在 NICE-SUGAR 中证明对患者有害 [34]。独立数据安全性监查委员会 (DSMB) 建议在首次中期分析时停止对照试验,原因是受试者的低血糖发生率高,并且备择假设被证明是正确的可能性低。应该注意的是,没有既存的 DSMB 章程或停止规则。在纳入了 2917 例受试者的数据的 2075 例患者后停止试验。个体化对照组 938 例患者中 308 例 (32.8%) 死亡,常规对照组 968 例患者中 295 例 (30.5%) 死亡 [33&&]。中度低血糖 (< 72 mg/dL) or
<4.0 mmol/L)更常见于个体化控制 (294/942 (31%) vs. 154/975 (16%);P < 0.01),但是重度低血糖的发生率没有统计学显著差异(< 40 mg/dL 或 < 2.2 mmol/L;37/942 (3.9%) vs. 24/975 (2.5%);P = 0.09)。对未患糖尿病的患者进行事后分析,发现个体化血糖目标有增加 90 天死亡率的信号(风险比:1.3,95% CI 1.05-1.59)。CONTROLLING 试验结果对 NICE-SUGAR 试验结果进行了补充,以提供更大的确定性,即无论患者既往是否患有糖尿病,“严格控制血糖” 或将血糖目标定为 < 110 mg/dL (6.1 mmol/L) 是有害的,应避免使用。但是,在对照试验中,是否未讨论 “个体化” 目标并允许中度高血糖(> 180 mg/dL 或 10 mmol/L)降低既存糖尿病患者的绝对和 / 或相对低血糖的策略。未来的试验,如 LUCID,将有助于了解本队列的决策 [35]。
# 重症监护病房出院后血糖监测更新
在高度监测的 ICU 环境中从连续 IV 给予胰岛素转变为在监测较少的病房环境中间歇给予皮下胰岛素增加了不良预后的风险 [36-40]。为了更好地量化这种风险,我们在澳大利亚的两家医院进行了一项队列研究,招募了 31 例从 ICU 出院并处方了皮下注射胰岛素的 2 型糖尿病患者 [41&]。我们对近 CGM 患者进行了 5 天的观察,发现超过三分之一的患者存在低血糖(< 63 mg/dL 或 3.5 mmol/L),大多数低血糖发作发生在夜间,无伴随症状,然后持续数小时 [41&]。鉴于该队列中普遍存在相关的心血管自主神经病变和无症状性低血糖,此类低血糖发作可能有害。如果这些数据代表了在其他医院提供的护理,应鼓励在出院时采用更大范围的血糖监测,并考虑采用胰岛素替代方案来降低血糖,而不存在低血糖风险 [40],并更着重于根据患者的需求匹配营养治疗 [42,43]。
我们最近还完成了一项研究,评估了需要 > 5 天 ICU 护理并存活至离开 ICU 的 2 型糖尿病患者的预后 [44&]。我们重点关注该队列,因为糖尿病通常是一种既存疾病,且该队列的预后仍不确定 [45]。本研究的主要预后是确定一项大型随机临床试验是否可行,该试验旨在评价重症监护病房 (ICU) 中 2 型糖尿病幸存者的重症监护 - 内分泌科诊所。本研究未达到规定的可行性目标。但是,结果较差,< 50% 的受试者在一年时独立生活且无支持 [44&],表明这是一个极度需要额外干预以改善结果的队列。
# 对重症监护病房存活者中应激性高血糖的影响进行更新
即使没有既存糖尿病,危重患者也经常发生明显的高血糖 [46]。这种 “应激性高血糖” 的病理生理学被认为是暂时性胰岛素抵抗所致。但是,最近的数据表明,应激性高血糖确定了患者有发生糖尿病前期和糖尿病的风险 [47-49]。最近使用来自 43 家香港医院之一的 31,691 例因血液感染而住院的患者的数据进行了一项倾向匹配的队列研究。研究者使用 ICD-9 编码确定了再次入院患者的后续糖尿病,或使用社区处方降糖药物确定了在后续 5 年内未再次入院的患者。研究者观察到应激性高血糖使随后的糖尿病风险增加了 2 倍 [50&&]。为了探索前驱糖尿病和糖尿病发生的潜在机制,我们对 40 例应激性高血糖患者进行了一项前瞻性、单中心、队列研究,这些患者存活至出院,并在进入 ICU 后 3 个月和 12 个月进行了 HbA1c 测量和口服葡萄糖耐量试验 [51&]。糖尿病和前驱糖尿病经常发生,β 细胞分泌能力降低和胰岛素抵抗增加均会导致葡萄糖代谢恶化 [51&]。进展至糖尿病前期和糖尿病的一致性信号表明,需要进行更大规模的研究,以便在有应激性高血糖的危重疾病幸存者中早期检测和 / 或预防糖尿病。
对评价 COVID-19 患者是否代表一个具有更高继发性糖尿病风险的队列有相当大的兴趣。COVID-19 患者入住 ICU 时经常发生应激性高血糖 [52]。在所有入住 ICU 的患者中,5-7% 的患者首次确诊为未确诊的糖尿病 [25]。但是,最近对 8 项研究进行的荟萃分析报告称,伴有未确诊或新发糖尿病的患者比例在伴有 COVID-19 住院的患者中高 2-3 倍(合并比例估计值为 14.4%(95% CI,5.9-25.8%))[53&]。为什么在没有确诊 COVID-19 的情况下,COVID-19 会比危重疾病更增加随后的前驱糖尿病和糖尿病的风险?据推测,胰岛细胞可通过冠状病毒与胰岛细胞上的 ACE2 受体直接结合而被破坏,或由于 COVID-19 继发的促炎状态而通过间接途径被破坏 [54]。需要纵向研究来确定 COVID-19 的生存者是否存在发展为糖尿病前期和糖尿病的特殊风险。
# 总结 / 结论
危重症期间和危重症之后的葡萄糖代谢有了最新进展。近 CGM 很有吸引力,但血糖监测仍主要采用床旁血糖仪和手指针刺样本间歇性进行。危重疾病期间的血糖目标应根据既存血糖进行个性化设置是合理的,但缺乏支持这种方法的证据。临床医生在离开 ICU 时处方降糖药物时也应考虑密切监测。有必要开展研究评估应激性高血糖患者是否发生糖尿病前期和糖尿病。
# REFERENCES
DETAILS
- Rousseau AF, Prescott HC, Brett SJ, et al. Long-term outcomes after critical illness: recent insights. Crit Care 2021; 25:108.
2[■]. Regmi P, Heilbronn LK. Time-restricted eating: benefits, mechanisms, and challenges in translation. iScience 2020; 23:101161.
This review provides an overview on the effect of meal timing on circadian rhythmns and summarises the mechanisms of action on the proposed metabolic health benefits of time-restricted eating in preclinical models and humans.
Krinsley JS, Deane AM, Gunst J. The goal of personalized glucose control in the critically ill remains elusive. Intensive Care Med 2021; 47:1319-1321.
Klonoff DC, Wang J, Rodbard D, et al. A glycemia risk index (GRI) of hypoglycemia and hyperglycemia for continuous glucose monitoring validated by clinician ratings. J Diabetes Sci Technol 2022; 19322968221085273doi: 10.1177/19322968221085273. [Online ahead of print].
Plummer MP, Deane AM. Dysglycemia and glucose control during sepsis. Clin Chest Med 2016; 37:309-319.
Salinas PD, Mendez CE. Glucose management technologies for the critically ill. J Diabetes Sci Technol 2019; 13:682-690.
Eerdekens GJ, Rex S, Mesotten D. Accuracy of blood glucose measurement and blood glucose targets. J Diabetes Sci Technol 2020; 14:553-559.
Poole AP, Anstey J, Bellomo R, et al. Opinions and practices of blood glucose control in critically ill patients with preexisting type 2 diabetes in Australian and New Zealand intensive care units. Aust Crit Care 2019; 32:361-365.
Pili-Floury S, Schneider C, Salomon du Mont L, et al. Blood glucose control management in critically ill adult patients: results of a French nationwide practice survey. Anaesth Crit Care Pain Med 2020; 39:447-449.
Deng T, Liu M, Pan L, et al. A comparison of arterial blood glucose and peripheral blood glucose levels in critically ill patients: measurements using the arterial blood gas analyzer and the rapid glucose meter. Ann Palliat Med 2021; 10:3179-3184.
Krinsley JS, Chase JG, Gunst J, et al. Continuous glucose monitoring in the ICU: clinical considerations and consensus. Crit Care 2017; 21:197.
Preiser J-C, Lheureux O, Thooft A, et al. Near-continuous glucose monitoring makes glycemic control safer in ICU patients. Crit Care Med 2018; 46:1224-1229.
Ancona P, Eastwood GM, Lucchetta L, et al. The performance of flash glucose monitoring in critically ill patients with diabetes. Crit Care Resusc 2017; 19:167-174.
Tingsarat W, Buranasupkajorn P, Khovidhunkit W, et al. The accuracy of continuous glucose monitoring in the medical intensive care unit. J Diabetes Sci Technol 2021; 19322968211027590doi: 10.1177/19322968211027590. [Online ahead of print].
Elder CT, Thigpin T, Karlnoski R, et al. Results of a multicenter feasibility study of an automated bedside glucose monitoring system in the burn intensive care setting. J Burn Care Res 2020; 41:535-538.
Faulds ER, Boutsicaris A, Sumner L, et al. Use of continuous glucose monitor in critically ill COVID-19 patients requiring insulin infusion: an observational study. J Clin Endocrinol Metab 2021; 106:e4007-e4016.
Klarskov CK, Windum NA, Olsen MT, et al. Telemetric continuous glucose monitoring during the COVID-19 pandemic in isolated hospitalized patients in denmark: a randomized controlled exploratory trial. Diabetes Technol Ther 2022; 24:102-112.
Knopp JL, Chase JG, Shaw GM. The goldilocks problem: Nutrition and its impact on glycaemic control. Clin Nutr 2021; 40:3677-3687.
van den Boorn M, Lagerburg V, van Steen SCJ, et al. The development of a glucose prediction model in critically ill patients. Comput Methods Programs Biomed 2021; 206:106105.
Davis GM, Faulds E, Walker T, et al. Remote continuous glucose monitoring with a computerized insulin infusion protocol for critically ill patients in a COVID-19 medical ICU: proof of concept. Diabetes Care 2021; 44:1055-1058.
Yatabe T, Yamazaki R, Kitagawa H, et al. The evaluation of the ability of closed-loop glycemic control device to maintain the blood glucose concentration in intensive care unit patients*. Crit Care Med 2011; 39:575-578.
Hinoue T, Yatabe T, Fujiwara H, Nishida O. Glucose control using an artificial pancreas in a severe COVID-19 patient on extracorporeal membrane oxygenation: a case report. J Anesth 2021; 35:586-590.
Namikawa T, Munekage M, Yatabe T, et al. Current status and issues of the artificial pancreas: abridged English translation of a special issue in Japanese. J Artif Organs 2018; 21:132-137.
Weinel LM, Summers MJ, Finnis ME, et al. Are point-of-care measurements of glycated haemoglobin accurate in the critically ill? Aust Crit Care 2019; 32:465-470.
Ma H, Yu G, Wang Z, et al. Association between dysglycemia and mortality by diabetes status and risk factors of dysglycemia in critically ill patients: a retrospective study. Acta Diabetol 2022; 59:461-470.
Krinsley JS, Rule P, Brownlee M, et al. Acute and chronic glucose control in critically ill patients with diabetes: the impact of prior insulin treatment. J Diabetes Sci Technol 2021; 19322968211032277doi: 10.1177/19322968211032277. [Online ahead of print].
Plummer MP, Bellomo R, Cousins CE, et al. Dysglycaemia in the critically ill and the interaction of chronic and acute glycaemia with mortality. Intensive Care Med 2014; 40:973-980.
Krinsley JS, Rule P, Pappy L, et al. The interaction of acute and chronic glycemia on the relationship of hyperglycemia, hypoglycemia, and glucose variability to mortality in the critically ill. Crit Care Med 2020; 48:1744-1751.
Vidger AJ, Czosnowski QA. Outcomes and adverse effects of extremely high dose insulin infusions in ICU patients. J Crit Care 2021; 63:62-67.
Kwan TN, Marhoon N, Young M, et al. Insulin therapy associated relative hypoglycemia during critical illness. J Crit Care 2022; 70:154018.
29[■]. Krinsley JS, Rule PR, Roberts GW, et al. Relative hypoglycemia and lower hemoglobin a1c-adjusted time in band are strongly associated with increased mortality in critically ill patients. Crit Care Med 2022; doi: 10.1097/CCM.0000000000005490. [Online ahead of print].
A large (>3000 patient) single-centre retrospective cohort utilising a novel metric of blood glucose control: a glycated haemoglobin adjusted time in band. This study demonstrated that blood glucose values in the range of 70-110 mg/dL range may deleterious for patients with chronic hyperglycaemia and a glycated haemoglobin >=8%.
Kar P, Plummer MP, Bellomo R, et al. Liberal glycemic control in critically ill patients with type 2 diabetes: an exploratory study. Crit Care Med 2016; 44:1695-1703.
Luethi N, Cioccari L, Biesenbach P, et al. Liberal glucose control in ICU patients with diabetes: a before-and-after study. Crit Care Med 2018; 46:935-942.
Luethi N, Cioccari L, Eastwood G, et al. Hospital-acquired complications in intensive care unit patients with diabetes: a before-and-after study of a conventional versus liberal glucose control protocol. Acta Anaesthesiol Scand 2019; 63:761-768.
33[■][■]. Bohe J, Abidi H, Brunot V, et al. Individualised versus conventional glucose control in critically-ill patients: the CONTROLING study-a randomized clinical trial. Intensive Care Med 2021; 47:1271-1283.
A vanguard randomized controlled trial that successfully blinded the glucose control regimen. This study demonstrated no benefit with personalized glucose targets over conventional control but was limited by inadequate treatment separation.
Finfer S, Chittock DR, Su SY, et al. Intensive versus conventional glucose control in critically ill patients. N Engl J Med 2009; 360:1283-1297.
Poole AP, Finnis ME, Anstey J, et al. Study protocol and statistical analysis plan for the Liberal Glucose Control in Critically Ill Patients with Preexisting Type 2 Diabetes (LUCID) trial. Crit Care Resusc 2020; 22:133-141.
Kyi M, Colman PG, Rowan LM, et al. Glucometric benchmarking in an Australian hospital enabled by networked glucose meter technology. Med J Aust 2019; 211:175-180.
Dwyer P, Drinkwater JJ, Fegan PG, et al. A prospective six-month audit of inpatient hypoglycemia in step-down general medical and geriatric wards. Int J Med Sci 2021; 18:3744-3747.
Sweeney AT, Pena S, Sandeep J, et al. Use of a Continuous Glucose Monitoring System in High Risk Hospitalized Noncritically ill Patients with Diabetes after Cardiac Surgery and during their Transition of Care from the Intensive Care Unit during Covid-19-A Pilot Study. Endocr Pract 2022; 28:615-621.
Krinsley JS, Maurer P, Holewinski S, et al. Glucose control, diabetes status, and mortality in critically ill patients: the continuum from intensive care unit admission to hospital discharge. Mayo Clin Proc 2017; 92:1019-1029.
Hulst AH, Plummer MP, Hollmann MW, et al. Systematic review of incretin therapy during peri-operative and intensive care. Crit Care 2018; 22:299.
41[■]. Ali Abdelhamid Y, Bernjak A, Phillips LK, et al. Nocturnal hypoglycemia in patients with diabetes discharged from ICUs: a prospective two-center cohort study. Crit Care Med 2021; 49:636-649.
Prospective observational study in 31 patients with type 2 diabetes who were discharged from ICU and prescribed subcutaneous insulin on the wards demonstrating the hypoglycaemia occurs frequently and is predominantly noctural, asymptomatic and prolonged.
Doola Re, Preiser J-C. Nutritional therapy in critically ill patients with diabetes. Curr Opin Clin Nutr Metab Care 2022; 25:93-98.
Eckert I, Kumbier MCC, Silva FM, et al. Association of specialized enteral nutrition with glycemic control and clinical outcomes in critically ill patients: a meta-analysis of randomized controlled trials. Clin Nutr 2021; 40:3940-3949.
44[■]. Ali Abdelhamid Y, Phillips LK, White MG, et al. Survivors of intensive care with type 2 diabetes and the effect of shared-care follow-up clinics: The SWEET-AS Randomized Controlled Pilot Study. Chest 2021; 159:174-185.
A prospective randomized single-center pilot study of a shared care ICU-endocrinology post-ICU follow-up clinic versus standard of care. Short term outcomes for ICU survivors with diabetes were poor; over a quarter of patients had died and less than half were living independently.
Ali Abdelhamid Y, Plummer MP, Finnis ME, et al. Long-term mortality of critically ill patients with diabetes who survive admission to the intensive care unit. Crit Care Resusc 2017; 19:303-309.
Al-Yousif N, Rawal S, Jurczak M, et al. Endogenous glucose production in critical illness. Nutr Clin Pract 2021; 36:344-359.
Ali Abdelhamid Y, Kar P, Finnis ME, et al. Stress hyperglycaemia in critically ill patients and the subsequent risk of diabetes: a systematic review and meta-analysis. Crit Care 2016; 20:301.
Plummer MP, Finnis ME, Phillips LK, et al. Stress induced hyperglycemia and the subsequent risk of type 2 diabetes in survivors of critical illness. PLoS One 2016; 11:e0165923.
Du YT, Kar P, Abdelhamid YA, et al. Glycated haemoglobin is increased in critically ill patients with stress hyperglycaemia: Implications for risk of diabetes in survivors of critical illness. Diabetes Res Clin Pract 2018; 135:73-75.
50[■][■]. Wang X, Cheng FTF, Lam TYT, et al. Stress hyperglycemia is associated with an increased risk of subsequent development of diabetes among bacteremic and nonbacteremic patients. Diabetes Care 2022; 45:1438-1444.
A large retrospective observational sudy of 224,534 patients reporting that hospitalized bacteremic patients with stress hyperglycaemia had approximately a two-fold increased risk of diabetes compared to those with normal glucose tolerance.
51[■]. Kar P, Plummer MP, Ali Abdelhamid Y, et al. Incident diabetes in survivors of critical illness and mechanisms underlying persistent glucose intolerance: a prospective cohort study. Crit Care Med 2019; 47:e103-e111.
A prospective single centre cohort study that followed up 40 critically ill patients with stress hyperglycaemia at 3 and 12 months with an oral glucose tolerance test reporting that the incidence of diabetes was 37% at 3 months and 27% at 12 months.
- Tan E, Song J, Deane AM, Plummer MP. Global impact of coronavirus disease 2019 infection requiring admission to the ICU: a systematic review and meta-analysis. Chest 2021; 159:524-536.
53[■]. Sathish T, Kapoor N, Cao Y, et al. Proportion of newly diagnosed diabetes in COVID-19 patients: a systematic review and meta-analysis. Diabetes Obes Metab 2021; 23:870-874.
A systematic review and meta-analysis of eight studies inclusive of more than 3700 patients showing a pooled proportion of 14.4% for newly diagnosed diabetes in hospitalized COVID-19 patients.
- Khunti K, Del Prato S, Mathieu C, et al. COVID-19, hyperglycemia, and new-onset diabetes. Diabetes Care 2021; 44:2645-2655.
3[■]. Daou M, Telias I, Younes M, et al. Abnormal sleep, circadian rhythm disruption, and delirium in the ICU: are they related? Front Neurol 2020; 11:549908.
Review on the physiological consequences of poor sleep quality circadian dysrhythmia, delirium and critical illness.
Kreymann KG, Berger MM, Deutz NE, et al. ESPEN guidelines on enteral nutrition: intensive care. Clin Nutr 2006; 25:210-223.
McClave SA, Taylor BE, Martindale RG, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). J Parenter Enteral Nutr 2016; 40:159-211.
6[■]. Parr EB, Heilbronn LK, Hawley JA. A time to eat and a time to exercise. Exerc Sport Sci Rev 2020; 48:4-10.
Perspective paper summarising the effects of time-restricted eating and exercise training on metabolic health.
Bohe J, Low JF, Wolfe RR, et al. Latency and duration of stimulation of human muscle protein synthesis during continuous infusion of amino acids. J Physiol 2001; 532 (Pt 2):575-579.
Gazzaneo MC, Suryawan A, Orellana RA, et al. Intermittent bolus feeding has a greater stimulatory effect on protein synthesis in skeletal muscle than continuous feeding in neonatal pigs. J Nutr 2011; 141:2152-2158.
Evans DC, Forbes R, Jones C, et al. Continuous versus bolus tube feeds: Does the modality affect glycemic variability, tube feeding volume, caloric intake, or insulin utilization? Int J Crit Illn Inj Sci 2016; 6:9-15.
Chowdhury AH, Murray K, Hoad CL, et al. Effects of bolus and continuous nasogastric feeding on gastric emptying, small bowel water content, superior mesenteric artery blood flow, and plasma hormone concentrations in healthy adults: a randomized crossover study. Ann Surg 2016; 263:450-457.
Dirks ML, Smeets JSJ, Holwerda AM, et al. Dietary feeding pattern does not modulate the loss of muscle mass or the decline in metabolic health during short-term bed rest. Am J Physiol Endocrinol Metab 2019; 316:E536-E545.
Pletschette Z, Preiser JC. Continuous versus intermittent feeding of the critically ill: have we made progress? Curr Opin Crit Care 2020; 26:341-345.
Puthucheary Z, Gunst J. Are periods of feeding and fasting protective during critical illness? Curr Opin Clin Nutr Metab Care 2021; 24:183-188.
Di Girolamo FG, Situlin R, Fiotti N, et al. Intermittent vs. continuous enteral feeding to prevent catabolism in acutely ill adult and pediatric patients. Curr Opin Clin Nutr Metab Care 2017; 20:390-395.
Bear DE, Hart N, Puthucheary Z. Continuous or intermittent feeding: pros and cons. Curr Opin Crit Care 2018; 24:256-261.
Van Dyck L, Casaer MP. Intermittent or continuous feeding: any difference during the first week? Curr Opin Crit Care 2019; 25:356-362.
Patel JJ, Rosenthal MD, Heyland DK. Intermittent versus continuous feeding in critically ill adults. Curr Opin Clin Nutr Metab Care 2018; 21:116-120.
Zheng X, Sehgal A. AKT and TOR signaling set the pace of the circadian pacemaker. Curr Biol 2010; 20:1203-1208.
Crosby P, Hamnett R, Putker M, et al. Insulin/IGF-1 drives PERIOD synthesis to entrain circadian rhythms with feeding time. Cell 2019; 177:896-909 e20.
20[■][■]. Tuvia N, Pivovarova-Ramich O, Murahovschi V, et al. Insulin directly regulates the circadian clock in adipose tissue. Diabetes 2021; 70:1985-1999.
One of the first human studies to show insulin as the primary mechanism of feeding-induced entrainment of peripheral circadian clocks in adipose tissue (through transcriptional changes in PER leading to the phase shift of circadian oscillations).
Lamia KA, Sachdeva UM, DiTacchio L, et al. AMPK regulates the circadian clock by cryptochrome phosphorylation and degradation. Science 2009; 326:437-440.
Ramsey KM, Yoshino J, Brace CS, et al. Circadian clock feedback cycle through NAMPT-mediated NAD+ biosynthesis. Science 2009; 324:651-654.
Nakahata Y, Sahar S, Astarita G, et al. Circadian control of the NAD+ salvage pathway by CLOCK-SIRT1. Science 2009; 324:654-657.
24[■][■]. Zeb F, Wu X, Chen L, et al. Effect of time-restricted feeding on metabolic risk and circadian rhythm associated with gut microbiome in healthy males. Br J Nutr 2020; 123:1216-1226.
This study is one of the first to demonstrate that time-restricted eating increases gut microbiome diversity and alters Sirt1 and clock genes Bmal1 and Clock mRNA expression in humans.
25[■][■]. Mindikoglu AL, Abdulsada MM, Jain A, et al. Intermittent fasting from dawn to sunset for 30 consecutive days is associated with anticancer proteomic signature and upregulates key regulatory proteins of glucose and lipid metabolism, circadian clock, DNA repair, cytoskeleton remodeling, immune system and cognitive function in healthy subjects. J Proteomics 2020; 217:103645.
This is the first human serum proteomics study assessing the effect of 30-day intermittent fasting with simultaneous assessment of clinical metabolic parameters, serum biomarkers, and faecal microbiota.
- Mason IC, Qian J, Adler GK, et al. Impact of circadian disruption on glucose metabolism: implications for type 2 diabetes. Diabetologia 2020; 63:462-472.
27[■]. Zhao L, Hutchison AT, Wittert GA, et al. Intermittent fasting does not uniformly impact genes involved in circadian regulation in women with obesity. Obesity 2020; 28 Suppl 1:S63-S67.
This is one of the few human studies to examine the impact of intermittent fasting on peripheral clocks by analysing clock gene expression in human muscle and adipose fat tissue biopsies following an 8-week intermittent fasting intervention in 37 women with obesity.
Acuna-Fernandez C, Marin JS, Diaz-Casado ME, et al. Daily changes in the expression of clock genes in sepsis and their relation with sepsis outcome and urinary excretion of 6-sulfatoximelatonin. Shock 2020; 53:550-559.
Diaz E, Diaz I, Del Busto C, et al. Clock genes disruption in the intensive care unit. J Intensive Care Med 2019; 885066619876572.
Davidson S, Villarroel M, Harford M, et al. Day-to-day progression of vital-sign circadian rhythms in the intensive care unit. Crit Care 2021; 25:156.
31[■][■]. Okutan B, Kjer CKW, Poulsen LM, et al. Sleep-wake rhythms determined by actigraphy during in-hospital stay following discharge from an intensive care unit. Acta Anaesthesiol Scand 2021; 65:801-808.
Prospective cohort study that quantified sleep-wake patterns using accelerometry in ICU patients in the first week after ICU discharge.
Yang PL, Ward TM, Burr RL, et al. Sleep and circadian rhythms in survivors of acute respiratory failure. Front Neurol 2020; 11:94.
2020; Maas MB, Iwanaszko M, Lizza BD, et al. Circadian gene expression rhythms during critical illness. crit care med. 48:e1294-e1299.
Diaz E, Diaz I, Del Busto C, et al. Clock genes disruption in the intensive care unit. J Intensive Care Med 2020; 35:1497-1504.
Coiffard B, Diallo AB, Culver A, et al. Circadian rhythm disruption and sepsis in severe trauma patients. Shock 2019; 52:29-36.
Hughes ME, Abruzzi KC, Allada R, et al. Guidelines for genome-scale analysis of biological rhythms. J Biol Rhythms 2017; 32:380-393.
37[■][■]. Maas MB, Lizza BD, Kim M, et al. Stress-induced behavioral quiescence and abnormal rest-activity rhythms during critical illness. Crit Care Med 2020; 48:862-871.
Large observational study in 112 critically ill patients quantifying rest-activity rhythms compared with 101 control patients (age-matched community-dwelling volunteers, hospital bedrest volunteers, and sleep deprived volunteers) using 24 h accelerometry.
38[■][■]. Maas MB, Lizza BD, Abbott SM, et al. Factors disrupting melatonin secretion rhythms during critical illness. Crit Care Med 2020; 48:854-861.
Large observational study observing melatonin rhythms in 112 ICU patients for 24-48 h within the first day of ICU admission in combination with the assessment of environmental entrainers including light intensity, nutritional intake, physical activity levels, medication, encephalopathy, and multiple organ system function.
McNelly AS, Bear DE, Connolly BA, et al. Effect of intermittent or continuous feed on muscle wasting in critical illness: A phase II clinical trial. Chest 2020.
Dong J, Liu R, Li L, et al. [Effects of intermittent feeding and continuous feeding on muscle atrophy and nutritional status in critically ill patients]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue 2021; 33:844-848.
Ren CJ, Yao B, Tuo M, et al. Comparison of sequential feeding and continuous feeding on the blood glucose of critically ill patients: a noninferiority randomized controlled trial. Chin Med J (Engl) 2021; 134:1695-1700.
Sjulin TJ, Strilka RJ, Huprikar NA, et al. Intermittent gastric feeds lower insulin requirements without worsening dysglycemia: a pilot randomized crossover trial. Int J Crit Illn Inj Sci 2020; 10:200-205.
Seyyedi J, Rooddehghan Z, Mohammadi M, et al. Comparison of the effect of enteral feeding through the bolus and continuous methods on serum phosphorus and glucose levels in patients with mechanical ventilation: a randomized clinical trial. J Nutr Metab 2020; 2020:6428418.
Zhu W, Jiang Y, Li J. Intermittent versus continuous tube feeding in patients with hemorrhagic stroke: a randomized controlled clinical trial. Eur J Clin Nutr 2020; 74:1420-1427.
Satinsky I, Richtarova J. Intermittent feeding in intensive care - the theory and practice. Rozhl Chir 2021; 100:66-73.
46[■]. Ma Y, Cheng J, Liu L, et al. Intermittent versus continuous enteral nutrition on feeding intolerance in critically ill adults: a meta-analysis of randomized controlled trials. Int J Nurs Stud 2021; 113:103783.
Latest meta-analysis on the effects of intermittent versus continuous enteral feeding on feeding intolerance in critically ill adults.
47[■][■]. Flower L, Haines RW, McNelly A, et al. Effect of intermittent or continuous feeding and amino acid concentration on urea-to-creatinine ratio in critical illness. J Parenter Enteral Nutr 2021.
Sub study on one of the largest multicentre RCT that compared 10 days of intermittent feeding with continuous feeding on muscle mass changes. This secondary analysis assessed urea-to-creatinine ratio trajectory, as a marker of muscle wasting, during intermittent vs continuous feeding.
- Abe T, Kazama R, Okauchi H, et al. Food deprivation during active phase induces skeletal muscle atrophy via IGF-1 reduction in mice. Arch Biochem Biophys 2019; 677:108160.
49[■][■]. Lundell LS, Parr EB, Devlin BL, et al. Time-restricted feeding alters lipid and amino acid metabolite rhythmicity without perturbing clock gene expression. Nat Commun 2020; 11:4643.
One of the few diet-controlled human studies that investigated the effect of 5 days of time-restricted eating on clock gene expression in vivo in skeletal muscle.
Jamshed H, Beyl RA, Della Manna DL, et al. Early time-restricted feeding improves 24-h glucose levels and affects markers of the circadian clock, aging, and autophagy in humans. Nutrients 2019; 11:1234.
Jakubowicz D, Landau Z, Tsameret S, et al. Reduction in glycated hemoglobin and daily insulin dose alongside circadian clock upregulation in patients with type 2 diabetes consuming a three-meal diet: a randomized clinical trial. Diabetes Care 2019.
Davis R, Bonham MP, Nguo K, et al. Glycaemic response at night is improved after eating a high protein meal compared with a standard meal: a cross-over study. Clin Nutr 2020; 39:1510-1516.
Parr EB, Devlin BL, Radford BE, et al. A delayed morning and earlier evening time-restricted feeding protocol for improving glycemic control and dietary adherence in men with overweight/obesity: a randomized controlled trial. Nutrients 2020; 12:505.
Plummer MP, Bellomo R, Cousins CE, et al. Dysglycaemia in the critically ill and the interaction of chronic and acute glycaemia with mortality. Intensive Care Med 2014; 40:973-980.
Investigators N-SS, Finfer S, Chittock DR, et al. Intensive versus conventional glucose control in critically ill patients. N Engl J Med 2009; 360:1283-1297.
56[■][■]. Van Dyck L, Vanhorebeek I, Wilmer A, et al. Towards a fasting-mimicking diet for critically ill patients: the pilot randomized crossover ICU-FM-1 study. Crit Care 2020; 24:249.
This pilot study in critically ill patients shows that 24-h macronutrient restriction can initiate a metabolic fasting response.
57[■]. Held NM, Wefers J, van Weeghel M, et al. Skeletal muscle in healthy humans exhibits a day-night rhythm in lipid metabolism. Mol Metab 2020; 37:100989.
Clinical study in humans showing that skeletal muscle lipid content and composition displays day-night rhythmicity in healthy, lean volunteers.
- van Moorsel D, Hansen J, Havekes B, et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity. Mol Metab 2016; 5:635-645.
# 危重病前、中、后的营养
综述目的
本综述描述了重症监护室 (ICU) 前、ICU 内和 ICU 后阶段关于营养管理的注意事项和告知临床护理的文献基础的当前状态。
近期结果
在 ICU 内,研究重点关注异质性机械通气患者疾病的前 5-7 天,对病前营养状态的考虑极少。ICU 内的这段时间仍存在许多证据空白,主要是提供的蛋白质量和长期营养干预的影响。ICU 后期的个体化营养和营养正成为重点关注的领域。
总结
不应在孤立的时间段内观察危重患者的营养情况;在 ICU 之前、期间和之后发生的情况可能对整体恢复轨迹很重要。关键是在特定人群中研究住院期间营养对临床和功能预后的影响,并以生物学上合理影响的方式使用干预措施。显示出对未来重症监护营养有希望的领域包括干预持续时间更长,并包括口服营养支持、个体化营养方案和使用新的床旁身体组成技术来识别有营养风险的患者。
关键词
肠内营养、重症监护、营养、肠外营养、恢复
# 要点
・不应在每个时间点考虑营养,而应考虑整个住院期间营养的影响和提供。 ・在为重症患者制定安全和及时的营养计划时,考虑入住 ICU 前已存在的营养状态很重要。 ・在开始早期肠内营养后,研究尚未显示危重病患者早期给予营养的获益,但仍有大量证据尚待研究(例如,所需蛋白质量)。 ・ICU 后期和 ICU 后期(尤其是仅口服营养的患者)的营养供应问题正在被发现。 ・显示出重症监护营养未来前景的领域包括干预持续时间更长,并包括口服营养支持、个体化营养方案和使用新的床旁身体组成技术来识别有营养风险的患者。
# 引言
重症护理营养领域正经历着一个变化时期。直到最近,已有的证据来自小型低质量研究,重点关注入住重症监护室 (ICU) 前 5-7 天内的机械通气患者。对发病前营养状态和虚弱或第 7 天后和 ICU 后期营养输送的影响非常重视。尽管最初的试验在促进证据基础方面至关重要,但由于多种可能的原因,它们在临床和功能预后方面基本上未能显示任何获益。研究的人群具有异质性;有一些重症患者亚组更可能从危重症期间的强化营养治疗中获益,这是合理的,即在 ICU 入院时处于病态营养不良或有营养不良风险的患者。营养干预的时间和持续时间也可能是一个尚未了解的关键差距。与其在每个时间点考虑营养,还不如考虑整个住院期间营养的影响和供应。此外,个性化营养正成为一个焦点,在考虑营养和专门定制营养计划时,关注个体特征。本综述描述了有关营养管理的 ICU 前、ICU 内和 ICU 后的注意事项以及提供临床护理信息的文献库的当前状态。
# 危重疾病前的营养 - 是否重要?
在为重症患者制定安全及时的营养计划时,入住 ICU 前已存在的营养状态很重要。营养风险和营养状况评估是重要的考虑因素,讨论如下。
# 营养风险
已经开发并验证了许多可用的筛查工具,用于评估住院患者的营养风险。危重患者的营养风险 (NUTRIC) 评分范围为 0-10,专门开发用于重症患者 [1]。完成评分工具包括输入年龄、急性生理和慢性健康评估 II 评分、序贯性器官衰竭评估评分、合并症、入住 ICU 前住院天数以及血清 IL-6 水平 ±[1]。如果获得高 NUTRIC 评分,则认为患者存在营养不良风险,最有可能从积极的营养治疗中获益 [1]。许多观察性研究已报告入住 ICU 时的 NUTRIC 评分与临床预后之间存在强烈相关性 [2]。但是,必须谨慎解释这些结果,NUTRIC 评分中包含两个与疾病严重程度相关的评分要素。据我们所知,尚无前瞻性随机对照试验 (RCT) 对高和低 NUTRIC 评分患者的强化营养干预进行研究,且有足够的把握度获得临床和 / 或功能预后。
低肌肉量与营养不良和虚弱密切相关,当在 ICU 入院时测量时,与死亡率、ICU 和呼吸机使用天数相关,并降低了出院回家的可能性 [3-6]。因此,在 ICU 入院时识别肌肉质量低于正常的患者可能提供 “营养风险” 个体的替代指标,这些个体可能从危重疾病期间更强化的营养治疗中获益。但是,如果尚未获得影像学检查结果(即计算机断层扫描 [CT]),ICU 环境中的肌肉含量测量具有挑战性,因为通常不可能也不适合将重症患者转移至专门的机器进行身体组成评估(例如,双能 X 线吸收测量法),传统的床旁方法可能受到患者体位和液体转移的影响,这些在危重疾病中很常见。最近的一项研究比较了使用床旁肌肉方法评估的肌肉结构与作为 ICU 入院时参考方法的 CT 图像分析,证实了后者 (n = 50)[7]。该研究报告,手臂人体测量、主观身体评估和生物阻抗分析仅能检测到 28-38% CT 测量的肌肉含量低的参与者。然而,当对生物阻抗分析中的去脂质量变量应用水合过度的调整算法时,所有 CT 测量的肌肉含量低的参加者均被确定 (n = 6)。这强调了在进行任何床旁肌肉评估时考虑液体状态的重要性 [8]。在相同的患者队列中,超声测量的肌肉含量(上臂中部和大腿)显示出良好的能力来识别 CT 测量的肌肉含量低的患者(曲线下面积 0.79),这一结果在其他危重患者人群中得到了类似的重复 [9&,10,11]。需要进行进一步研究,以确定在非重症患者中开发的使用床旁方法(例如,超声)诊断低肌肉浓度的阈值是否在 ICU 环境中具有适用性 [12]。在此之后,未来的研究应重点关注使用床旁肌肉评估测试方法确定的低肌肉含量患者对积极营养治疗干预的反应。
# 营养不良
营养不良定义为 “因缺乏或摄取营养而导致身体组成(去脂量减少)和体细胞量减少,从而导致身体和心理功能减弱以及疾病导致的临床预后受损的状态”[13]。营养不良的诊断涉及由经过培训的临床医生使用经验证的工具来评估和解释人体测量、体重和饮食史以及身体组成(重点是确定肌肉消耗)。对于通常无法提供饮食和体重史的卧床和镇静患者,在重症监护室进行营养评估可能具有挑战性。此外,如前所述,重症患者经常发生显著的液体转移,使得获得准确的干体重和床边肌肉浓度评估变得困难。
在获得进一步研究之前,实用方法是遵循欧洲肠外肠内营养学会的建议,考虑所有在 ICU 住院 > 48h 的高营养风险患者 [14]。这些患者应由经过培训的临床医生进行早期全面营养评估 - 确保在获得所有信息后诊断出营养不良,并制定适当的营养治疗计划(确保考虑到再喂养综合征的风险)。但是,重要的是要注意,在重症患者中很容易遗漏营养不良的诊断(尤其是存在肥胖的患者),并且应定期监测临床状况和营养充分性,以预防营养不良的进展或发生。这在单独提供口服营养和住院时间长的患者中尤为重要 [15&,16&,17]。表 1 突出了临床医生在 ICU 入院时进行营养评估时的注意事项。
# 期间的营养 - 我们知道什么以及我们想要做什么?
在 ICU 内,公认早期肠内营养优于延迟肠内营养,即使是低剂量 [18]。但是,除此以外,还显示了其他领域的微小差异,还有其他有待研究的较大证据差距(例如,危重病时所需的蛋白质量)。与其假设这意味着营养在危重病中并不重要,相反,应注意为什么可能是这种情况,仍存在许多差距。
# 为什么研究的干预措施可能没有产生差异
目前的研究重点关注危重疾病的早期阶段,这可能不是营养治疗对预后产生积极影响的阶段。国际临床营养指南首次将代谢阶段定义为急性早期(1-2 天)、急性晚期(3-7 天)和恢复期(> 7 天)[14]。在急性早期和晚期阶段(此时大部分研究已完成),代谢仍处于适应性应激状态,在此阶段重点关注生存,并认为营养物质代谢受损 [19]。这并不是说这个时期的营养不重要;危重疾病期间的明显饥饿可能导致营养不良的长期后果并延长恢复时间 [19]。然而,代谢很可能从分解代谢转变为合成代谢,但检测到这种变化的能力不足,且可能具有高度个体化。由于危重疾病期间的代谢变化,在长期提供营养的情况下,在生物学上似乎可以合理地获得最大获益(本文后面列出的原因)。总体而言,已对异质性人群进行了研究;在患有相同疾病 / 疾病过程的个体和患者组中,营养风险和对营养的反应会有所不同。
- 表 1. 入住 ICU 时进行营养评估的考虑因素。a
| 主题 | 临床医生需要考虑的问题 |
|---|---|
| 体重和身高 | ・医疗记录中是否有此信息(例如,近期住院)和 / 或可由患者、家人和 / 或社区医生提供? |
| ・患者可以称重吗?如果是,患者是否水肿 - 他们估计的干体重是多少? | |
| ・我需要估计体重吗?如果是,与患者和 / 或其家人确认,并尽快称重。 | |
| ・身高 - 如果不可用,我可以使用尺骨长度还是头对趾测量? | |
| 体重指数 (BMI,kg/m2) | ・患者是否处于健康体重范围内 范围(针对年龄和种族)? |
| 体重和饮食史 | ・医疗记录(如,近期住院)中是否有此信息可用和 / 或可由患者、家人和 / 或社区医生提供? |
| ・患者最近体重明显减轻(> 5% 体重)? | |
| ・入院前是否存在营养摄入的明显障碍(例如,单独生活、老年人、牙列不齐、胃肠道症状、食物不安全、酒精和 / 或药物滥用)? | |
| 身体评估 | ・完成从头到脚的身体评估。是否有肌肉萎缩的迹象? |
| ・我是否可以客观地评估肌肉耗竭(例如,生物阻抗分析 b、手臂人体测量 b、第三腰椎区域计算机断层扫描)? | |
| 合并症 | ・患者是否有任何可能影响营养状态的合并症(例如,吸收障碍、糖尿病、癌症、慢性阻塞性疾病、慢性疾病、进食障碍)? |
a 表预期与经验证的营养不良诊断工具一起使用。
b 如果怀疑液体超负荷,则不应使用这些方法。
# 我们要去哪里?
现在注意力转向 ICU 中的其他重点小组,而不仅仅是机械通气组。越来越多地使用非侵入性通气模式,由于在插管时需要禁食或经口和肠内喂养的实际困难以及该领域的研究退出有限,导致营养供应出现问题 [20]。此外,在 ICU 内经口进食的患者中营养充分性较差的证据持续出现。经口进食的患者可能仅有较短的住院时间和较低的疾病严重程度,营养治疗不充分对临床状况的影响可能极小。然而,并非所有患者均是如此。现在必须了解住院期间长期饥饿和口服途径摄入不充分对营养不良和其他以患者为中心的重要预后的影响。
缺乏个体化和个体化营养也可能是试验未显示差异的原因。对于那些在临床营养学领域工作的人,我们继续处方我们的主要疗法(营养),却没有任何准确的指标,这是令人担忧的。与间接测热法的金标准相比,预测方程估计值反复显示不准确,但由于缺乏专业知识和经验,其与现代医疗的结合仍较差。在其他重症监护领域,对患者的生理参数进行密切监测,并将治疗滴定至实际测量值(例如平均动脉压),但并非为了补充营养,这似乎并不常见。荟萃分析或小型研究显示出有希望的改善,这些研究试图以更个体化和个性化的方法提供营养,包括使用血糖控制 EN 改善血糖控制和降低胰岛素的使用,尝试使用代谢组学根据能量输送发现代谢特征的差异,结合高蛋白质摄入和早期运动对功能预后的影响,研究 β- 羟基 -β- 甲基丁酸与安慰剂相比的情况,并减少肌肉萎缩 [21-25]。虽然尚未提供明确的答案,但这项工作表明,正在更多地考虑个体化和个体化营养可能对特定患者有益。
# 重症监护室后阶段的营养
因此,虽然标准治疗营养供应可能适合入院后 5-7 天,但应考虑整个住院期间营养的影响,目前几项工作显示了口服营养的问题(危重病后期的主要营养模式)。在混合 ICU 住院 > 3 天的 289 名成人子集中,口服营养摄入量分别为 9.7 (5.8-19) kcal/kg/d 和 0.35 (0.17-0.57) g/kg/d 蛋白质,在住院 > 7 天的 37 名患者中,51% 和 94% 从未接受 > 80% 的能量和蛋白质目标 [15&]。在第二项研究中,对 19 例成人患者拔管后 14 天的进食情况进行了分析,包括进食障碍,与处方相比,消耗的蛋白质和能量的中位数分别仅为 27%(IQR,15-41) 和 47%(IQR,29-66),最常报告的进食障碍为食欲不振、早饱和味觉改变 [16&]。
在此期间,充分营养供应面临许多挑战,之前曾被描述为服务、患者和临床 [17]。需要进一步开展工作,以了解这些障碍是什么,以及我们如何克服这些障碍,正在进行范围审查,以尝试了解这些障碍 [26]。表 2 概述了一些已确定的问题。
研究表明,持续人工营养可桥接营养间隙,近期一项非重症患者荟萃分析发现,接受营养干预的营养不良患者的死亡率显著降低,且这种降低的主要预测因素之一是干预的持续时间较长 [27]。尚未研究长期营养干预对临床预后的影响,仍然是危重症中最大的证据缺口之一。然而,目前正在进行的首项试验将很快完成招募 [28&&]。
表 2. ICU 后期营养摄入的问题和障碍 [17]
| 问题 | 示例 |
|---|---|
| 患者因素 | ・食欲和味觉改变・胃肠功能紊乱(例如腹泻、便秘)・吞咽功能(例如吞咽困难)・身体功能(例如疲劳、无力感)・心理社会(例如谵妄、情绪低落) |
| 临床医生因素 | ・过渡期护理(例如,没有从 ICU 转到病房营养师)・移除饲管・病房护理(例如,护士与患者比率增加的竞争工作,提供喂养帮助的时间) |
| 系统因素 | ・餐饮服务(如提供大餐,所有时间都无法获得食物) |
# 结论
不应在孤立的时间段内观察危重患者的营养情况;在 ICU 之前、期间和之后发生的情况可能对总体康复轨迹很重要。在特定人群中研究住院期间的营养及其对临床和功能性预后的影响,并以生物学上合理影响的方式使用干预措施至关重要。显示出对未来重症监护营养有希望的事情包括更长时间的营养干预、重点为口服营养支持的干预、个体化营养方案和使用新的床旁身体组成技术。
# REFERENCES
DETAILS
Heyland DK, Dhaliwal R, Jiang X, Day AG. Identifying critically ill patients who benefit the most from nutrition therapy: the development and initial validation of a novel risk assessment tool. Crit Care 2011; 15:R268.
Cattani A, Eckert IC, Brito JE, et al. Nutritional risk in critically ill patients: how it is assessed, its prevalence and prognostic value: a systematic review. Nutr Rev 2020; 78:1052-1068.
Jaitovich A, Dumas CL, Itty R, et al. ICU admission body composition: skeletal muscle, bone, and fat effects on mortality and disability at hospital discharge-a prospective, cohort study. Critical Care 2020; 24:566.
Ng CC, Lee ZY, Chan WY, et al. Low muscularity as assessed by abdominal computed tomography on intensive care unit admission is associated with mortality in a critically ill Asian population. J Parenter Enteral Nutr 2020; 44:425-433.
Fuchs G, Thevathasan T, Chretien YR, et al. Lumbar skeletal muscle index derived from routine computed tomography exams predict adverse postextubation outcomes in critically ill patients. J Crit Care 2018; 44:117-123.
Weijs PJ, Looijaard WG, Dekker IM, et al. Low skeletal muscle area is a risk factor for mortality in mechanically ventilated critically ill patients. Crit Care 2014; 18:R12.
Lambell KJ, Earthman CP, Tierney AC, et al. How does muscularity assessed by bedside methods compare to computed tomography muscle area at intensive care unit admission? A pilot prospective cross-sectional study. J Hum Nutr Diet 2021; 34:345-355.
Earthman CP. Body composition tools for assessment of adult malnutrition at the bedside: a tutorial on research considerations and clinical applications. J Parenter Enteral Nutr 2015; 39:787-822.
9[■][■]. Lambell KJ, Tierney AC, Wang JC, et al. Comparison of ultrasound-derived muscle thickness with computed tomography muscle cross-sectional area on admission to the intensive care unit: a pilot cross-sectional study. J Parenter Enteral Nutr 2021; 45:136-145.
An observational study in critically ill patients which compared muscularity measured by bedside ultrasound and a reference method (CT imaging) at ICU admission. This study demonstrated that ultrasound-measured muscle thickness (at both the upper and lower limbs) was 1) highly correlated with CT-measured muscularity and 2) had good ability to identify patients with low muscle mass at ICU admission.
Arai Y, Nakanishi N, Ono Y, et al. Ultrasound assessment of muscle mass has potential to identify patients with low muscularity at intensive care unit admission: a retrospective study. Clin Nutr ESPEN 2021; 45:177-183.
Fetterplace K, Corlette L, Abdelhamid YA, et al. Assessment of muscle mass using ultrasound with minimal versus maximal pressure compared with computed tomography in critically ill adult patients. Aust Crit Care 2021; 34:303-310.
Paris MT, Lafleur B, Dubin JA, Mourtzakis M. Development of a bedside viable ultrasound protocol to quantify appendicular lean tissue mass. J Cachexia Sarcopenia Muscle 2017; 8:713-726.
Sobotka L, ed. Basics in Clinical Nutrition, 4th edn. Czech Republic: Publishing House Galen; 2011.
Singer P, Blaser AR, Berger MM, et al. ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr 2019; 38:48-79.
15[■]. Rougier L, Preiser J-C, Fadeur M, et al. Nutrition during critical care: an audit on actual energy and protein intakes. J Parenter Enteral Nutr 2021; 45:951-960.
A key observational study highlighting that energy and protein intake of critically ill patients consuming an oral diet is suboptimal.
16[■]. Moisey LL, Pikul J, Keller H, et al. Adequacy of protein and energy intake in critically ill adults following liberation from mechanical ventilation is dependent on route of nutrition delivery. Nutr Clin Pract 2021; 36:201-212.
This study identified that energy and protein intake is suboptimal following liberation from mechanical ventilation and provided data on reported barriers to meeting nutritional requirements.
Ridley EJ, Chapple LS, Chapman MJ. Nutrition intake in the post-ICU hospitalization period. Curr Opin Clin Nutr Metab Care 2020; 23:111-115.
Rupert AA, Seres DS, Li J, et al. Factors associated with delayed enteral nutrition in the intensive care unit: a propensity score-matched retrospective cohort study. Am J Clin Nutr 2021; 114:295-302.
Tatucu-Babet OA, Ridley EJ. How much underfeeding can the critically ill adult patient tolerate? J Intens Med 2022; 2:69-77.
Viner Smith E, Ridley EJ, Rayner CK, Chapple L-aS. Nutrition management for critically ill adult patients requiring non-invasive ventilation: a scoping review. Nutrients 2022; 14:1446.
Gonzalez-Granda A, Seethaler B, Haap M, et al. Effect of an intensified individual nutrition therapy on serum metabolites in critically ill patients - A targeted metabolomics analysis of the ONCA study. Clin Nutr ESPEN 2021; 43:267-275.
de Azevedo JRA, Lima HCM, Frota PHDB, et al. High-protein intake and early exercise in adult intensive care patients: a prospective, randomized controlled trial to evaluate the impact on functional outcomes. BMC Anesthesiol 2021; 21:283.
Viana MV, Becce F, Pantet O, et al. Impact of [beta]-hydroxy-[beta]-methylbutyrate (HMB) on muscle loss and protein metabolism in critically ill patients: a RCT. Clin Nutr 2021; 40:4878-4887.
Eckert I, Kumbier MCC, Silva FM, et al. Association of specialized enteral nutrition with glycemic control and clinical outcomes in critically ill patients: a meta-analysis of randomized controlled trials. Clin Nutr 2021; 40:3940-3949.
Lee ZY, Yap CSL, Hasan MS, et al. The effect of higher versus lower protein delivery in critically ill patients: a systematic review and meta-analysis of randomized controlled trials. Crit Care 2021; 25:260.
Amon JN, Ferguson C, Tatucu-Babet OA, et al. Barriers and facilitators to oral nutrition intake in hospitalised adult patients following critical illness: a scoping review protocol. Clin Nutr ESPEN 2022; 47:399-404.
Kaegi-Braun N, Faessli M, Kilchoer F, et al. Nutritional trials using high protein strategies and long duration of support show strongest clinical effects on mortality.: Results of an updated systematic review and meta-analysis. Clin Nutr ESPEN 2021; 45:45-54.
28[■][■]. Ridley EJ, Bailey M, Chapman M, et al. Protocol summary and statistical analysis plan for Intensive Nutrition Therapy comparEd to usual care iN criTically ill adults (INTENT): a phase II randomised controlled trial. BMJ Open 2022; 12:e050153.
# 儿童重症营养的挑战与进展
综述目的
营养不良在重症儿童中仍很普遍,并且与较差的临床预后相关。相反,提供营养与改善生存率相关。必须解决营养挑战,以指导危重儿童的最佳营养实践。在本叙述性综述中,我们总结了 2020 年 7 月至 2022 年 1 月期间发表的关于危重儿童营养的研究结果。这些文章的结果以之前的工作为基础,指导本队列研究和临床实践的后续步骤。
近期结果
进行了全面的文献综述。我们确定了 2020 年 7 月至 2022 年 1 月期间发表的研究的以下共同主题:代谢、肠内营养,包括时间、剂量、特殊人群的蛋白质处方和递送、胃肠功能和肠内营养辅助治疗。
总结
研究继续支持肠内营养的早期启动和进步。实现营养充分性具有挑战性,但与肠内营养的时间和剂量、肠内营养输送的替代方法和辅助药物使用相关的研究正在扩展我们对该队列最佳实践的理解。进一步研究的领域仍然是使用测量的能量需求、蛋白质剂量和纳入功能性预后,以评估营养干预的获益。
关键词
危重症、肠内营养、胃肠、儿科
# 要点
・间接测热法仍然是测量危重儿童静息时能量消耗的金标准;但是,继续探索评价能量消耗的新方法。
・对于适合肠内营养的危重儿童,应鼓励早期开始肠内营养,并在入院第一周内达到 60% 的估计能量和蛋白质需求量;但是,需要进一步研究最佳蛋白质剂量。
・胃肠道功能障碍和肠内营养不耐受继续限制最佳营养输送,需要可靠的定义和生物标志物来识别胃肠道功能障碍。
・肠内营养的替代模式,例如及时放置后的间歇胃喂养或幽门后管喂养,可以实现更大的肠内营养目标。
・在被视为肠内营养高风险人群(如需要无创通气、先天性心脏病和体外膜肺氧合的患者)中,一旦达到血流动力学稳定,肠内营养可能安全且耐受良好。
# 引言
总体而言,16-20% 的重症儿童在入院时存在营养不良,14% 存在肥胖 [1&,2]。营养不良,无论是营养不良还是肥胖,都与较差的临床预后相关,包括死亡率、感染率和机械通气持续时间增加 [3,4]。相反,提供营养与改善生存率相关 [1&,5]。因此,营养评估和提供是为危重儿童提供集束化护理的关键方面。在本叙述性综述中,我们根据 2020 年 6 月至 2022 年 1 月发表的研究,重点关注重症儿童的营养进展。表 1 总结了文献检索策略。我们确定了代谢、肠内营养(包括在特殊人群中的时间、给药、蛋白质处方和递送、胃肠道功能和肠内营养辅助)主题研究的优势。
# 代谢和代谢监测
危重疾病期间的急性应激会导致影响碳水化合物、脂质和蛋白质代谢的复杂适应性反应 [6]。炎症级联反应、下丘脑 - 垂体轴和肾素 - 血管紧张素 - 醛固酮系统的激活也影响能量利用。最近的一项先导性干预试验研究了接受心肺转流术修复先天性心脏病 (CHD) 的儿童在快速推进喂养时细胞因子水平的变化 [7]。研究者测量了整个围手术期的炎症标志物,发现细胞因子水平的模式没有差异,但是快速喂养组获得了比标准喂养组更高的肠内营养体积和热量摄入,表明肠内营养推进的耐受性,没有改变旁路移植术后的炎症反应。
机械通气和镇静药物等现代疗法可能会改变这种适应性反应和儿科患者的能量消耗,使得难以估计能量处方。在一个单中心韩国儿科 ICU (PICU) 的 95 名机械通气儿童队列中,与相同队列中通过间接测热法测量的能量消耗相比,发现通过常用预测方程估计的能量消耗是可变的并且不准确 [8]。最近的研究与现有文献中估计能量消耗的预测方程不准确一致。间接测热法仍然是准确测量静息能量消耗的推荐金标准,以指导能量处方 [9]。该技术使用现代机械通气机的实测耗氧量 (VO2) 和二氧化碳消除 (VCO2),使用改良的 Weir 方程确定热量需求 [10]。目前的指南建议对疑似代谢减退或代谢亢进的患者进行评价,如有神经或肿瘤诊断的患者 [9]。但是,鉴于目前在大量患者中使用间接测热法的适用性有限,探索测量能量消耗的新方法仍是一个高度优先的问题 [10,11]。
# 肠内营养
肠内营养是重症儿童推荐和首选的营养模式,因为它比肠外营养 (PN) 更具生理性,并直接有益于肠道健康和功能。事实上,一项纵向国际多中心观察性研究发现,大多数 (1630/1844,88%) 重症儿童在 ICU 住院期间接受了肠内营养,与近 10 年前的首次报告相比,这一比例增加 [1&&,5]。然而,有关儿科危重症患者肠内营养给药的许多问题仍然存在,如给药时间、最佳途径(胃或幽门后)或给药方式(间歇或连续)。
| 表 1. 检索策略总结 | |||
|---|---|---|---|
| 术语(MeSH 和非 MeSH,如适用) | 搜索引擎 | 时间框架 | 方法 |
| 年龄相关:青少年、儿童、婴儿、儿科、新生儿、青少年,营养相关:肠内营养、肠外营养、胃肠道疾病 / 疾病 / 功能障碍 / 障碍、消化系统、胃肠道吸收、代谢、间接测热法、营养相关危重症:重症监护、重症护理、危重症、ICU、NICU、CICU、PICU、危重症、危重症疾病 | PubMedWeb of Science | 2020 年 6 月 1 日至 2022 年 1 月 31 日 | 作者审查了所有标题和摘要,确认其为原始研究、系统审查或营养主题内的荟萃分析,包括符合入选标准的儿科重症患者文章,如果注意到复发主题或如果文章涉及营养研究的新领域,则进行审查并纳入 |
CICU,心脏 ICU;MeSH,医学主题词;NICU,新生儿 ICU;PICU,儿科 ICU。
# 时间和大量营养素处方
重症医学协会 / 美国肠外肠内营养学会指南建议有功能性胃肠道的患者应尽早开始肠内营养,即入院后 24-48h [9]。该建议基于显示早期肠内营养启动耐受性的多项观察性研究以及与临床预后的相关性,包括生存期改善 [12]。成人研究已检查了危重症患者早期喂养阶段的最佳主要营养素摄入,但对危重症儿童的了解较少 [13]。一项大型回顾性队列研究表明,入院 48h 内接受超过 25% 的估计能量需求与生存率改善相关 [12]。一项国际、多中心、观察性纵向研究显示,达到 60-67% 的估计能量需求也与生存率改善相关 [1&&,5]。最近,他们报告,与 7 天内未达到 60% 营养目标的患者相比,入院前 7 天内达到 60% 估计能量需求的患者死亡率降低 68%[1&&](图 1)。这些研究表明,对于适合肠内营养的重症儿童,应鼓励在入院前 48h 内开始肠内营养,并在入院第 1 周内达到估计能量需求的 60%。
在蛋白质分解增加以允许应激反应期间循环氨基酸的情况下,预期危重疾病期间蛋白质的需求更高。给予危重儿童 60% 的蛋白质需求量估计值与预后改善相关,包括生存率 [14]。实现蛋白质充足仍然是营养输送最具挑战性的方面之一 [15]。在一项前瞻性观察性队列研究中,呼吸衰竭重症儿童的中位蛋白质充分性为 56%,中位蛋白质摄入量为 0.84 g/kg/d。尽管该蛋白质摄入量高于近期发表的其他队列,但仍低于当前推荐的蛋白质需求量 1.5 g/kg/d [15]。因此,尚不清楚可以安全输送并将改善患者预后的最佳蛋白质量。正在进行的干预性试验将研究在危重儿童中补充蛋白质的可行性(临床 Trials.gov 识别码:NCT05296096)[16]。

图 1. 危重儿童中与达到 60% 或更高能量和蛋白质充足相关的死亡率预后。在一项国际、多中心研究中,1844 例重症儿童在进入 ICU 7 天内通过肠内营养和 / 或肠内营养和肠外营养达到 60% 或更高的能量和蛋白质与显著改善的生存率相关。经许可复制 [1&&]。
图 2. 危重症中胃肠功能障碍的机制和替代治疗概述。专家组 (a) 描述了对导致危重儿童胃肠功能障碍机制的当前证据的图示概述。专家组 (b) 描述了近期研究探索的克服危重儿童胃肠功能障碍的两种替代策略。创建人 BioRender.com.
# 胃肠功能障碍:诊断和替代肠内营养方法
总体而言,肠内营养给药可能具有挑战性。全球多学科综合治疗者调查确定肠内营养中断为最佳肠内营养输送的常见障碍 [17]。在一项营养实践的国际、多中心前瞻性队列中,69% 的患者有一次或一次以上肠内营养中断,平均中断 2 天,持续 8h / 天 [1&&]。治疗中断可能是由于程序(不可避免),但也可能是肠内营养不耐受(可能是肠内营养中断的一个可改变的原因)。因此,近年来对小儿危重症肠内营养的研究主要集中在胃肠功能和定义,以及检查肠内营养的最佳途径和方法。图 2 总结了对胃肠功能障碍潜在机制的当前理解和本节中讨论的克服胃肠功能障碍的一些替代方法。
40-80% 的重症儿童报告了胃肠功能障碍 [18-20]。在危重成人中,工作组提出了评估胃肠功能的共识定义 [21,22]。这些定义与临床预后相关,包括死亡率。在 PePANIC 试验的次要分析中,接受肠内营养的患者最常报告的胃肠道症状为呕吐、腹泻、大量胃残留量 (GRV) 和腹胀 [2]。最近,儿科器官功能障碍信息更新授权小组考虑了定义儿科危重症胃肠功能障碍的标准,并指出了有限的研究和该领域经验证的生物标志物。虽然喂养不耐受、肠梗阻和胃肠道出血被认为是胃肠功能障碍的标志物,但作者最后仅在将胃肠功能障碍定义为穿孔、肠壁积气或直肠粘膜脱落证实的肠缺血方面达成共识 [23]。然而,目前正在对儿科重症疾病中胃肠功能障碍的潜在机制和生物标志物进行临床转化研究,并将指导未来的诊断和治疗选择 [24,25]。这种定义和诊断工具的开发是关键,因为儿科危重症中胃肠道症状的报告增加,特别是在 COVID-19 流行的情况下,胃肠道症状的存在与儿童入住 ICU 的可能性更大相关 [26,27]。
克服胃肠道功能障碍的潜在替代方法的研究也已取得进展。间歇性胃肠内营养已被提出作为一种促进危重病患者获得最佳胃肠功能的方法,因为它更符合生理要求,应能刺激健康的肠内分泌信号传导,并允许空腹代谢过程如突触融合 [28-30]。很少有研究在重症儿童中对间歇性喂养与连续喂养进行比较。来自一项小型随机对照试验 (RCT) 的两份报告,持续进食患者的胃肠道症状(呕吐和腹泻)和 GRV 高于间歇进食患者 [31,32]。近期一项更大型的多中心 RCT(每个研究组包括 70 例患者)报告,与持续进食患者相比,间歇进食患者在 2h 内更早达到肠内营养目标,且达到能量和蛋白质目标的比例高 20%[33&]。这些 RCT 受到样本量小和临床预后差异的限制。但是,他们认为间歇喂养可能是可行的,在一项单中心研究中,在测试推注喂养后使用 GRV 来指导肠内营养输送的方法也证实了这一点。作者报告连续鼻饲饮食的使用率从 66% 降至 2-3%[34]。
解决胃肠功能障碍的另一种常见替代方法是幽门后喂养。在成人和儿童研究中,在危重病患者中检查幽门后与胃喂养相比,报告了更高的肠内营养输送 [35,36]。但是,也报告了幽门管置入困难,这可能延迟肠内营养的开始。因此,近期研究重点关注有效和及时放置幽门后管 [35-37]。首次尝试使用盲法床旁置入、电磁引导和 pH 引导装置置入幽门后管的成功率各不相同,一些研究报告这些技术中任何一种的成功率大于 80%[38-40]。目前,床旁超声也被用于幽门后管置入,重症儿童中的成功率为 87%-94%,使得超声成为一种有前景的幽门后管及时置入工具 [41,42]。但是,一项系统性审查发现,置管成功的最大促成因素是操作者的经验,无论技术如何,因此教育和培训在 PICU 中早期和成功放置幽门后饲管最关键 [43&]。
# 需要体外支持的患者的肠内营养
体外膜肺氧合 (ECMO) 治疗严重疾病通常被认为是心肺休息,但通常不会导致代谢休息。事实上,需要 ECMO 支持的患者通常存在长期分解代谢状态,导致瘦肌肉质量损失和总体负氮平衡 [44]。一旦达到血流动力学稳定,肠内喂养仍然是能量输送的首选方法,但是鉴于对肠缺血和坏死性小肠结肠炎 (NEC) 的担忧,必须对儿童进行密切监测 [44]。在最近的一项关于接受 ECMO 的儿童营养实践的单中心描述性研究中,35%(8/23) 的患者接受了全胃肠外营养,ECMO 第 5 天达到的中位 85% 热量目标,未报告重大胃肠道并发症 [45]。第二项回顾性研究的作者描述了 100 例(93% 心脏)需要 ECMO 的患者的结果,以评价肠内营养的安全性。在该队列中,64% 的患者接受了肠内营养,34% 的患者仅接受肠内营养,在平均 33.8h 内达到了 92% 的平均计算能量目标 [46]。至开始肠内营养的平均时间为 46.5h,表明在大多数 PN 补充患者中达到了能量目标。然而,接受肠内营养和 PN 的患者在胃肠道并发症方面无统计学显著性差异。这些近期研究继续支持现有文献,在需要 ECMO 治疗的患者中,应考虑将早期肠内营养作为能量输送的首选模式,如果未达到能量和蛋白质目标,应考虑 PN 补充,并且必须提供仔细的胃肠道监测。
# 肠内营养和无创正压通气
无创正压通气 (NIPPV) 是 ICU 常用的呼吸支持模式,但临床医生担心误吸风险通常会让接受这种形式支持的患者暂停或延迟肠内营养 [47-49]。越来越多的观察性和回顾性研究对接受 NIPPV 的危重儿童的肠内营养输送进行了检查,包括高流量鼻插管。在毛细支气管炎患儿中,一项研究中 90% 的患者在入院 48h 内开始经鼻肠管、母乳喂养或经口给予肠内营养,另一项研究中 71% 的患者在入院 24h 内开始经鼻肠管、母乳喂养或经口给予肠内营养 [50,51]。需要 NIPPV 的毛细支气管炎儿童开始肠内营养与心率和呼吸频率改善相关 [50,52]。一项欧洲多中心研究检查了由于各种急性呼吸衰竭基础原因接受 NIPPV 的重症儿童的肠内营养实践 [53]。他们发现,开始 NIPPV 后平均 4h 开始给予肠内营养,与胃管相比,通过幽门后管喂食实现了更大的能量输送,在胃管喂食的患者中,当连续喂食与间歇喂食相比 [53]。这些研究中报告的穿刺率较低 (< 1.5%)[50,51,53]。这些研究表明肠内营养可能对某些接受 NIPPV 的患者可行,但未来的研究应考虑确定从该策略中获益最大的患者队列的选择标准,而不增加肠内营养和 / 或吸入延迟启动或进展继发的风险或对患者的伤害。
# 先天性心脏病患者肠内营养
CHD 重症儿童是一个需要仔细评估能量处方的人群。基线时,该人群中既存的营养不良很常见 [54]。由于生理学改变,能量需求通常较高,导致持续性代谢能量消耗较高。接受心脏手术的儿童也可能存在血流受限、液体限制和频繁肠内营养中断 [55]。已对能量和蛋白质密集的肠内喂养进行了研究,临床上用于满足增加的代谢需求。最近的一项荟萃分析对该主题进行了研究和总结,以确定能量密集的肠内喂养与标准喂养对患者预后的影响 [56&]。从本分析中纳入的 RCT 来看,平均能量和蛋白质摄入量以及体重增加均有所增加,接受高能量肠内营养的患者未报告不良事件。该荟萃分析表明,能量密集肠内喂养是可行的,但进一步临床试验应评估可测量临床预后的改善,如缩短住院时间和改善长期功能和神经发育预后。
# 辅助用药 - 预防应激性溃疡
包括组胺 2 受体拮抗剂 (H2RA) 和质子泵抑制剂 (PPI) 在内的药物通常用于保护胃肠道在危重疾病期间免受粘膜损伤 [57&&],并降低可能因应激相关溃疡导致的胃肠道出血风险 [58]。加拿大 PICU 中的一项大型多中心观察性研究和一项单独的国际观察性研究均报告 70% 的患者接受了应激性溃疡预防 (SUP) 治疗 [1&&,57&&]。在加拿大研究中,H2RA 的 SUP 使用率分布为 66%,PPI 为 47%,接受 SUP 的患者年龄较大,接受的肠内营养较少,接受的糖皮质激素或非甾体抗炎药物较多 [57&&]。然而,儿童中临床显著性胃肠道出血的发生率仍然较低 [58],并且存在 SUP 给药的潜在危害风险,如 NEC、艰难梭菌感染或医院获得性肺炎 [59,60]。一项包括接受全身性糖皮质激素治疗哮喘持续状态患者的单中心回顾性队列研究未报告胃肠道出血 [61]。一项关于 SUP 给药的系统回顾未观察到 SUP 给药和无预防治疗之间胃肠道出血率的显著差异 [62]。17 项观察性研究的荟萃分析也报告 SUP 与未给予 SUP 之间胃肠道出血风险无差异 [63]。但是,在这项荟萃分析中,发现接受 SUP 的患者发生医院内肺炎的风险增加。假定 SUP 患者可能发生医院获得性肺炎,因为 SUP 会增加胃内 pH 值。一项单中心前瞻性队列研究采用 24h 食管 pH 监测评价了机械通气儿童胃食管反流 (GER) 的患病率和呼吸机相关性肺炎 (VAP) 的发生率。他们发现酸性 GER 儿童的 VAP 发生率下降,虽然这没有统计学意义 [64]。迄今为止的研究表明,处方这些药物存在潜在危害,但未显示预后的明确获益。但是,这些研究受到其观察性设计和低质量证据的限制,但是正在进行的 RCT 可能在未来提供更多关于该领域的数据 [65]。此外,缺乏何时中止 SUP 的指南。
# 结论
为重症儿童提供最佳的能量和蛋白质处方可改善预后,但仍存在挑战。近期研究继续支持肠内营养的启动和进步,即使是在既往认为禁忌使用肠内营养的复杂患者人群中。研究肠内营养的能量消耗、时间和剂量的准确测量,以及优化肠内营养的新策略,扩大了我们对这一脆弱队列最佳营养实践的理解。进一步研究的领域继续是使用间接测热法测量能量需求,并纳入功能预后以评估超出充分能量或蛋白质输送的营养干预获益。
# REFERENCES
DETAILS
1[■][■]. Bechard LJ, Staffa SJ, Zurakowski D, Mehta NM. Time to achieve delivery of nutrition targets is associated with clinical outcomes in critically ill children. Am J Clin Nutr 2021; 114:1859-1867.
An international, multicenter prospective study, including 1800 critically ill children identified an association between achieving 60% of nutrition goal, with enteral and/or parenteral nutrition, and improved survival compared with patients requiring greater than 7 days to achieve 60% of nutrition goal.
Eveleens RD, Hulst JM, de Koning BAE, et al. Achieving enteral nutrition during the acute phase in critically ill children: associations with patient characteristics and clinical outcome. Clin Nutr 2021; 40:1911-1919.
Bechard LJ, Duggan C, Touger-Decker R, et al. Nutritional status based on body mass index is associated with morbidity and mortality in mechanically ventilated critically ill children in the PICU. Crit Care Med 2016; 44:1530-1537.
de Souza Menezes F, Leite HP, Koch Nogueira PC. Malnutrition as an independent predictor of clinical outcome in critically ill children. Nutrition 2012; 28:267-270.
Mehta NM, Bechard LJ, Cahill N, et al. Nutritional practices and their relationship to clinical outcomes in critically ill children - an international multicenter cohort study. Crit Care Med 2012; 40:2204-2211.
Albert BD, Spolidoro GC, Mehta NM. Metabolism and energy prescription in critically ill children. Minerva Anestesiol 2021; 87:1025-1033.
Floh AA, Herridge J, Fan CS, et al. Rapid advancement in enteral nutrition does not affect systemic inflammation and insulin homeostasis following pediatric cardiopulmonary bypass surgery. Pediatr Crit Care Med 2020; 21:e441-e448.
Jhang WK, Park SJ. Energy expenditure in mechanically ventilated korean children: single-center evaluation of a new estimation equation. Pediatr Crit Care Med 2020; 21:e522-e529.
Mehta NM, Skillman HE, Irving SY, et al. Guidelines for the provision and assessment of nutrition support therapy in the pediatric critically ill patient: society of critical care medicine and American Society for Parenteral and Enteral Nutrition. JPEN J Parenter Enteral Nutr 2017; 41:706-742.
Mehta NM, Smallwood CD, Joosten KF, et al. Accuracy of a simplified equation for energy expenditure based on bedside volumetric carbon dioxide elimination measurement - a two-center study. Clin Nutr 2015; 34:151-155.
Spolidoro GCI, D'Oria V, De Cosmi V, et al. Artificial neural network algorithms to predict resting energy expenditure in critically ill children. Nutrients 2021; 13:3797.
Mikhailov TA, Kuhn EM, Manzi J, et al. Early enteral nutrition is associated with lower mortality in critically ill children. JPEN J Parenter Enteral Nutr 2014; 38:459-466.
Rice TW, Mogan S, Hays MA, et al. Randomized trial of initial trophic versus full-energy enteral nutrition in mechanically ventilated patients with acute respiratory failure. Crit Care Med 2011; 39:967-974.
Mehta NM, Bechard LJ, Zurakowski D, et al. Adequate enteral protein intake is inversely associated with 60-d mortality in critically ill children: a multicenter, prospective, cohort study. Am J Clin Nutr 2015; 102:199-206.
Melro EC, de Souza Lima AE, Missagia de Mattos Springer A, et al. Protein intake deficiency in critically ill children with respiratory insufficiency: a call to action? Clin Nutr ESPEN 2020; 37:69-74.
Wong JJM, Ong JSM, Ong C, et al. Protein supplementation versus standard feeds in underweight critically ill children: a pilot dual-centre randomised controlled trial protocol. BMJ Open 2022; 12:e047907.
Tume LN, Eveleens RD, Verbruggen S, et al. Barriers to delivery of enteral nutrition in pediatric intensive care: a world survey. Pediatr Crit Care Med 2020; 21:e661-e671.
Typpo KV, Larmonier CB, Deschenes J, et al. Clinical characteristics associated with postoperative intestinal epithelial barrier dysfunction in children with congenital heart disease. Pediatr Crit Care Med 2015; 16:37-44.
Martinez EE, Pereira LM, Gura K, et al. Gastric emptying in critically ill children. JPEN J Parenter Enteral Nutr 2017; 41:1100-1109.
Eveleens RD, Joosten KFM, de Koning BAE, et al. Definitions, predictors and outcomes of feeding intolerance in critically ill children: a systematic review. Clin Nutr 2020; 39:685-693.
Reintam Blaser A, Malbrain ML, Starkopf J, et al. Gastrointestinal function in intensive care patients: terminology, definitions and management. Recommendations of the ESICM Working Group on Abdominal Problems. Intensive Care Med 2012; 38:384-394.
Reintam Blaser A, Padar M, Mandul M, et al. Development of the gastrointestinal dysfunction score (GIDS) for critically ill patients - a prospective multicenter observational study (iSOFA study). Clin Nutr 2021; 40:4932-4940.
Typpo KV, Irving SY, Prince JM, et al. Pediatric Organ Dysfunction Information Update Mandate Conference. Gastrointestinal dysfunction criteria in critically ill children: the PODIUM consensus conference. Pediatrics 2022; 149: (1 Suppl 1): S53-S58.
Martinez EE, Zurakowski D, Pereira L, et al. Interleukin-10 and zonulin are associated with postoperative delayed gastric emptying in critically ill surgical pediatric patients: a prospective pilot study. JPEN J Parenter Enteral Nutr 2020; 44:1407-1416.
Martinez EE, Lan J, Konno T, et al. Novel role of zonulin in the pathophysiology of gastro-duodenal transit: a clinical and translational study. Sci Rep 2021; 11:22462.
Lo Vecchio A, Garazzino S, Smarrazzo A, et al. Factors associated with severe gastrointestinal diagnoses in children with SARS-CoV-2 infection or multisystem inflammatory syndrome. JAMA Netw Open 2021; 4:e2139974.
Gonzalez Jimenez D, Velasco Rodriguez-Belvis M, Ferrer Gonzalez P, et al. COVID-19 gastrointestinal manifestations are independent predictors of PICU admission in hospitalized pediatric patients. Pediatr Infect Dis J 2020; 39:e459-e462.
Chowdhury AH, Murray K, Hoad CL, et al. Effects of bolus and continuous nasogastric feeding on gastric emptying, small bowel water content, superior mesenteric artery blood flow, and plasma hormone concentrations in healthy adults: a randomized crossover study. Ann Surg 2016; 263:450-457.
Wu T, Rayner CK, Young RL, Horowitz M. Gut motility and enteroendocrine secretion. Curr Opin Pharmacol 2013; 13:928-934.
Veldscholte K, Cramer ABG, Joosten KFM, Verbruggen S. Intermittent fasting in paediatric critical illness: the properties and potential beneficial effects of an overnight fast in the PICU. Clin Nutr 2021; 40:5122-5132.
Horn D, Chaboyer W. Gastric feeding in critically ill children: a randomized controlled trial. Am J Crit Care 2003; 12:461-468.
Horn D, Chaboyer W, Schluter PJ. Gastric residual volumes in critically ill paediatric patients: a comparison of feeding regimens. Aust Crit Care 2004; 17:98-100. 2-3.
33[■]. Brown AM, Irving SY, Pringle C, et al. Bolus gastric feeds improve nutrition delivery to mechanically ventilated pediatric medical patients: results of the COntinuous vs BOlus multicenter trial. JPEN J Parenter Enteral Nutr 2021; [Online ahead of print].
Randomized-controlled trial (RCT) evaluating enteral nutrition delivery between intermittently and continuously fed patients reported earlier and greater nutrition delivery in intermittently fed critically ill children. More RCTs in pediatric critical care nutrition are needed.
Knight DE, Larmour K, Wellman P, et al. Prospective evaluation of a novel enteral feeding guideline based on individual gastric emptying times: an improvement project in a pediatric intensive care unit. JPEN J Parenter Enteral Nutr 2021; 45:1720-1728.
Alkhawaja S, Martin C, Butler RJ, Gwadry-Sridhar F. Postpyloric versus gastric tube feeding for preventing pneumonia and improving nutritional outcomes in critically ill adults. Cochrane Database Syst Rev 2015; CD008875.
Meert KL, Daphtary KM, Metheny NA. Gastric vs small-bowel feeding in critically ill children receiving mechanical ventilation: a randomized controlled trial. Chest 2004; 126:872-878.
Kamat P, Favaloro-Sabatier J, Rogers K, Stockwell JA. Use of methylene blue spectrophotometry to detect subclinical aspiration in enterally fed intubated pediatric patients. Pediatr Crit Care Med 2008; 9:299-303.
Jha P, Rupp L, Bonilla L, et al. Electromagnetic versus blind guidance of a postpyloric feeding tube in critically ill children. Pediatrics 2020; 146:e20193773.
Krafte-Jacobs B, Persinger M, Carver J, et al. Rapid placement of transpyloric feeding tubes: a comparison of pH-assisted and standard insertion techniques in children. Pediatrics 1996; 98 (2 Pt 1):242-248.
Turner AD, Hamilton SM, Callif C, et al. Bedside postpyloric tube placement and enteral nutrition delivery in the pediatric intensive care unit. Nutr Clin Pract 2020; 35:299-305.
Hamadah HK, Elsaoudi ARF, Faraji MA, Kabbani MS. Ultrasound-guided postpyloric feeding tube insertion in peri-operative cardiac infants. Cardiol Young 2021; 1-4. [Online ahead of print].
Osawa I, Tsuboi N, Nozawa H, et al. Ultrasound-guided postpyloric feeding tube placement in critically ill pediatric patients. Pediatr Crit Care Med 2021; 22:e324-e328.
43[■]. Hawk H, Valdivia H. Bedside methods for transpyloric feeding tube insertion in hospitalized children: a systematic review of randomized and non-randomized trials. J Pediatr Nurs 2021; 60:238-246.
High success rates of transpyloric tube placement can be acomplished with multiple different techniques. Training and education are key in successful placement of transpyloric tube placement.
Jaksic T, Hull MA, Modi BP, et al. Clinical guidelines: nutrition support of neonates supported with extracorporeal membrane oxygenation. JPEN J Parenter Enteral Nutr 2010; 34:247-253.
Hofheinz SB, Nunez-Ramos R, German-Diaz M, et al. Which is the best route to achieve nutritional goals in pediatric ECMO patients? Nutrition 2022; 93:111497.
Perez G, Gonzalez E, Zamora L, et al. Early enteral nutrition and gastrointestinal complications in pediatric patients on extracorporeal membrane oxygenation. J Pediatr Gastroenterol Nutr 2022; 74:110-115.
Leroue MK, Good RJ, Skillman HE, Czaja AS. Enteral nutrition practices in critically ill children requiring noninvasive positive pressure ventilation. Pediatr Crit Care Med 2017; 18:1093-1098.
Canarie MF, Barry S, Carroll CL, et al. Risk factors for delayed enteral nutrition in critically ill children. Pediatr Crit Care Med 2015; 16:e283-e289.
Canning A, Fairhurst R, Chauhan M, Weir KA. Oral feeding for infants and children receiving nasal continuous positive airway pressure and high-flow nasal cannula respiratory supports: a survey of practice. Dysphagia 2020; 35:443-454.
Lenihan A, Ramos V, Nemec N, et al. A retrospective analysis of feeding practices and complications in patients with critical bronchiolitis on non-invasive respiratory support. Children (Basel) 2021; 8:410.
Walter S, DeLeon S, Walther JP, et al. The nutritional impact of a feeding protocol for infants on high flow nasal cannula therapy. Nutr Clin Pract 2022; [Online ahead of print].
Sochet AA, Nunez M, Wilsey MJ, et al. Enteral nutrition improves vital signs in children with bronchiolitis on noninvasive ventilation. Hosp Pediatr 2021; 11:135-143.
Tume LN, Eveleens RD, Mayordomo-Colunga J, et al. Enteral feeding of children on noninvasive respiratory support: a four-center european study. Pediatr Crit Care Med 2021; 22:e192-e202.
Toole BJ, Toole LE, Kyle UG, et al. Perioperative nutritional support and malnutrition in infants and children with congenital heart disease. Congenit Heart Dis 2014; 9:15-25.
Wong JJ, Cheifetz IM, Ong C, et al. Nutrition support for children undergoing congenital heart surgeries: a narrative review. World J Pediatr Congenit Heart Surg 2015; 6:443-454.
56[■]. Singal A, Sahu MK, Trilok Kumar G, Kumar A. Effect of energy- and/or protein-dense enteral feeding on postoperative outcomes of infant surgical patients with congenital cardiac disease: a systematic review and meta-analysis. Nutr Clin Pract 2021; [Online ahead of print].
A systematic review and meta-analysis evaluating enriched enteral nutrition in postoperative critically ill children and congenital heart disease. This review highlighted that enriched nutrition delivery is tolerated and improved clinical outcomes in this population.
57[■][■]. Duffett M, Chan A, Closs J, et al. Stress ulcer prophylaxis in critically ill children: a multicenter observational study. Pediatr Crit Care Med 2020; 21:e107-e113.
Multicenter, prospective observational trial in seven Canadian pediatric ICUs, including 378 children evaluating the practice of stress ulcer prophylaxis (SUP) prespcription. The authors found significant variability in SUP practice and low rates of gastrointestinal bleeding.
Shears M, Alhazzani W, Marshall JC, et al. Stress ulcer prophylaxis in critical illness: a Canadian survey. Can J Anaesth 2016; 63:718-724.
Terrin G, Passariello A, De Curtis M, et al. Ranitidine is associated with infections, necrotizing enterocolitis, and fatal outcome in newborns. Pediatrics 2012; 129:e40-e45.
Albert BD, Zurakowski D, Bechard LJ, et al. Enteral nutrition and acid-suppressive therapy in the PICU: impact on the risk of ventilator-associated pneumonia. Pediatr Crit Care Med 2016; 17:924-929.
Sochet AA, Son S, Ryan KS, et al. Stress ulcer prophylaxis in children with status asthmaticus receiving systemic corticosteroids: a descriptive study assessing frequency of clinically important bleeding. J Asthma 2020; 57:858-865.
Jensen MM, Marker S, Do HQ, et al. Prophylactic acid suppressants in children in the intensive care unit: a systematic review with meta-analysis and trial sequential analysis. Acta Anaesthesiol Scand 2021; 65:292-301.
Yao DWJ, Ong C, Eales NM, et al. Reassessing the use of proton pump inhibitors and histamine-2 antagonists in critically ill children: a systematic review and meta-analysis. J Pediatr 2021; 228:164-176.e7.
Gupta P, Sankar J, Kumar BK, et al. Twenty-four-hour esophageal ph measurement in mechanically ventilated children: a prospective cohort study. Pediatr Crit Care Med 2021; 22:e203-e212.
Mills KI, Albert BD, Bechard LJ, et al. Stress ulcer prophylaxis versus placebo-a blinded randomized control trial to evaluate the safety of two strategies in critically ill infants with congenital heart disease (SUPPRESS-CHD). Trials 2020; 21:590.
# 危重病后身体恢复不佳:发生率、特征、风险因素、病理生理学和循证治疗
综述目的
总结长期重症监护病房 (ICU) 获得性虚弱 (ICU-AW) 的发生率、特征、发病机制、风险因素和循证治疗。我们旨在提供危重病后身体恢复较差方面的更新概述。
近期结果
ICU 存活后新出现的身体问题,如肌无力、身体虚弱和运动能力下降,是重症监护后综合征患者最常遇到的局限性。残疾可能持续数月至数年,通常无法完全恢复。激素和线粒体紊乱、卫星细胞损伤导致的肌肉再生障碍和表观遗传差异可能参与了持续的 ICU-AW。虽然人口统计学和 ICU 治疗因素似乎对身体恢复至关重要,但 ICU 前的健康状况也很重要。目前尚无有效的治疗方法。ICU 中的早期活动可能改善出院时的身体预后,但无证据表明长期身体恢复可带来获益。
总结
在 ICU 存活者中经常观察到身体恢复受损。ICU 前健康状况、人口统计学和 ICU 治疗因素似乎是 ICU 后期身体康复的重要决定因素。对其中涉及的病理生理机制知之甚少,从而导致迄今为止令人费解的循证治疗策略。
关键词
危重病、重症监护室获得性无力、重症监护室、肌无力、康复
# 要点
・在重症监护后的患者中,经常会遇到新的身体问题,例如肌无力、身体虚弱和运动能力下降。
・损伤的卫星细胞、表观遗传差异以及激素和线粒体紊乱可能参与持续的 ICU-AW。
・除了人口统计学和 ICU 治疗因素外,预先存在的健康状况是 ICU 出院后身体恢复的重要决定因素。
・目前,对于疾病导致的肌肉无力持续时间较长的患者,尚无刺激肌肉恢复的治疗证据。然而,最近已经确定了几个潜在的治疗靶点。
# 引言
重症监护医学的显著发展提高了生存率,使得重症监护室 (ICU) 存活者增多 [1]。但是,作为 “重症监护后综合征”(PICS) 的一部分,存活的危重疾病可能会导致新的残疾,包括身体、心理和认知健康问题 [2]。
本综述重点关注危重疾病后的长期身体预后。入住 ICU 后的长期肌无力,也称为持续 ICU 获得性无力 (ICU-AW),经常观察到,包括危重症肌病 (CIM)、危重症多发性神经病 (CIP) 或组合 [3&,4&&]。通常,医学研究委员会 (MRC) 总分 < 48 即为 ICU-AW 的临床诊断 [5]。ICU 患者在 ICU 治疗的第一周内可损失 > 15% 的肌肉量 [6]。因此,肌肉质量和功能下降会损害进行工具性日常活动的能力,并限制恢复工作的机会 [7]。在严重病例中,有必要出院进入康复机构或疗养院。此外,在重度 ICU-AW(MRC - 总和 < 36)患者中,观察到入住 ICU 后 1 年内死亡率增加 [8]。
本综述对危重疾病后身体恢复较差的方面进行了更新,包括其发生率、特征、风险因素、病理生理学和循证疗法。
# 身体恢复不佳的发生率及其特征
在 ICU 存活者中经常遇到身体预后较差的情况(图 1)[9&]。CIP 以及 CIM 联合治疗的患病率在 ICU 出院后比单独 CIM 更常见 [3&]。仅 CIM 患者比 CIM 和 CIP 患者更容易恢复 [3&,10&]。Herridge 及其同事表明,在大多数急性呼吸应激综合征 (ARDS) 存活者中,ICU 出院后 5 年的运动能力仍低于预测性能 [11]。在另一项研究中,40% 的患者在 6 个月至 10 年随访期间报告了持续的 ICU-AW 症状 [10&]。值得注意的是,在 ICU 出院时,仅 38% 的 ICU-AW 患者恢复,62% 的 ICU-AW 患者症状持续。此外,队列中仅 11.6% 的患者在 ICU 出院时被医生诊断为 ICU-AW,而 75% 的患者自我报告在 ICU-AW 出院后出现了 ICU-AW 症状,这强调了治疗医生对 ICU-AW 认识的需求以及出院后随访期间充分的诊断程序 [10&]。
最近的一项系统综述发现,在 ICU 出院后,存活者的平均 6 min 步行距离试验 (6MWD) 仍低于人群标准 [12&&]。与 3 个月时相比,12 个月时观察到平均 6MWD 显著增加,但 12 个月与 60 个月之间无差异,表明在出院后 1 年时身体恢复停滞。
值得注意的是,既往研究未考虑既存损害的患病率。应考虑这些因素,以防止高估危重疾病对身体功能的影响 [13]。然而,并不总是评价 ICU 前的功能性能。很少有发表的研究对 ICU 出院后新发身体问题进行研究。
MONITOR-IC 研究的一项子研究得出结论,PICS 新的身体领域问题是 ICU 出院后 1 年报告的最常见症状,且存在于一半患者中 [4&]。尽管可能与物理 PICS 域以外的其他域相关,疲乏是最常报告的新症状。虚弱状态和肌无力是一年后最常见的身体症状 [4&&]。在另一项亚组研究中,ICU 后患者接受冠状病毒病治疗 2019 年 (COVID-19) 报告了相似的症状。三分之二的患者在 ICU 治疗后 1 年报告了 1 个或多个新发身体问题 [14&&]。Hodgson 及其同事还评价了重度 COVID-19 后的 ICU 患者 [15&]。总共 71.3% 的患者报告了持续症状,其中 38.9% 出现了新发残疾 [15&]。
# 冠状病毒病 2019 vs 非冠状病毒病 2019 例患者
COVID-19 ICU 患者比非 COVID-19 ICU 患者更易发生 ICU-AW,因为前者的机械通气时间和 ICU 停留时间更长 [14&&]。Moonen 等人报告称,COVID-19 ICU 存活者出院时的身体功能比非 COVID-19 ICU 存活者更有限 [16&]。但是,COVID-19 组和非 COVID-19 ICU 存活者相比,在住院期间肌肉功能改善更迅速,导致出院时的功能相似 [16&]。比较非 COVID-19 和 COVID-19 患者在离开 ICU 一年后新发身体残疾的发生率,后者更高。无需在早期恢复长期治疗 [4&&,14&&]。此外,在 COVID-19 ICU 存活者中,观察到握力 (HGS) 随时间显著改善,但 6MWD 无显著改善 [17&]。COVID-19 ICU 幸存者可能出现肺弥散功能受损,导致长期运动能力下降,而不是肌肉功能障碍 [15&,18]。尽管 COVID-19 的临床特征不同于经典的 ARDS,但 ARDS 患者在一段时间内的身体功能恢复比 ICU 后非 ARDS 患者差 [12&&]。尽管如此,86% 的 COVID-19 患者可以在 ICU 出院后 1 年恢复工作,显著高于经典 ARDS 存活患者 (40%)[17&]。

图 1. COVID-19 和非 COVID-19 患者中,ICU - 出院后身体功能受损的患病率和发生率的研究结果的直观总结。图例:a 包括 16 项研究和 1755 名 ICU 存活者的系统回顾和荟萃分析 [12&];b 包括 114 名 COVID-19 ICU 存活者的前瞻性单中心研究,其中 3 个月时 98 名患者接受分析,1 年时 51 名患者接受分析 [17&];c 包括 266 名 > 70 岁 ICU 存活者的前瞻性队列研究 [13];d 包括 212 名 COVID-19 ICU 存活者的前瞻性多中心队列研究 [15&];e 包括 546 名 > 70 岁 ICU 存活者的基于人群的队列研究 [33];f 包括 2345 名成人 ICU 存活者的前瞻性多中心队列研究 [4&];g 包括 301 名 COVID-19 ICU 存活者的前瞻性多中心队列研究,其中 1 年时 246 名患者接受分析 [14&];h 包括 149 名 ICU 存活者的单中心队列研究 [10&];i 单中心队列研究包括 109 名 ARDS ICU 存活者,其中 94 名在 5 年时进行分析 [11]。6MWD,6 分钟步行距离;ADL,日常生活活动;COVID-19,冠状病毒病 2019;ICU,重症监护室;ICU-AW,ICU 获得性无力;m6MWD,平均 6 分钟步行距离;mHGS,平均握力。创建人 BioRender.com.
# 病原体
肌肉力量下降和无力主要是肌肉蛋白合成和溶解之间不平衡的结果,导致显著的肌肉消耗并维持分解代谢状态 [6,19]。
# 急性期
一些涉及肌肉萎缩和功能障碍的潜在病理生理机制与 ICU-AW 的发生相关(图 2)。危重疾病期间的全身性炎症和氧化应激增强导致泛素蛋白水解作用途径上调和细胞增殖紊乱,从而引起快速和重度的肌肉蛋白水解作用 [19,20]。炎症和高血糖也会引起线粒体能力和功能丧失,影响能量产生,导致肌肉功能障碍和萎缩 [19-21]。此外,外周胰岛素抵抗、细胞内钙稳态紊乱、脂质毒性、肌肉误用、微循环障碍和细胞因子释放导致肌肉去神经支配均可导致重症患者发生肌无力 [1921]。最近,与对照组相比,在 ICU 患者的肌肉组织中发现两个甲基化程度较低的表观基因组区域,HIC1 和 NADK2 [22&]。HIC1 调节肌肉再生,缓和突触后乙酰胆碱受体的浓度,而 NADK2 参与脂肪脂质代谢和线粒体刺激 [22&]。
# 重症监护室后阶段
尽管危重病期间肌肉萎缩和功能障碍的病理生理学似乎已部分阐明,但导致离开 ICU 后身体恢复受损的持续性肌肉功能障碍的相关机制仍知之甚少(图 3)[20]。Dos Santos 及其同事报告,与急性危重症相关的肌肉萎缩相关的机制,即线粒体含量、肌肉蛋白水解增强和细胞色素沉着失调,在 ICU - 入院 6 个月后已恢复至基线水平 [23]。相反,持续的肌肉无力可解释为由于肌肉干细胞(众所周知的卫星细胞)数量减少导致的持续肌肉再生障碍 [23,24]。在危重疾病期间,这些细胞由于炎症而耗尽,并且在持续性肌无力患者中,尽管炎症已消退,但似乎再生较少,表明这些细胞的长期损伤 [23]。在老年个体和肌肉病理学患者中发现卫星细胞表观基因组的变化,降低了这些细胞的再生能力 [25]。这些改变的改变可能为维持 ICU-AW 提供未来的治疗靶点。

图 2. 标题:可能涉及危重疾病期间发生急性肌肉萎缩和功能障碍,导致 ICU 获得性虚弱的病理生理学机制。ATP,三磷酸腺苷;O2,氧气。创建人 BioRender.com.
值得注意的是,患持续性肌无力的危重疾病存活者的肌肉质量似乎恢复正常,而收缩性在 ICU 出院后数月仍受损,表明肌肉体积和力量之间不平衡 [23,26]。危重疾病期间的广泛炎症可导致肌肉结构的改变,用脂肪细胞替代肌肉组织或纤维化 [19,21]。在一个身体恢复较差的 ICU 后患者队列中,这种脂肪浸润持续了数月 [27]。在相同的样本中,肌肉 microRNA 490-mrt 和 microRNA-744-p(两者均为负性肌生成调节因子)增加,可能影响 ICU 存活者的长期肌无力 [28]。尽管这些发现可能代表了一些群体变异性,但肌肉 microRNA 调节可能作为防止肌肉再生失调的潜在治疗策略。
肌肉生长抑制素在肌肉骨骼肌肉萎缩中的作用最近受到关注 [6,29]。肌肉生长抑制素是一种肌生成负调节因子,与重症患者的炎症呈负相关,可能预防急性期的过度肌肉萎缩 [29]。有争议的是,在脓毒症小鼠模型中,完全抑制肌肉生长抑制素可防止肌肉萎缩并提高存活率,为减轻危重疾病诱导的肌肉萎缩提供了潜在的药理学靶点 [30&]。肌肉生长抑制素在发生严重热损伤后 912 个月上调,并与肌肉强度呈负相关 [31]。但是,这些结果需要在一般 ICU 后人群中进行确认。

图 3. 标题:可能涉及危重病后长期肌肉功能障碍的病理生理学机制。ATP,三磷酸腺苷;HIC1,癌症 1 中的高甲基化;NADK 2,烟酰胺腺嘌呤二核苷酸激酶 2;O2,氧气;PICS,重症监护后综合征。创建人 BioRender.com.
此外,持续肌无力患者的神经内分泌变化与身体恢复减少相关。发现危重疾病后 5 年,较高的反 T3 和较低的 T3 - 反 T3 比与较低的 HGS 和较短的 6MWD 相关 [32&]。甲状腺轴持续异常可能增加长期身体损害的风险。然而,其中涉及的机制仍不清楚。
# 入住重症监护病房之前、期间和之后的风险因素
女性和老年人在危重病后更容易出现功能恢复不良 [4&&,10&,33]。衰老过程中刺激肌肉蛋白质合成的能力降低,被称为合成代谢抗性 [34]。虽然较年轻患者的恢复速度可能比老年人快,但他们并不总能完全恢复到 ICU 前的健康状况 [11]。两性之间的差异尚不清楚,但可能与女性中既存的较小肌肉量相关 [5]。然而,这些患者的 ICU 前健康状况通常也较差 [35]。入住 ICU 前经历认知、心理或生理健康问题的患者处于 ICU 后功能预后不良的风险中 [4&&,15&,34]。最后,在进入 ICU 一年后,接受中等教育的患者比接受低教育的患者更不可能变得虚弱 [4&&]。
与发生 ICU-AW 相关的几个风险因素为多器官衰竭、制动、高血糖和全身炎症 [9&&]。此外,疾病的严重程度和机械通气的持续时间是危重病后身体预后的重要预测因素 [15&,21]。急诊外科 ICU 患者以及在较小程度上内科 ICU 患者在入院后 1 年报告身体功能和生活质量显著恶化,而择期手术患者可能出现改善 [4&]。择期手术患者通常需要短期 ICU 住院,而其他患者更多暴露于全身炎症和长期器官支持 [4&&]。此外,皮质类固醇治疗与 ICU-AW 的发生相关,尤其是在机械通气患者中 [36]。尽管皮质类固醇可减轻全身炎症并改善低氧血症,但它们可诱导骨骼肌的分解代谢效应 [9&&,12&&]。此外,神经肌肉阻滞治疗 (NMBA) 可能与肌无力相关,因为它引起完全的肌肉废用,可能归因于 ICU-AW。然而,目前的指南并不推荐 NMBA 长期治疗,因为其对肌肉萎缩的影响尚未得到证实 [12&&,37]。
通过 MRC 总和评分测量的离开 ICU 时的肌力,是 HGS、6MWD 和自我报告的 5 年随访时身体功能的预测指标 [38]。ICU 住院时间 (LOS) 是 1 年身体预后的重要决定因素;住院 LOS 也可能导致新发虚弱 [4&&,33]。
# 基于证据的治疗
目前尚无有效的治疗方法,医生主要通过早期活动和避免高血糖来预防 ICU-AW [21,39]。
# 早期活动
已经发表了几篇系统综述,阐述了 ICU 住院期间早期活动对预后的影响 [40-43]。这些荟萃分析的比较结果不一致,可能是由于早期动员的定义和纳入异质性试验的不同。最近的综合荟萃分析(包括 60 项试验)发现,入住 ICU 期间早期活动可改善出院时的身体功能 [44]。但是,在 ICU 住院期间接受康复治疗的患者中未发现出院 6 个月后对身体功能的有益作用 [42,44]。此外,ICU 出院后开始康复治疗的证据不足以证明其对功能恢复的影响 [45]。这些结果表明存在持续的机制,例如持续干扰分解代谢 / 合成代谢平衡,导致出院后无法重新获得肌肉功能 [23]。
# 激素疗法
在 ICU 患者中研究生长激素的随机对照试验 (RCT) 未能改善预后,甚至增加死亡率 [19]。然而,治疗的时间可能很关键,因为在危重疾病期间激素补充可能作用于促炎性。影响性腺轴的另一种方法是通过睾酮,因为低睾酮水平可能在出院后持续存在 [46&]。在重度烧伤患者中,睾酮类似物氧氮芥 - 屈隆治疗可在恢复期间增加瘦体重 [47]。两项在非烧伤 ICU 患者中进行的小型试验未发现与预后改善相关,但未关注长期 [48,49]。两组均接受低营养摄入,表明肌肉再生的底物给药不充分。此外,在住院期间停用了氧雄龙,这将是持续 ICU-AW 患者恢复肌肉功能的关键治疗阶段。因此,有必要在 ICU 后患者中进行一项睾酮类似物的 RCT,以确定其对身体康复的影响 [46&]。
# 营养治疗
另一种方法是通过营养治疗恢复合成代谢状态并刺激肌肉再生 [50]。然而,蛋白质摄入量升高的有益作用尚未显示。在一项 RCT 中,估计个体化营养目标覆盖了一组 100% 的需求,而另一组接受标准营养 [51]。虽然第一组的蛋白质供应较高,但是在危重疾病 6 个月后,患者自我报告的身体功能没有差异。值得注意的是,在 ICU 住院期间,与晚期 PN(> 8 天)相比,早期肠外营养 (PN)(< 48h) 可增加肌无力,但不增加肌肉萎缩 [52]。作者将其归因于在接受晚期 PN 的患者中更有效的套细胞疗法控制。此外,在危重疾病的急性期输注酮体或生酮作用减弱了小鼠脓毒症模型中的肌无力 [53]。在线粒体功能障碍的情况下,酮体可提供能量。然而,这一发现需要在人体研究中进一步探索。在 ICU 住院 4-7 天后,需要充分的蛋白质和能量摄入以防止肌肉量和功能的损失 [50,54]。
这些营养需求通常在 ICU 后期未实现,对长期预后产生不利影响 [55,56]。缺乏在 ICU 后期重点关注最佳营养策略的研究。近期一项非 ICU 患者的 RCT 显示,肌肉减少症住院老年患者补充蛋白质改善了体能状态,减少了康复时间和住院 LOS [57&]。虽然这些患者不同于 ICU 患者,因为后者可能患有炎症和氧化应激,但补充蛋白质仍可能提供合成代谢信号。这可能是 ICU 后期肌肉萎缩患者的潜在治疗策略,但需要进一步研究。
与 Dos Santos et al. 相反,在脓毒症存活的动物中发现线粒体损伤,尽管炎症消退,但仍存在持续性肌无力的动物中线粒体损伤持续存在 [23,26]。此外,Dos Santos 及其同事未研究可能有助于维持 ICU-AW 的实际线粒体功能 [23]。因此,ICU 出院后使用微量营养素进行线粒体复苏可能会引起关注,因为许多维生素和微量元素参与线粒体的最佳功能 [58]。高剂量的单一微量营养素未能显示获益。因此,战略抗氧化剂鸡尾酒疗法可能更具有临床有效性 [59&]。
# 间质细胞
考虑到持续性卫星细胞损伤是肌肉再生不良的关键驱动因素,靶向这些细胞可能是一个有价值的治疗靶点 [23]。其功能可通过间充质干细胞恢复。在脓毒症小鼠模型中,这些细胞可改善肌肉恢复,减少坏死和纤维化,并降低血浆促炎细胞因子和降钙素原水平 [24]。尚未发表涉及间充质细胞治疗以恢复 ICU 后患者肌肉功能的人体研究。
# 结论
身体恢复较差是 ICU 幸存者中最令人虚弱和报告的 PICS 方面。由于大多数研究在处理新的身体症状时未考虑既存健康状况,因此目前尚不清楚新发残疾的实际发生率。ICU 前健康状况、人口统计学和 ICU 治疗因素似乎是 ICU 后身体康复的重要决定因素。对其中涉及的病理生理机制知之甚少,从而导致迄今为止令人费解的循证治疗策略。需要更多研究 ICU 后期的病理生理学和有前景的多模式治疗,包括营养、运动康复和激素治疗。
# REFERENCES
DETAILS
Wischmeyer PE, San-Millan I. Winning the war against ICU-acquired weakness: new innovations in nutrition and exercise physiology. Crit Care 2015; 19: (Suppl 3): S6.
Needham DM, Davidson J, Cohen H, et al. Improving long-term outcomes after discharge from intensive care unit: report from a stakeholders' conference. Crit Care Med 2012; 40:502-509.
3[■]. Intiso D, Centra AM, Bartolo M, et al. Recovery and long term functional outcome in people with critical illness polyneuropathy and myopathy: a scoping review. BMC Neurol 2022; 22:50.
Recently published systematic review and meta-analysis reporting the incidence of ICU-AW following ICU admission, differentiating between different ICU-AW manifestations such as CIM, CIP and the combination.
4[■][■]. Geense WW, Zegers M, Peters MAA, et al. New physical, mental, and cognitive problems 1 year after ICU admission: a prospective multicenter study. Am J Respir Crit Care Med 2021; 203:1512-1521.
A large, Dutch multicenter study providing interesting insights into the incidence of PICS-related problems one year after ICU survival. This study adjusted for pre-ICU health status, providing a valid picture of the impact of critical illness on problems following ICU-admission.
Kress JP, Hall JB. ICU-acquired weakness and recovery from critical illness. N Engl J Med 2014; 371:287-288.
Puthucheary ZA, Rawal J, McPhail M, et al. Acute skeletal muscle wasting in critical illness. JAMA 2013; 310:1591-1600.
Hopkins RO, Suchyta MR, Kamdar BB, et al. Instrumental activities of daily living after critical illness: a systematic review. Ann Am Thorac Soc 2017; 14:1332-1343.
Hermans G, Van Mechelen H, Clerckx B, et al. Acute outcomes and 1-year mortality of intensive care unit-acquired weakness. A cohort study and propensity-matched analysis. Am J Respir Crit Care Med 2014; 190:410-420.
9[■][■]. Wang W, Xu C, Ma X, et al. Intensive care unit-acquired weakness: a review of recent progress with a look toward the future. Front Med 2020; 7:559789.
A recent systematic review and meta-analysis investigating the efficacy of physical rehabilitation in the ICU, including the most recent studies available.
10[■]. Meyer-Friessem CH, Malewicz NM, Rath S, et al. Incidence, time course and influence on quality of life of intensive care unit-acquired weakness symptoms in long-term intensive care survivors. J Intensive Care Med 2021; 36:1313-1322.
A cohort study investigating the incidence of ICUAW for a period up to 10 years after ICU discharge, including comparisons of CIM and CIP. This information provides insights for different disease outcomes.
- Herridge MS, Tansey CM, Matte A, et al. Functional disability 5 years after acute respiratory distress syndrome. N Engl J Med 2011; 364:1293-1304.
12[■][■]. Parry SM, Nalamalapu SR, Nunna K, et al. Six-minute walk distance after critical illness: a systematic review and meta-analysis. J Intensive Care Med 2021; 36:343-351.
A comprehensive systematic review and meta-analysis giving an overview of studies evaluating an objective performance-based physical function measurement (6MWD), providing longitudinal information on physical function recovery over the first 5 years after critical illness.
- Ferrante LE, Pisani MA, Murphy TE, et al. The association of frailty with post-ICU disability, nursing home admission, and mortality: a longitudinal study. Chest 2018; 153:1378-1386.
14[■][■]. Heesakkers H, van der Hoeven JG, Corsten S, et al. Clinical outcomes among patients with 1-year survival following intensive care unit treatment for COVID-19. JAMA 2022; 327:559-565.
A comprehensive substudy of the MONITOR-ICU study in COVID-19 patients using the exact same study methods as Geense et al. (ref. 4), making it possible to compare incidence rates of new physical outcomes in COVID-19 and non-COVID-19 ICU survivors.
15[■]. Hodgson CL, Higgins AM, Bailey MJ, et al. The impact of COVID-19 critical illness on new disability, functional outcomes and return to work at 6 months: a prospective cohort study. Crit Care 2021; 25:382.
A large multicenter, prospective cohort study describing the incidence of self-reported new disabilities and functional impairment, following severe COVID-19 requiring ICU-admission.
16[■]. Moonen H, Strookappe B, van Zanten ARH. Physical recovery of COVID-19 pneumosepsis intensive care survivors compared with non-COVID pneumosepsis intensive care survivors during postintensive care hospitalization: The RECOVID retrospective cohort study. J Parenter Enteral Nutr 2021; 46:798-804.
A restrospective cohort study comparing physical recovery during hospital stay in COVID-19 and non-COVID pneumosepsis ICU survivors. One of few reports comparing recovery among COVID-19 and non-COVID-19 ICU survivors.
17[■]. Latronico N, Peli E, Calza S, et al. Physical, cognitive and mental health outcomes in 1-year survivors of COVID-19-associated ARDS. Thorax 2022; 77:300-303.
This prospective longitudinal study evaluated physical outcomes in COVID-19 patients 3, 6 and 12 months after ICU discharge. Objective measures are used to measure physical function.
Huang C, Huang L, Wang Y, et al. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet 2021; 397:220-232.
Friedrich O, Reid MB, Van den Berghe G, et al. The sick and the weak: neuropathies/myopathies in the critically ill. Physiol Rev 2015; 95:1025-1109.
Batt J, Herridge MS, Dos Santos CC. From skeletal muscle weakness to functional outcomes following critical illness: a translational biology perspective. Thorax 2019; 74:1091-1098.
Vanhorebeek I, Latronico N, Van den Berghe G. ICU-acquired weakness. Intensive Care Med 2020; 46:637-653.
22[■]. Van Dyck L, Guiza F, Derese I, et al. DNA methylation alterations in muscle of critically ill patients. J Cachexia Sarcopenia Muscle 2022; 13:1731-1740.
A cohort study derived from the EPaNIC trial contributing to the unsolved puzzle of the pathophysiology behind ICU-AW by providing novel insights into the role of muscle DNA methylation alterations following critical illness.
Dos Santos C, Hussain SN, Mathur S, et al. Mechanisms of chronic muscle wasting and dysfunction after an intensive care unit stay. A pilot study. Am J Respir Crit Care Med 2016; 194:821-830.
Rocheteau P, Chatre L, Briand D, et al. Sepsis induces long-term metabolic and mitochondrial muscle stem cell dysfunction amenable by mesenchymal stem cell therapy. Nat Commun 2015; 6:10145.
Massenet J, Gardner E, Chazaud B, Dilworth FJ. Epigenetic regulation of satellite cell fate during skeletal muscle regeneration. Skelet Muscle 2021; 11:4.
Owen AM, Patel SP, Smith JD, et al. Chronic muscle weakness and mitochondrial dysfunction in the absence of sustained atrophy in a preclinical sepsis model. Elife 2019; 8:e49920.
Walsh CJ, Batt J, Herridge MS, et al. Transcriptomic analysis reveals abnormal muscle repair and remodeling in survivors of critical illness with sustained weakness. Sci Rep 2016; 6:29334.
Walsh CJ, Escudero King C, Gupta M, et al. MicroRNA regulatory networks associated with abnormal muscle repair in survivors of critical illness. J Cachexia Sarcopenia Muscle 2022; 13:1262-1276.
Wirtz TH, Loosen SH, Buendgens L, et al. Low myostatin serum levels are associated with poor outcome in critically ill patients. Diagnostics 2020; 10:574.
30[■]. Kobayashi M, Kasamatsu S, Shinozaki S, et al. Myostatin deficiency not only prevents muscle wasting but also improves survival in septic mice. Am J Physiol Endocrinol Metab 2021; 320:E150-E159.
A well designed animal study providing novel and interesting insights into the role of myostatin in sepsis-induced muscle wasting.
- Wallner C, Wagner JM, Dittfeld S, et al. Myostatin serum concentration as an indicator for deviated muscle metabolism in severe burn injuries. Scand J Surg 2019; 108:297-304.
32[■]. Vanhorebeek I, Derese I, Gunst J, et al. Persisting neuroendocrine abnormalities and their association with physical impairment 5 years after critical illness. Crit Care 2021; 25:430.
This study investigated long-term neuroendocrine abnormalities after ICU among patients with poor phsyical recovery. This papers suggests potential targets to improve long term outcomes after critical illness.
Hajeb M, Singh TD, Sakusic A, et al. Functional outcome after critical illness in older patients: a population-based study. Neurol Res 2021; 43:103-109.
Paddon-Jones D, Rasmussen BB. Dietary protein recommendations and the prevention of sarcopenia. Curr Opin Clin Nutr Metab Care 2009; 12:86-90.
Geense WW, van den Boogaard M, Peters MAA, et al. Physical, mental, and cognitive health status of ICU survivors before ICU admission: a cohort study. Crit Care Med 2020; 48:1271-1279.
Yang T, Li Z, Jiang L, Xi X. Corticosteroid use and intensive care unit-acquired weakness: a systematic review and meta-analysis. Crit Care 2018; 22:187.
Murray MJ, DeBlock HF, Erstad BL, et al. Clinical practice guidelines for sustained neuromuscular blockade in the adult critically ill patient: 2016 update-executive summary. Am J Health Syst Pharm 2017; 74:76-78.
Van Aerde N, Meersseman P, Debaveye Y, et al. Five-year impact of ICU-acquired neuromuscular complications: a prospective, observational study. Intensive Care Med 2020; 46:1184-1193.
Anekwe DE, Biswas S, Bussieres A, Spahija J. Early rehabilitation reduces the likelihood of developing intensive care unit-acquired weakness: a systematic review and meta-analysis. Physiotherapy 2020; 107:1-10.
Menges D, Seiler B, Tomonaga Y, et al. Systematic early versus late mobilization or standard early mobilization in mechanically ventilated adult ICU patients: systematic review and meta-analysis. Crit Care 2021; 25:16.
Doiron KA, Hoffmann TC, Beller EM. Early intervention (mobilization or active exercise) for critically ill adults in the intensive care unit. Cochrane Database Syst Rev 2018; 3:CD010754.
Fuke R, Hifumi T, Kondo Y, et al. Early rehabilitation to prevent postintensive care syndrome in patients with critical illness: a systematic review and meta-analysis. BMJ Open 2018; 8:e019998.
Zang K, Chen B, Wang M, et al. The effect of early mobilization in critically ill patients: a meta-analysis. Nurs Crit Care 2020; 25:360-367.
Wang YT, Lang JK, Haines KJ, et al. Physical rehabilitation in the ICU: a systematic review and meta-analysis. Crit Care Med 2022; 50:375-388.
Connolly B, Salisbury L, O'Neill B, et al. Exercise rehabilitation following intensive care unit discharge for recovery from critical illness: executive summary of a Cochrane Collaboration systematic review. J Cachexia Sarcopenia Muscle 2016; 7:520-526.
46[■]. Wischmeyer PE, Suman OE, Kozar R, et al. Role of anabolic testosterone agents and structured exercise to promote recovery in ICU survivors. Curr Opin Crit Care 2020; 26:508-515.
Excellent and comprehensive review adressing the urgency for research into treatment strategies for post-ICU muscle weakness, advocating for trials investigating the efficacy of anabolic medications, exercise and nutrition to enhance the convalescence of critical illness survivors.
Li H, Guo Y, Yang Z, et al. The efficacy and safety of oxandrolone treatment for patients with severe burns: a systematic review and meta-analysis. Burns 2016; 42:717-727.
Bulger EM, Jurkovich GJ, Farver CL, et al. Oxandrolone does not improve outcome of ventilator dependent surgical patients. Ann Surg 2004; 240:472-478. discussion 8-80.
Gervasio JM, Dickerson RN, Swearingen J, et al. Oxandrolone in trauma patients. Pharmacotherapy 2000; 20:1328-1334.
van Zanten ARH, De Waele E, Wischmeyer PE. Nutrition therapy and critical illness: practical guidance for the ICU, post-ICU, and long-term convalescence phases. Crit Care 2019; 23:368.
Allingstrup MJ, Kondrup J, Wiis J, et al. Early goal-directed nutrition in ICU patients (EAT-ICU): protocol for a randomised trial. Dan Med J 2016; 63:A5271.
Hermans G, Casaer MP, Clerckx B, et al. Effect of tolerating macronutrient deficit on the development of intensive-care unit acquired weakness: a subanalysis of the EPaNIC trial. Lancet Respir Med 2013; 1:621-629.
Goossens C, Weckx R, Derde S, et al. Adipose tissue protects against sepsis-induced muscle weakness in mice: from lipolysis to ketones. Crit Care 2019; 23:236.
Singer P, Blaser AR, Berger MM, et al. ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr 2019; 38:48-79.
Ridley EJ, Parke RL, Davies AR, et al. What happens to nutrition intake in the post-intensive care unit hospitalization period? An observational cohort study in critically ill adults. JPEN J Parenter Enteral Nutr 2019; 43:88-95.
Wittholz K, Fetterplace K, Clode M, et al. Measuring nutrition-related outcomes in a cohort of multitrauma patients following intensive care unit discharge. J Hum Nutr Diet 2020; 33:414-422.
57[■]. Rondanelli M, Cereda E, Klersy C, et al. Improving rehabilitation in sarcopenia: a randomized-controlled trial utilizing a muscle-targeted food for special medical purposes. J Cachexia Sarcopenia Muscle 2020; 11:1535-1547.
A randomized controlled trial investigating the effect of nutritional supplementation in sarcopenic elderly to restore physical function. This study shows beneficial effects in non-ICU patients and provides promising information for a realistic intervention in post-ICU patients.
- Wesselink E, Koekkoek WAC, Grefte S, et al. Feeding mitochondria: potential role of nutritional components to improve critical illness convalescence. Clin Nutr 2019; 38:982-995.
59[■]. Moonen H, Van Zanten ARH. Mitochondrial dysfunction in critical illness during acute metabolic stress and convalescence: consequences for nutrition therapy. Curr Opin Crit Care 2020; 26:346-354.
# 社论:心源性休克中让人盲从的治疗:我们是否正在进入一种新的状态
心源性休克 (CS) 仍然是一种反常的心脏疾病,死亡率最高,但改善预后的治疗最少。在这个时代,动脉粥样硬化性心脏病、射血分数降低性心力衰竭、心律失常疾病患者的预后已获得巨大改善,同时瓣膜性心脏病患者微创治疗的创新也取得巨大进展 - 只有 CS 的治疗一直没有改变预后,其治疗选择和我们提供的治疗选择一样有限。当然,我们不得不想知道,当心血管医学的许多其他领域都获得成功时,我们这个领域是如何未能取得进展的?
作为研究的一个重点,预后改变疗法的确定一直受到无法产生形成实践的可靠证据基础的阻碍。直到最近,心血管造影和介入学会才开发了一个分类系统,以确保入选研究的患者人群标准化 [1,2],因为 CS 可代表一个广泛异质性人群,其预后根据其类别不同而广泛不同。尽管这是确保各研究间人群更具有可比性的关键步骤 - 招募仍存在重大障碍。事实上,在超过 20 年的研究中,仅 5 项专门的 CS 试验已入组超过 150 例患者 [3-7],许多拟定的随机试验未能达到招募目标,未能达到增加我们知识库的希望。在缺乏良好数据的情况下,随着越来越复杂的机械支持、治疗算法和实施它们的团队的出现,执业医师已经开始常规使用生理学和基本原理来指导治疗。随着这些疗法的根深蒂固,它们将越来越难以评估,我们为临床研究制造了一个泥土。尽管如此,我对需要证明所有治疗的价值的认识日益增加感到鼓舞,无论是血管加压药或正性肌力药,还是现代机械循环支持 (MCS)。事实上,我们可能正在进入 CS 研究和治疗的新时代,因为我们证明了真正的治疗和方法,并丢弃了我们今天盲目使用的虚假的最佳治疗。为此,当前版本的杂志强调了 CS 管理或护理系统的几个方面,并回顾了新出现的证据。
首先,Mathew 博士及其团队报告了有关在 CS 治疗中使用正性肌力药物的最新证据。根据近期发表的 DoReMi 试验 [5](该试验发现 SCAI C/D 患者中米力农与多巴酚丁胺之间并无差异),此次审查强调了现有药物之间的生理学和药理学差异,以及支持使用两种药物的证据。此外,其重点关注正性肌力药物治疗时间、治疗目标、药物选择方面稳健数据的相对缺乏,或许最有趣的是,我们是否需要正性肌力药物治疗,尤其是在新出现的循环支持策略背景下。
随后,Jung 博士对 [9] 二尖瓣返流 (MR) 作为特定 CS 患者潜在治疗靶点的认识日益增加进行了综述。实际上,多达 20% 的 CS 患者同时伴有中度或以上 MR [10]。随着微创经导管疗法的出现,如边缘对边缘修复,可以解决原发性和继发性 MR,即使在危重患者人群中,风险也很小,效率高 [11]。越来越多的观察性研究支持这一策略,鉴于提供这种治疗所需的高成本和资源强度,越来越多的人要求随机对照试验数据支持这一方法。
在资源利用和复杂性的顶峰,MCS 的选项阵列不断增加。尽管与 MCS 使用相关的成本较高,但这种治疗方法在无任何随机对照试验数据支持其使用的情况下得到了越来越广泛的应用。在本版中,Dr Fernando 及其同事 [12] 熟练地总结了 MCS 策略的现状,并仔细平衡了对潜力的热情与实用主义和实施的现实。正在进行的里程碑试验将很快回答该问题 - 轴向泵或静脉 - 动脉体外膜肺氧合是否能够改善预后。如果他们失败了 - 我们是否有足够的胆量放弃这些在没有良好数据的情况下被广泛采用的疗法?
新手和专家们都在与 CS 的血流动力学、代谢和临床目标作斗争。为此,Kapur 博士及其同事 [13] 回顾了皮质内固醇试验中的替代标记物,以及可能作为治疗靶点的标记物。随着肺动脉导管的重新出现,对传统和新型生物标志物的兴趣增加,以及更频繁地验证其与死亡率相关性的能力,脉络膜 “靶向治疗” 或允许这些验证的替代物作为器械关键性试验的预后变得越来越强烈。鉴于招募具有足够效能的死亡率试验存在困难,我们如何实际处理评价和批准越来越多的疗法。对于执业医生,我们应该针对乳酸清除率 [14]、楔压、右心房压等目标。在这些重症患者中滴定药物治疗或机械支持时?
最后,随着这些患者的治疗选择和复杂性的增加,Dr Miller 及其同事 [15] 讨论了系统方法的 CS 问题,具体解决了如何配备现代病房来管理这些患者。与传统的冠心病监护病房不同,2022 年的心脏重症监护病房需要经过培训的医生,这些医生能够反映出越来越多的患者自己得到护理。除了 CS 区域护理系统的复杂问题外,一个更根本的问题是我们如何使医生充分准备来处理这些多系统患者。虽然事实上可能存在于许多进入 CICU 的途径中,但是增加重症监护的培训将是越来越多的双重认证的心脏病专家 - 重症监护医师领导的标准做法。此外,随着越来越多的治疗选择,多学科休克团队在管理 CS 患者中发挥了作用 - 这是否增加了预后方面的价值,或者只是简单地增加了这些系统的成本和复杂性。
这些主题均突出了证据基础的不确定性。因此,这些问题中的每一个都可以并且应该通过随机对照试验数据来回答。如果我们希望 CS 患者享受我们在其他心血管疾病中观察到的结果改善,我们将需要消除偏见,丢弃我们的虚假偶像,允许随机分组指导我们对 CS 患者进行最有效的治疗。
# REFERENCES
DETAILS
Baran DA, Grines CL, Bailey S, et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock: This document was endorsed by the American College of Cardiology (ACC), the American Heart Association (AHA), the Society of Critical Care Medicine (SCCM), and the Society of Thoracic Surgeons (STS) in April 2019. Catheter CardiovascInterv 2019; 94:29-37.
Naidu SS, Baran DA, Jentzer JC, et al. SCAI SHOCK Stage Classification Expert Consensus Update: A Review and Incorporation of Validation Studies: This statement was endorsed by the American College of Cardiology (ACC), American College of Emergency Physicians (ACEP), American Heart Association (AHA), European Society of Cardiology (ESC) Association for Acute Cardiovascular Care (ACVC), International Society for Heart and Lung Transplantation (ISHLT), Society of Critical Care Medicine (SCCM), and Society of Thoracic Surgeons (STS) in December 2021. J Am Coll Cardiol 2022; 79:933-946.
Thiele H, Zeymer U, Neumann FJ, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med 2012; 367:1287-1296.
Thiele H, Akin I, Sandri M, et al. PCI strategies in patients with acute myocardial infarction and cardiogenic shock. N Engl J Med 2017; 377:2419-2432.
Mathew R, Di SP, Jung RG, et al. Milrinone as compared with dobutamine in the treatment of cardiogenic shock. N Engl J Med 2021; 385:516-525.
Alexander JH, Reynolds HR, Stebbins AL, et al. Effect of tilarginine acetate in patients with acute myocardial infarction and cardiogenic shock: the TRIUMPH randomized controlled trial. JAMA 2007; 297:1657-1666.
Hochman JS, Sleeper LA, Webb JG, et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med 1999; 341:625-634.
Hu K, Mathew R. Inotrope and vasopressor use in cardiogenic shock: what, when and why? Curr Opin Crit Care 2022; 28:419-425.
Jung RG, Simard T, Di Santo P, Hibbert B. Transcatheter edge-to-edge repair in patients with mitral regurgitation and cardiogenic shock: a new therapeutic target. Curr Opin Crit Care 2022; 28:426-433.
Parlow S, Weng W, Di SP, et al. Significant valvular dysfunction and outcomes in cardiogenic shock: insights from the randomized DOREMI trial. Can J Cardiol 2022; doi: 10.1016/j.cjca.2022.04.004.
Jung RG, Simard T, Kovach C, et al. Transcatheter mitral valve repair in cardiogenic shock and mitral regurgitation: a patient-level, multicenter analysis. JACC Cardiovasc Interv 2021; 14:1-11.
Fernando SM, Price S, Mathew R, et al. Mechanical circulatory support in the treatment of cardiogenic shock. Curr Opin Crit Care 2022; 28:434-441.
Kosyakovsky LB, Marbach JA, Nguyen K, et al. Outcomes in cardiogenic shock: the role of surrogate endpoints. Curr Opin Crit Care 2022; 28:442-452.
Marbach JA, Di SP, Kapur NK, et al. Lactate clearance as a surrogate for mortality in cardiogenic shock: insights from the DOREMI Trial. J Am Heart Assoc 2022; 11:e023322.
Quien M, Thomas A, Ludmir J, Miller PE. Staffing models in the cardiac intensive care unit. Curr Opin Crit Care 2022; 28:453-459.
# 治疗心源性休克的正性肌力药和升压药:何谓、何时、为何?
综述目的
尽管人们对心源性休克 (CS) 的治疗越来越感兴趣,但死亡率仍高得令人无法接受。支持性治疗的主要内容包括血管加压药和正性肌力药物。这些药物在国际指南中被推荐,尽管支持 CS 安全性和疗效的证据有限,但被广泛使用。
近期结果
OptimaCC 试验进一步支持去甲肾上腺素应继续作为 CS 的一线血管加压素选择。CAPITAL DOREMI 试验发现,米力农在降低 CS 发病率和死亡率方面并不优于多巴酚丁胺。目前正在进行的两项研究将提供安慰剂对照试验中强心剂治疗必要性的首个证据:CAPITAL DOREMI2 将在休克初始复苏时将 CS 患者随机分配至强心剂组或安慰剂组,以评价强心剂治疗的疗效;LevoHeartShock 将检查左西孟旦相较于安慰剂在需要升压治疗的早期 CS 中的疗效。
总结
当前文献综述未显示任何特定血管加压药或正性肌力药物在 CS 患者中的显著死亡率获益。即将进行的 DOREMI 2 和左西孟旦对比安慰剂试验将进一步解决皮质内固醇中强心剂必要性的问题。此时,应根据医生的经验、可用性、费用以及最重要的是个体患者对治疗的反应来选择正性肌力药物。
关键词
心源性休克、正性肌力药物、血管加压药
# 要点
・血管加压药和正性肌力药仍然是 CS 支持治疗的主要手段,尽管有限的证据支持其在 CS 中的有效性和安全性。
・去甲肾上腺素是 CS 中首选的血管加压药,但尚无数据支持在 CS 中选择一种正性肌力药而非另一种。
・应根据个体患者对治疗的反应和对潜在不良反应的耐受性来选择正性肌力药物。
・目前迫切需要检验强心剂与安慰剂相比治疗 CS 的随机试验。
# 引言
心源性休克 (CS) 是一种原发性低心输出量 (CO) 心脏疾病,导致临床和生化检查发现终末器官灌注不足 [1]。病理生理变化包括心肌收缩力受损和 CO 降低,与全身血管收缩和冠状动脉缺血相关。伴随全身性炎症、血管舒张和异常一氧化氮处理可使复杂的 CS 螺旋恶化。CS 使约 5-10% 的急性心肌梗死 (AMI) 复杂化 [2]。CS 的非 AMI 病因包括急性失代偿性心力衰竭、严重瓣膜疾病、心律失常和心肌炎。过去定义的 CS 为血流动力学异常,收缩压持续低于 90 mmHg 的低血压与心脏指数严重下降相关(无支持时低于 1.8 L/min/m2,有支持时低于 2.2 L/min/m2),充盈压充分或升高(左心室舒张末期压大于 15-18 mmHg)[1]。心血管造影和介入学会 (SCAI) 最近更新了有关 CS 分类的专家共识声明。分期范围为 A 期,存在 CS、脚趾风险的患者,确定处于濒死状态的患者。C 级或 C 级以上休克患者根据临床和 / 或生化低灌注证据进行区分 [3]。该分类系统标准化了我们沟通 CS 的方式,提供了 AMI - 和非 AMI CS 队列的预后瓣膜,并允许在不同的 CS 患者亚群中更好地评估干预的有效性。认识 CS 患者的表型变异以及这些病因如何影响预后很重要。例如,在 CAPITAL DOREMI 队列中,与非 AMI-CS 患者相比,AMI-CS 患者的全因死亡率、MCS 器械需求和 RRT 显著更高,突出了在 CS 特定亚组中进行药物和器械干预试验的必要性 [4&]。2022 年 SCAI 更新还包括休克阶段以外的风险因素,改善了死亡率风险分层,允许额外的亚组鉴别和改善预后效用。CAPITAL DOREMI 试验的事后分析发现,中度至重度或以上瓣膜狭窄或反流患者的住院死亡率较高 [5&]- 显著的伴随瓣膜病是否只是预后恶化的标志物或潜在的治疗目标尚未确定。
CS 患者护理方面最显著的进步是 SHOCK 试验,该试验显示 AMI-CS 伴紧急冠状动脉病变血运重建的死亡率降低 [6]。探索其他治疗干预措施的试验,包括主动脉内球囊反搏 (IABP)[7] 和一氧化氮合酶抑制剂 [8] 未显示获益,在过去二十年中,CS 的死亡率稳定在 40% 以上 [9]。因此,血管加压药和正性肌力药仍然是药理学稳定的主要药物,国际指南推荐使用这些药物 [10,11]。其使用主要基于专家共识,有限的随机临床试验数据支持疗效和安全性 [1214]。在此,我们对常用的正性肌力药物、它们的作用机制以及它们在治疗 CS 中作用的相关数据进行了综述。
# 正性肌力药物的生理基础
机体的肾上腺素能受体分为 α 受体和 β 受体,负责执行交感神经系统的功能。α-1 受体与血管平滑肌活动相关,活化产生全身血管收缩,增加外周血管阻力和动脉血压。α-2 受体位于突触前神经末梢内,抑制内源性去甲肾上腺素的释放。β-1 受体的激活导致正性肌力和变时性增强,而 β-2 受体的激活导致平滑肌和血管舒张。大多数 CS 复苏药物具有正性肌力和血管加压素特性,利用对上述受体的兴奋和抑制作用,发挥其对心脏、外周血管系统和自主神经系统的作用,以增加 CO 并恢复终末器官灌注 [15]。
# 去甲肾上腺素被认为是一线血管加压药
皮质内固醇中最常用的血管加压药是去甲肾上腺素,这是一种作用于 α-1 肾上腺素能受体的强效血管加压药,可引起血管收缩,也可作用于心肌中的 β-1 肾上腺素能受体,增强心肌收缩力 [15]。治疗剂量范围为 0.05 至 1.0 μg/kg/min [16]。如表 1 所示,去甲肾上腺素可升高平均动脉压 (MAP),而不会导致心率升高 [15-17]。这可能是由于 α-1 刺激引起的后负荷增加引起的反射性心动过缓。这证明具有潜在优势,因为心动过速可恶化心肌需氧量。此外,去甲肾上腺素不作用于 β-2 肾上腺素能受体,阻止肾上腺素诱导的血清乳酸盐升高,使乳酸盐可用作终末器官灌注更可靠的标志物 [18,19]。
相反,肾上腺素比去甲肾上腺素具有更强效的 β-1 肾上腺素能效应,以及中度的 β-2 和 α-1 肾上腺素能受体效应 [15]。治疗剂量范围为 0.1 至 1 μg/kg/min [16]。在较低剂量下,肾上腺素由于 β-1 肾上腺素能正性肌力和变时性效应而增加 CO,而 α-1 肾上腺素能诱导的血管收缩则被 β-2 肾上腺素能血管舒张所平衡。在较高剂量下,α- 肾上腺素能受体效应占优势,导致体循环血管阻力 (SVR) 增加 [20]。由于快速性心律失常、内脏血管收缩和高乳酸血症的风险增加,肾上腺素不常用作休克状态的一线治疗 [21]。在对 CS 中的几种血管加压药和正性肌力药进行的一项综述中,仅肾上腺素与心脏和肾脏生物标志物的显著恶化以及 90 天死亡率增加独立相关 [22]。Opti-maCC 试验证实了去甲肾上腺素相对于肾上腺素的优势,该试验将 57 例 AMI-CS 患者随机分配至这两种药物组。两种药物均可升高 MAP,但肾上腺素治疗患者显示乳酸酸中毒的发生率更高,心率显著且持续增加,心脏双乘积(心肌耗氧量的标志物)增加。虽然肾上腺素能有效升高 MAP,但其会导致较高的能量消耗和较低的心脏效率。这些效应可能是由于受体亲和力的差异所致,因为仅肾上腺素作用于 β-2 肾上腺素能受体。最重要的是,肾上腺素组患者难治性休克的发生率增加,但两组的死亡率无显著差异(肾上腺素组 60 天死亡率为 52%,去甲肾上腺素组为 37%)。必须注意 OptimaCC 的几个局限性,包括样本量较小、缺乏有关达到的最大剂量的说明和随访持续时间较短 [23]。尽管在停搏前后情况下,肾上腺素仍经常用作 “推进剂量或推注剂量血管加压药”,但在 CS 患者中应避免持续输注用于血流动力学支持。
表 1. 皮质内固醇常用的正性肌力药物,包括剂量范围、受体结合、血流动力学效应和不良反应。
| 药物 | 治疗剂量范围 | 受体结合 | 血流动力学作用 | 血流动力学作用 | 不良反应 |
|---|---|---|---|---|---|
| 去甲肾上腺素 | 0.05-1 μg/kg/min | α1+++ β1++ | MAP:↑↑ HR:- 或↓ CO:↑ | + 收缩力 + + 血管收缩 | 心律失常,肺血管阻力增加,外周(指)缺血 |
| 肾上腺素 | 0.1-1 μg/kg/min | α1 + + + β1 + + + β2 + + | MAP:↑↑ HR:↑↑ CO:↑↑ | + 收缩力 + + 血管收缩 | 室性心律失常,重度高血压,心肌缺血 |
| 多巴酚丁胺 | 2-20 μg/kg/min | β1++ | MAP:- 或↓ HR:↑↑ CO:↑↑ | + + 收缩力 + 血管舒张 | 心动过速、房颤患者心室反应率增加、室性心律失常、心脏缺血、高血压、低血压 |
| 米力农 | 0.0625-0.5 μg/kg/min | PDE-3 抑制剂 | MAP:- 或↓ HR:↑ CO:↑↑ | + + 收缩力 + 血管舒张 | 室性心律失常、低血压、心肌缺血、尖端扭转型室性心动过速 |
| 左西孟旦 | 0.05-2 μg/kg/min | 钙增敏剂 | MAP:- 或↓ HR:↑↑ CO:↑↑ | + + 收缩力 + 血管舒张 | 心动过速,房室传导增强,低血压 |
MAP,平均动脉压;CO,心输出量;HR,心率。改编自参考文献 [15-17]。
# 二线血管加压药
单纯血管加压素(如血管加压素或去氧肾上腺素)通常不是 CS 的一线治疗,因为其对心肌收缩力无影响。有些特殊情况下,纯血管加压药可能是有益的,例如在后负荷敏感情况下,如动态左心室流出道梗阻 (LVOTO) 和 CS [12]。正性肌力性质如去甲肾上腺素的血管加压药可能有害,因为增加心肌收缩力将恶化 LVOTO 并进一步损害前向血流。此外,在右心室衰竭明显的患者中可优先选择血管加压素,因为它被认为可增加 SVR 而不伴有肺血管阻力 (PVR) 增加,有助于尽量减少对已衰竭 RV 的额外损害 [24]。这一概念反映在一项 RCT 中,该 RCT 在 CABG 期间米力农诱导低血压患者中比较了低剂量血管加压素与去甲肾上腺素。结果发现,这两种药物均可有效恢复米力农诱导的 SVR 降低,但仅低剂量血管加压素降低了 PVR/SVR 比值 [25]。关于专门在 CS 中使用纯升压药,现有证据是实验性的,迄今为止仅发表了非人类研究。在心脏骤停并发难治性 CS 并采用静脉 - 动脉 ECMO 进行复苏的猪模型中,与去甲肾上腺素相比,血管加压素产生更快的乳酸盐清除、更少的液体复苏和更少的肺水肿 [26&]。一项正在进行的随机试验 (NCT02118467)* 目前正在研究去氧肾上腺素和血管加压素与去甲肾上腺素和肾上腺素相比,治疗对静脉输液无反应的 ICU 休克患者,假设纯血管加压素将减少快速性心律失常 [27&]。由于 CS 人群在病因学方面具有多样性和异质性,这些结果强调了根据个体患者状况定制决策并密切监测临床反应的重要性。
# 在心源性休克中不推荐多巴胺
多巴胺是休克状态下另一种常用的血管加压药,作用于 β-1 和 α-1 肾上腺素能受体。剂量范围为 2-20 μg/kg/min [15]。但是,多巴胺并非常规用于 CS,De Backer et al. 在 SOAP II 试验中发现,与去甲肾上腺素相比,多巴胺可增加心律失常和 28 天死亡率 [28]。这些结果在近期一项随机化对照试验 (RCT) 的荟萃分析中得到了证实,该分析得出结论,在不考虑病因的情况下,去甲肾上腺素与多巴胺相比降低 CS 患者的 28 天死亡率、较少的心律失常事件和较低的胃肠道反应发生率相关 [29]。但是,因为 SOAP II 试验没有 CS 的标准定义,并且包括阻塞性、瓣膜性和心切开术后状态,所以对结果的外部有效性和适用性提出了问题。不同的血流动力学特征可能导致治疗相关差异,但未对其进行正式评价。因此,van Diepen 等人表明最佳一线血管加压药仍不清楚 [12],但指南支持去甲肾上腺素作为首选血管加压药,因为去甲肾上腺素有效且不良事件风险较低。还需要更大规模和高质量的随机对照试验来研究不同表型 CS 中的其他药物,并以循证方式更好地指导这些决策。
# 多巴胺
多巴酚丁胺是皮质内固醇中最常用的正性肌力药物之一。它是一种合成的儿茶酚胺,对 β-1 和 β-2 受体有亲和力,可产生正性肌力和后负荷降低作用 [30]。剂量范围从 2 μg/kg/min 至 20 μg/kg/min 以上,无需针对肾或肝功能不全进行调整 [15]。临床上,多巴酚丁胺的半衰期较短,使得强心剂疗法的 “试验” 具有优势,可以快速评估其有效性和安全性 [31]。鉴于缺乏强有力的数据显示强心剂的有意义获益以及已确定危害的信号,这一点尤为重要,应在获得更令人信服的数据之前调整用药。多巴酚丁胺的一个问题,特别是在 AMI 后人群中,据称是心肌耗氧量增加、缺血和快速性心律失常。在伴有重度心力衰竭的 AMI 后患者中,多巴酚丁胺的室上性和室性心律失常负荷高于依诺昔酮 [32]。一项纳入了 CS 患者异质队列的回顾性审查发现,与米力农相比,多巴酚丁胺中心律失常,尤其是窦性心动过速更常见 [33]。然而,多巴酚丁胺被广泛使用,多巴酚丁胺 - 去甲肾上腺素联合用药常见于需要血管加压药和正性肌力药物支持的 CS 患者中。一项比较多巴酚丁胺 - 去甲肾上腺素与肾上腺素的研究发现,两种干预措施同样有效,但肾上腺素会引起更多不良事件,包括一过性乳酸酸中毒、心率加快和心律失常以及胃灌注不足 [34]。
最后,作为 β- 肾上腺素能受体激动剂,多巴酚丁胺与 β- 受体阻滞剂联合治疗的疗效受到关注。CAPITAL DOREMI 试验 ** 的二次分析发现,在开始强心剂治疗前 24h 接受 β- 受体阻滞剂治疗的患者中,多巴酚丁胺与米力农之间的预后并无差异 [35&&]。事实上,β 受体阻滞剂队列显示心脏骤停复苏和死亡较少,有室性心律失常较少的趋势。β- 受体阻滞剂的使用可能会产生反常的保护作用,专门的临床试验将有助于描述这一发现。
# 米力农
米力农是一种正性肌力药物,广泛用于终末期心力衰竭和 CS 患者。最初于 20 世纪 80 年代获批使用,该药物具有显著的使用经验和舒适感 [36]。米力农是一种磷酸二酯酶 - 3 抑制剂,可限制环磷酸腺苷 (cAMP) 的分解,增加蛋白激酶 a 的活化,并在细胞内转运钙,最终促进改善收缩性 [37]。剂量范围从 0.0625 至 0.5 μg/kg/min 以上,一些临床医生选择在开始时提供负荷剂量,通常保留给术中使用。在失代偿性心力衰竭患者中,观察到相似的稳态血浆水平和血流动力学获益,无论输注开始前 3h 开始推注。尽管餐时胰岛素组更早显示出血流动力学获益,但是与单独输注组相比,这些患者的低血压和心动过速更多 [38]。
米力农已在慢性心力衰竭人群中开展了最为广泛的研究,随机化数据表明,48h 米力农输注与安慰剂治疗患者之间的发病率或死亡率并无差异。然而,米力农治疗患者中新发房性心律失常和需要干预的持续性低血压的发生率升高 [39]。有趣的是,作者注意到,与非缺血性心肌病相比,米力农治疗缺血性心肌病患者的预后较差 [40],强调了对按 CS 病因分类的专门临床试验的需求。Lewis 等人的回顾性研究在 CS 患者中对米力农与多巴酚丁胺作为初始正性肌力药物进行了比较,发现这两种正性肌力药物具有相似的有效性和安全性特征,但不良事件的类型大多数不同,多巴酚丁胺治疗患者报告了更多的心律失常 [33]。最近,CAPITAL DOREMI** 试验在 SCAI 类 B-E CS 中对多巴酚丁胺和米力农进行了比较,发现米力农在降低复合预后或任何个体预后方面并不优于多巴酚丁胺,包括全因住院死亡、需要新的肾脏替代治疗、需要心脏移植或 MCS 或心脏骤停复苏。与之前的回顾性研究相反,作为累积药理学支持指标的心率、MAP 或血管活性药物评分 (VIS) 没有显著差异 [41&]。连续乳酸盐测量对 CS 具有诊断、治疗和预后价值,近期证据支持乳酸盐清除率可替代住院死亡率 [42]。CAPITAL DOREMI 试验的事后分析发现,早在入组后 8h,多个乳酸盐参数与 30 天死亡率相关,包括完全乳酸盐清除率 (CLC)、乳酸盐清除率百分比和每小时乳酸盐清除率百分比。但是,在入组后 8-24h 的所有时间点,CLC 是生存期的最强预测因素 [43&]。
# 左氧氟沙星
左西孟旦是一种钙增敏剂,可与心肌肌钙蛋白 C 结合,提高不依赖于细胞内钙水平升高的收缩力 [44]。左西孟旦还可开放三磷酸腺苷敏感钾通道,导致系统性血管舒张 [45]。首选左西孟旦治疗 CS 的原因之一是其对 β- 肾上腺素能受体的影响极小 [44,46],理论上可降低心肌需氧量并降低快速性心律失常的风险。剂量范围介于 0.05-0.2 μg/kg/min [15]。尽管尚未在北美上市,欧洲心脏病学会建议首选左西孟旦或其他 III 型磷酸二酯酶抑制剂,因为它们可降低心脏充盈压,在接受 β- 受体阻滞剂治疗的患者中,因为它们通过不同的生理途径发挥作用 [47]。已在多项 RCT 中将左西孟旦与多巴酚丁胺进行比较,但患者大多为 SCAI A 类,而不是休克严重程度更高的患者。这些试验已证明,利钠肽可改善血流动力学并降低利钠肽水平,但未显示出有意义的死亡率改善 [48,49]。LevoHeartShock**(NCT04020263) 的结果,将比较早期使用左西孟旦与安慰剂在接受血管加压药治疗(一线疗法为去甲肾上腺素 - 多巴酚丁胺联合治疗)的 CS 患者中的疗效,将为其在这一特殊患者人群中的疗效和安全性提供更多的信息 [50&&]。
# 结论
CS 仍然具有较高的发病和死亡风险。药物治疗的主要内容在于血管加压药和正性肌力药,尽管在 CS 人群中专门和比较的证据仍然很少。常见的正性肌力药物包括多巴酚丁胺、米力农和左西孟旦,每种药物都有各自的血流动力学和临床获益与风险。关于正性肌力药物治疗的第二个最紧急的问题是药物是否同样有效、无效或有害。我们希望通过即将进行的试验 CAPITAL DOREMI2 回答这一问题,该试验将在休克初始复苏时将 SCAI C/D 级 CS 随机分配至强心剂或安慰剂组。还需要进一步研究,确定递增使用 MCS 时,正性肌力药物治疗如何适合 CS 模型。最后,正性肌力药物的选择必须由医生的经验、可用性、费用以及最重要的是个体患者对治疗的反应来指导。
# REFERENCES
DETAILS
Reynolds HR, Hochman JS. Cardiogenic shock. Circulation 2008; 117:686-697.
Fincke R, Hochman JS, Lowe AM, et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: a report from the SHOCK trial registry. J Am Coll Cardiol 2004; 44:340-348.
Naidu SS, Baran DA, Jentzer JC, et al. SCAI SHOCK Stage Classification Expert Consensus Update: a review and incorporation of validation studies. J Am Coll Cardiol 2022; 79:933-946.
4[■]. Jung RG, Di Santo P, Mathew R, et al. Implications of myocardial infarction on management and outcome in cardiogenic shock. J Am Heart Assoc 2021; 10:e021570.
This study outlines a heterogeneity of outcomes between AMI and non-AMI CS patients, supporting that future trials should consider studying interventions in specific subgroups of CS.
5[■]. Parlow S, Weng W, Di Santo P, et al. Significant valvular dysfunction and outcomes in cardiogenic shock: insights from the randomized DOREMI trial. Can J Cardiol 2022; S0828-282X (22)00220-3.
This study finds significant valvular dysfunction is associated with poorer outcomes in CS, highlighting how different etiologies of CS impact outcomes.
Hochman JS, Sleeper LA, Webb JG, et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med 1999; 341:625-634.
Thiele H, Zeymer U, Neumann FJ, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med 2012; 367:1287-1296.
Alexander JH, Reynolds HR, Stebbins AL, et al. TRIUMPH Investigators. Effect of tilarginine acetate in patients with acute myocardial infarction and cardiogenic shock: the TRIUMPH randomized controlled trial. JAMA 2007; 297:1657-1666.
Thiele H, Ohman EM, Desch S, et al. Management of cardiogenic shock. Eur Heart J 2015; 36:1223-1230.
Ibanez B, James S, Agewall S, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2018; 39:119-177.
Levy B, Bastien O, Karim B, et al. Experts' recommendations for the management of adult patients with cardiogenic shock. Ann Intensive Care 2015; 5:52.
van Diepen S, Katz JN, Albert NM, et al. Contemporary management of cardiogenic shock: a scientific statement From the American Heart Association. Circulation 2017; 136:e232-e268.
Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37:2129-2200.
Zeymer U, Bueno H, Granger CB, et al. Acute Cardiovascular Care Association position statement for the diagnosis and treatment of patients with acute myocardial infarction complicated by cardiogenic shock: A document of the Acute Cardiovascular Care Association of the European Society of Cardiology. Eur Heart J Acute Cardiovasc Care 2020; 9:183-197.
Overgaard CB, Dzavik V. Inotropes and vasopressors. Circulation 2008; 118:1047-1056.
Levy B, Buzon J, Kimmoun A. Inotropes and vasopressors use in cardiogenic shock: when, which and how much? Curr Opin Crit Care 2019; 25:384-390.
Levy B, Klein T, Kimmoun A. Vasopressor use in cardiogenic shock. Curr Opin Crit Care 2020; 26:411-416.
Levy B, Bollaert PE, Charpentier C, et al. Comparison of norepinephrine and dobutamine to epinephrine for hemodynamics, lactate metabolism, and gastric tonometric variables in septic shock: a prospective, randomized study. Intensive Care Med 1997; 23:282-287.
Levy B, Gibot S, Franck P, et al. Relation between muscle Na+K+ ATPase activity and raised lactate concentrations in septic shock: a prospective study. Lancet 2005; 365:871-875.
Allwood MJ, Cobbold AF, Ginsburg J. Peripheral vascular effects of noradrenaline, isopropylnoradrenaline and dopamine. Br Med Bull 1963; 19:132-136.
Russell JA. Vasopressor therapy in critically ill patients with shock. Intensive Care Med 2019; 45:1503-1517.
Tarvasmaki T, Lassus J, Varpula M, et al. Current real-life use of vasopressors and inotropes in cardiogenic shock - adrenaline use is associated with excess organ injury and mortality. Crit Care 2016; 20:208.
Levy B, Clere-Jehl R, Legras A, et al. Epinephrine versus norepinephrine for cardiogenic shock after acute myocardial infarction. J Am Coll Cardiol 2018; 72:173-182.
Wallace AW, Tunin CM, Shoukas AA. Effects of vasopressin on pulmonary and systemic vascular mechanics. Am J Physiol-Heart Circ Physiol 1989; 257:H1228-H1234.
Jeon Y, Ryu JH, Lim YJ, et al. Comparative hemodynamic effects of vasopressin and norepinephrine after milrinone-induced hypotension in off-pump coronary artery bypass surgical patients. Eur J Cardiothorac Surg 2006; 29:952-956.
26[■]. Klein T, Grandmougin D, Liu Y, et al. Comparison of vasopressin versus norepinephrine in a pig model of refractory cardiogenic shock complicated by cardiac arrest and resuscitated with Veno-arterial ECMO. Shock 2021; 56:473-478.
The first experimental look at pure vasopressor versus inopressor therapy specifically in the CS population.
27[■]. University of Chicago. A Randomized Double Blind Trial of Vasoactive Drugs for the Management of Shock in the ICU [Internet]. clinicaltrials.gov; 2020 Nov [cited 2022 Jan 23]. Report No.: NCT02118467. Available from:
https://clinicaltrials.
An ongoing clinical trial comparing pure vasopressor vs inopressor therapy in a generalized shock population. If a cardiogenic shock subgroup included, it would be interesting to evaluate the efficacy of pure vasopressor therapy, since these medications are generally not used in cardiogenic shock.
De Backer D, Biston P, Devriendt J, et al. Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med 2010; 362:779-789.
Rui Q, Jiang Y, Chen M, et al. Dopamine versus norepinephrine in the treatment of cardiogenic shock. Medicine 2017; 96:e8402.
Jentzer JC, Hollenberg SM. Vasopressor and inotrope therapy in cardiac critical care. J Intensive Care Med 2021; 36:843-856.
Ashkar H, Adnan G, Makaryus AN. Dobutamine. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2022.
Caldicott LD, Hawley K, Heppell R, et al. Intravenous enoximone or dobutamine for severe heart failure after acute myocardial infarction: a randomized double-blind trial. Eur Heart J 1993; 14:696-700.
Lewis TC, Aberle C, Altshuler D, et al. Comparative effectiveness and safety between milrinone or dobutamine as initial inotrope therapy in cardiogenic shock. J Cardiovasc Pharmacol Ther 2019; 24:130-138.
Levy B, Perez P, Perny J, et al. Comparison of norepinephrine-dobutamine to epinephrine for hemodynamics, lactate metabolism, and organ function variables in cardiogenic shock. A prospective, randomized pilot study*. Crit Care Med 2011; 39:450-455.
35[■][■]. Di Santo P, Mathew R, Jung RG, et al. Impact of baseline beta-blocker use on inotrope response and clinical outcomes in cardiogenic shock: a subgroup analysis of the DOREMI trial. Crit Care 2021; 25:289.
The subgroup analysis shows a paradoxical protective effect of beta-blocker use. It raises the question of whether baseline beta-blocker use may actually improve response to inotropic therapy and clinical outcomes. With many cardiac patients on a baseline beta-blocker, this would be an important question to answer with a dedicated control trial.
Tariq S, Aronow WS. Use of inotropic agents in treatment of systolic heart failure. Int J Mol Sci 2015; 16:29060-29068.
Colucci WS, Wright RF, Braunwald E. New positive inotropic agents in the treatment of congestive heart failure. Mechanisms of action and recent clinical developments. 2 N Engl J Med 1986; 314:349-358.
Baruch L, Patacsil P, Hameed A, et al. Pharmacodynamic effects of milrinone with and without a bolus loading infusion. Am Heart J 2001; 141:266-273.
Cuffe MS, Califf RM, Adams KF, et al. Short-term intravenous milrinone for acute exacerbation of chronic heart failure: a randomized controlled trial. JAMA 2002; 287:1541-1547.
Felker GM, Benza RL, Chandler AB, et al. Heart failure etiology and response to milrinone in decompensated heart failure: results from the OPTIME-CHF study. J Am Coll Cardiol 2003; 41:997-1003.
41[■][■]. Mathew R, Di Santo P, Jung RG, et al. Milrinone as compared with dobutamine in the treatment of cardiogenic shock. N Engl J Med 2021; 385:516-525.
The most recent high-quality look at milrinone vs dobutamine as initial inotropic therapy in CS patients. With results showing no differences in clinical outcomes between the two inotropes, this outlines the need for a placebo-based trial to determine efficacy of the individual inotropes
- Fuernau G, Desch S, de Waha-Thiele S, et al. Arterial lactate in cardiogenic shock: prognostic value of clearance versus single values. JACC Cardiovasc Interv 2020; 13:2208-2216.
43[■]. Marbach JA, Di Santo P, Kapur NK, et al. Lactate clearance as a surrogate for mortality in cardiogenic shock: insights from the DOREMI Trial. J Am Heart Assoc 2022; 11:e023322.
This post hoc analysis of the DOREMI trial finds complete lactate clearance as a significant predictor of in-hospital mortality in CS patients. These results emphasize the utility of serial lactate measurements.
Kaheinen P, Pollesello P, Hertelendi Z, et al. Positive inotropic effect of levosimendan is correlated to its stereoselective Ca2+-sensitizing effect but not to stereoselective phosphodiesterase inhibition. Basic Clin Pharmacol Toxicol 2006; 98:74-78.
Yokoshiki H, Katsube Y, Sunagawa M, Sperelakis N. The novel calcium sensitizer levosimendan activates the ATP-sensitive K+ channel in rat ventricular cells. J Pharmacol Exp Ther 1997; 283:375-383.
Haikala H, Kaheinen P, Levijoki J, Linden IB. The role of cAMP- and cGMP-dependent protein kinases in the cardiac actions of the new calcium sensitizer, levosimendan. Cardiovasc Res 1997; 34:536-546.
McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; 42:3599-3726.
Follath F, Cleland JGF, Just H, et al. Efficacy and safety of intravenous levosimendan compared with dobutamine in severe low-output heart failure (the LIDO study): a randomised double-blind trial. Lancet 2002; 360:196-202.
Mebazaa A, Nieminen MS, Packer M, et al. Levosimendan vs dobutamine for patients with acute decompensated heart failure: the SURVIVE Randomized Trial. JAMA 2007; 297:1883-1891.
50[■][■]. Effect of Early Use of Levosimendan Versus Placebo on Top of a Conventional Strategy of Inotrope Use of a Combined Morbidity-mortality Endpoint in Patients with Cardiogenic Shock. ClinicalTrials.gov identifier: NCT04020263. Updated July 18, 2019. [cited 2022 Jan 23]. https://clinicaltrials.gov/ct2/show/NCT04020263
# 二尖瓣反流伴心源性休克患者的经导管缘对缘修复:一个新的治疗目标
综述目的
心源性休克伴明显二尖瓣返流提示预后较差,治疗选择有限。在此,我们回顾了有关心源性休克和二尖瓣返流患者的特征、管理、经导管边缘修复术 (TEER) 对血流动力学的影响以及临床预后的现有证据。
近期结果
几项观察性研究和系统综述证实了 TEER 在并发退行性或功能性二尖瓣返流的心源性休克中的可行性和安全性。由于心源性休克患者的风险特征,二尖瓣返流的手术干预仍然有限。在退行性和功能性二尖瓣返流患者中对 TEER 进行了研究,TEER 在重症人群中仍然可行。此外,TEER 与二尖瓣反流减少以及住院和长期死亡率改善相关。
总结
TEER 仍是并发严重二尖瓣返流的心源性休克的一种有前景的治疗选择,但需要额外的研究来确定患者和手术特征、血流动力学参数和最佳介入时间。此外,未来的随机对照试验正在进行中,以评价 TEER 相对于心源性休克和二尖瓣返流医学管理的潜在获益。
关键词
心源性休克、二尖瓣返流、死亡、经导管边缘修复
# 要点
・心源性休克和二尖瓣返流仍然与预后不良相关,治疗选择有限。
・手术干预的重点是心源性休克和退行性二尖瓣返流,功能性二尖瓣返流干预的证据有限。
・在心源性休克和二尖瓣返流患者中使用 TEER 与二尖瓣返流减少以及住院和长期死亡率改善相关。
・还需要进一步的随机对照试验来证实这些观察结果,并将二尖瓣返流确定为真正的治疗目标。
# 引言
心源性休克定义为心输出量不足导致全身灌注不足 [1]。传统上,大多数心源性休克发生在急性心肌梗死 (AMI) 的情况下,导致住院死亡率通常超过 50%[2&,3,4,5&,6-8,9&,10&]。然而,近十年来非 AMI 心源性休克的比例越来越普遍,原因有两个:首先,由于早期识别和干预 AMI 介导的事件以逆转心源性休克,ST 段抬高型心肌梗死 (STEMI) 的心源性休克发生率下降 [11,12&];其次,随着指南指导的药物治疗的进步和 AMI 后管理的改善,慢性心力衰竭的患病率不断升高 [11]。迄今为止,仅证实 AMI 背景下的早期血运重建可改善心源性休克的死亡率 [3,13-15]。
并发瓣膜性心脏病的心源性休克代表了治疗选择有限的具有挑战性的人群。具体而言,5-10% 的心源性休克患者存在中度至重度二尖瓣反流 (MR)[16,17],该人群通常存在手术干预的禁止风险,因为他们需要机械通气、正性肌力药、血管加压药或机械循环支持,代表了无既定治疗的队列 [9&,18,19]。在 SHOCK 试验中,AMI 并发心源性休克和重度二尖瓣返流患者接受了保守治疗,住院死亡率为 55%[14]。此外,二尖瓣返流的原因各不相同,可能是在累及瓣叶、腱索、乳头肌或二尖瓣环的疾病背景下的退行性二尖瓣返流 (DMR),或在进行性左心室 (LV) 重塑和乳头肌移位背景下的功能性二尖瓣返流 (FMR),由于缺血性或非缺血性心肌病,导致二尖瓣瓣叶发育不良和二尖瓣返流 [20,21]。传统上,FMR 中获益未知的特定 DMR 患者保留心源性休克中二尖瓣返流的外科手术 [22,23],而 DMR 和 FMR 中越来越多地使用经导管干预。
经导管二尖瓣缘对缘修复术 (TEER) 于 2013 年首次获得美国食品药品监督管理局批准,在 FMR 中越来越多地用于 LV 重塑,导致二尖瓣瓣叶接合不良 - 但是,值得注意的是,这些研究未纳入心源性休克患者 [21,24-27]。此外,认为具有二尖瓣外科手术高风险的明显症状性 DMR 患者可使用 TEER。许多观察性研究描述了 TEER 在心源性休克和 MR 患者中作为补救治疗的作用,证实了 TEER 作为安全替代方案的可行性 [[5&&,18,28,29][30&&,31&]]。在此,我们对有关心源性休克和二尖瓣返流患者特征、管理、TEER 对血流动力学的影响以及临床预后的现有证据进行了综述。
# 患者特征
心力衰竭和心源性休克的临床表现从需要机械循环支持的非卧床、无症状至血流动力学不稳定患者,以及可能的心脏移植。心血管造影和介入学会 (SCAI) 发布了心源性休克分类的共识声明,以表明休克严重程度和死亡风险预测 [32],分为 a 期(风险)、B 期(开始)、C 期(典型)、D 期(恶化)和 E 期(濒死状态)心源性休克 [32,33]。传统上,心源性休克和瓣膜性心脏病患者预后的证据仅限于小型病例系列研究和观察性研究,见表 1 [18,28,29,34-46],因为住院死亡率较高(范围为 55-58%),这些研究通常被排除在随机临床试验之外 [16,47]。
在有显著 MR 的心源性休克情况下,患者的临床特征不同于孤立性 LV 衰竭,因为患者更可能为女性,就诊时 ECG 结果缺血较少,下壁和后壁 MI 的患病率较高,且心源性休克延迟就诊 [16]。此外,对 MR 中 TEER 进行的全面系统审查强调了危重人群的严重程度,这些人群通常具有禁止手术的风险,其 INTERMACS 评分较低 (3.1),28.2% 表现为 AMI,24.8% 表现为急性二尖瓣返流,超过 30% 为 SCAI D 期或以上。此外,78.7% 的患者具有正性肌力药物依赖性,50.4% 的患者在 TEER 之前需要机械循环支持 [5&&]。最近,一项回顾性国际登记研究对 TEER 和外科二尖瓣修复与保守治疗进行了比较,显示 TEER 和外科二尖瓣修复均改善了生存率 [30&&]。在本项观察性研究中,作者列出了相似重症人群的数据,包括 471 例平均年龄为 73 岁的患者,其中 50% 的 Killip 分级至少为 3 级,35% 为心源性休克,49% 接受机械循环支持,支持以下观点:TEER 越来越多地用于该高风险队列。
表 1. 评价心源性休克和二尖瓣反流情况下死亡率的研究
| Conservative | Surgery | TEER | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| First author | Year | Study type | Age | Male (%) | Intervention performed | N | In-hospital mortality | 1-year mortality | Hospitalization | N | In-hospital mortality | 1-year mortality | Hospitalization | N | NNNIn-hospital mortality | 1-year mortality | Hospitalization | MR grade < 2(%) |
| Pleger (1) | 2013 | Acute MR (n = 6) | 69 土 7 | 5 (83) | TEER | N/A | N/A | N/A | N/A | N/A | N/A | N/A | N/A | 6 | N/A | 3 (50) | N/A | 6 (100) |
| Estevez-Loureiro (2) | 2015 | Acute MR (n = 5) | 68 土 10 | N/A | TEER | N/A | N/A | N/A | N/A | N/A | N/A | N/A | N/A | 5 | 1 (20) | 1 (20) | N/A | 5 (100 |
| Adamo (3) | 2015 | Cardiogenic shock (n = 16) | 69 土 13 | 12(75) | TEER | N/A | N/A | N/A | N/A | N/A | N/A | N/A | N/A | 16 | 1 (6) | 3(19) | N/A | 13 (81 |
| Flint (4) | 2018 | Acute MR -cardiogenic shock (n = 12) | 71.7 土 12.8 | 9(75) | TEER | N/A | N/A | N/A | N/A | N/A | N/A | N/A | N/A | 12 | 1 (8) | 30-days: 2(17) | N/A | 12(10( |
| Kesler (5) | 2018 | Both DMR and FMR (n = 34) | 67.3 | 25 (74) | TEER | N/A | N/A | N/A | N/A | N/A | N/A | N/A | N/A | 34 | 0(0) | 6 months:3 (9) | 6 months:9 (27) | N/A |
| Medvedovsky (6) | 2019 | Functional MR (n = 6) | 69.2 | 4(67) | TEER | N/A | N/A | N/A | N/A | N/A | N/A | N/A | N/A | 6 | 1 (13) | 3 (50) | N/A | 5 (83) |
| Chan (7) | 2019 | Functional MR (n = 27) | 71.0 土 13.0 | 17 (63) | TEER | N/A | N/A | N/A | N/A | N/A | N/A | N/A | N/A | 27 | 8 (30) | 6 months:17 (63) | N/A | 25 (93 |
| 日 iaz (8) | 2019 | Acute MI (n = 4) | 75.8 土 4.6 | 0(0) | TEER | N/A | N/A | N/A | N/A | N/A | N/A | N/A | N/A | 4 | N/A | 1 (25) | N/A | N/A |
| Benito-Gonzalez (9) | 2021 | Both DMR and FMR (n = 17) | 76.7 | 10 (59) | TEER | N/A | N/A | N/A | N/A | N/A | N/A | N/A | N/A | 17 | 0(0) | 30-days:1 (6) | N/A | 17 (10 |
| Farwati (10) | 2021 | AMI versus no-AMI (n = 639) | 73 (63-81) | 383 (59.9) | TEER | N/A | N/A | N/A | N/A | N/A | N/A | N/A | N/A | 639 | 147 (23) | N/A | 30 days:113 (26.3) | N/A |
| Tang (11) | 2021 | DMR and FMR (n = 1192) | N/A | 688 (57.7) | TEER | 596 | 211 (35.4) | N/A | N/A | N/A | N/A | N/A | N/A | 596 | 148 (24.8) | N/A | N/A | N/A |
| Falasconi (12) | 2021 | DMR and FMR (n = 31) | 73 (66-78) | 23 (74) | TEER | N/A | N/A | N/A | N/A | N/A | N/A | N/A | N/A | 31 | 7(23) | 6 months:12 (39) | N/A | 27 (87 |
| Jung (13) | 2021 | DMR and FMR (n = 141) | 68.9 土 12.1 | 78 (55.3) | TEER | N/A | N/A | N/A | N/A | N/A | N/A | N/A | N/A | 141 | 22 (15.6) | 55 (42.6) | 26 (18.4) | 125 (88 |
| Haberman (14) | 2021 | DMR and FMR (n = 471) | 73 土 11 | 268 (56.9) | TEER and Surgery | 266 | 53 (20) | 96 (36) | N/A | 106 | 17(16) | 32 (31) | 6(6) | 99 | 6(6) | 16(17) | 13 (13) | 91 (92 |
| Lorusso (15) | 2008 | DMR (n = 279) | 62.6 土 14.4 | 106 (38) | Mitral valve repair or replacement | N/A | N/A | N/A | N/A | 279 | N/A | 30 days:63 (22.5) | N/A | N/A | N/A | N/A | N/A | N/A |
| Tavakoli (16) | 2002 | DMR(n = 21) | 62 土 10 | N/A | Mitral valve repair or replacement | N/A | N/A | N/A | N/A | 21 | N/A | 30 days: 4 (19) | N/A | N/A | N/A | N/A | N/A | N/A |
| Thompson (17) | 2000 | Acute severe DMR (n = 98) | 70.6 (64.4-77.0) | 47 (48) | Mitral valve repair or replacement | 51 | 36 (71) | N/A | N/A | 43 | 17 (40) | N/A | N/A | N/A | N/A | N/A | N/A | N/A |
| Massimi (18) | 2021 | Acute DMR (n = 214) | 66.9 土 10.5 | 156 (72.9) | Mitral valve repair or replacement | N/A | N/A | N/A | N/A | 214 | 53 (24.8) | N/A | N/A | N/A | N/A | N/A | N/A | N/A |
年龄 ± 标准差或(Q1 至 Q3)。
参考文献。
- Pleger ST, Chorianopoulos E, Krumsdorf U et al. Percutaneous edge-to-edge repair of mitral regurgitation as a bail-out strategy in critically ill patients. J Invasive Cardiol 2013;25:69 -- 72.
- Estevez-Loureiro R, Arzamendi D, Freixa X et al. Percutaneous mitral valve repair for acute mitral regurgitation after an acute myocardial infarction. J Am Coll Cardiol 2015;66:91 --92.
- Adamo M, Barbanti M, Curello S et al. Effectiveness of MitraClip therapy in patients with refractory heart failure. J Interv Cardiol 2015;28:61 -- 68.
- Flint K, Brieke A, Dominik W, John C. Percutaneous edge-to-edge mitral valve repair may rescue select patients in cardiogenic shock. Circ Conf 2018;138.
- Kesler M, Seeger J, Wohrle J et al. Intra-aortic balloon counterpulsation pump in heart failure patients during MitraClip implantation -- a propensity-score matched analysis. Catheter Cardiovasc Interv 2018;92:1433 -- 14
- Turyan Medvedovsky A, Tonchev I, Tahiroglu I et al. MitraClip therapy in critically ill patients with severe functional mitral regurgitation and refractory heart failure. Struct Heart 2019;3:296 -- 301.
- Chan V, Messika-Zeitoun D, Labinaz M et al. Percutaneous mitral repair as salvage therapy in patients with mitral regurgitation and refractory cardiogenic shock. Circ Cardiovasc Interv 2019;12:e008435.
- Eliaz R, Turyan A, Beeri R, Shuvy M. Utilization of intra-aortic balloon pump to allow MitraClip procedure in patients with noncoapting mitral valve leaflets: a case series. Eur Heart J Case Rep 2019;3:01.
- Benito-Gonzalez T, Estevez-Loureiro R, Villablanca PA et al. Percutaneous mitral valve repair vs. stand-alone medical therapy in patients with functional mitral regurgitation and heart failure. Cardiovasc Revasc Med 2019;25:25.
- Farwati M, Saad AM, Abushouk AI et al. Short-term outcomes following urgent transcatheter edge-to-edge repair with MitraClip in cardiogenic shock: a population-based analysis. JACC Cardiovasc Interv 2021;14:207 2078.
- Tang GHL, Estevez-Loureiro R, Yu Y et al. Survival following edge-to-edge transcatheter mitral valve repair in patients with cardiogenic shock: a nationwide analysis. J Am Heart Assoc 2021;10:e019882.
- Falasconi G, Melillo F, Pannone L et al. Use of edge-to-edge percutaneous mitral valve repair for severe mitral regurgitation in cardiogenic shock: a multicenter observational experience (MITRA-SHOCK study). Catheter Cardiovasc Interv 2021;98:E163 -- E170.
- Jung RG, Simard T, Kovach C et al. Transcatheter mitral valve repair in cardiogenic shock and mitral regurgitation: a patient-level, multicenter analysis. JACC Cardiovasc Interv 2021;14:1 --11.
- Haberman D, EstOvez-Loureiro R, Benito-Gonzalez T et al. Conservative, surgical, and percutaneous treatment for mitral regurgitation shortly after acute myocardial infarction. Eur Heart J 2021; 43:641 -650.
- Lorusso R, Gelsomino S, De Cicco G et al. Mitral valve surgery in emergency for severe acute regurgitation: analysis of postoperative results from a multicentre study. Eur J Cardiothorac Surg 2008;33:573 -- 582.
- Tavakoli R, Weber A, Brunner-La Rocca H et al. Results of surgery for irreversible moderate to severe mitral valve regurgitation secondary to myocardial infarction. Eur J Cardiothorac Surg 2002;21:818 -- 824.
- Thompson CR, Buller CE, Sleeper LA et al. Cardiogenic shock due to acute severe mitral regurgitation complicating acute myocardial infarction: a report from the SHOCK Trial Registry. SHould we use emergently revascularize Occluded Coronaries in cardiogenic shocK? J Am Coll Cardiol 2000;36:1104 -- 1109.
- Massimi G, Ronco D, De Bonis M et al. Surgical treatment for postinfarction papillary muscle rupture: a multicentre study. Eur J Cardiothorac Surg 2021; 61:469 -- 476.
DMR,退行性二尖瓣返流;FMR,功能性二尖瓣返流;MR,二尖瓣返流;TEER,经导管边缘修复。
# 病理生理学:血流动力学
FMR 常见于缺血性和非缺血性心肌病患者,原因是进行性整体或局部 LV 重塑,造成乳头肌位移,导致瓣叶适应不良和慢性二尖瓣返流 [23,48]。有效开口面积至少 20 mm2*、反流体积至少 30 mL 或缩脉宽度超过 0.4 cm 的患者与 FMR 预后不良相关,3 年死亡率为 50%[23,49]。同样,DMR 也有明确的超声心动图标准,有效开口面积至少 40 mm2,反流体积至少 60 mL,缩脉宽度至少 0.7 cm [23]。经皮或手术修复的生理效应导致 MR 降低,随后引起左心房压力、肺动脉压力和右心室后负荷降低,同时减少 LV 体积和扩张,增加前向心输出量以改善血流动力学状态 [50,51&]。因此,TEER 可作为 FMR 和 DMR 的挽救治疗,减少对血管加压药和 / 或正性肌力药物的依赖,同时也可作为心脏移植形式的长期管理的桥梁。
# 干预
# 外科手术二尖瓣修复或置换
从历史上看,AMI 后发生心源性休克和重度 MR 的患者的外科干预风险过高,尽管进行了二尖瓣置换术或修复,但住院死亡率仍超过 40%[16]。已经在 AMI 和 DMR 中描述了二尖瓣手术修复和置换 [23,52]。Lorusso et al. 的登记分析。证明二尖瓣手术与 26% 的院内死亡率相关,这与既往研究的范围 22-24% 相似 [52]。相反,在 FMR 情况下,手术干预的研究仍然很少,研究未显示死亡率改善,也未显示影响基础疾病的自然病程 [23,53,54]。
最近,一项 2001 年至 2019 年的登记分析揭示了在乳头肌破裂的情况下,相较于急诊(入院 24 小时内进行手术)和抢救(手术在送至手术室的途中需要进行心肺复苏)二尖瓣置换术 / 修复术,更多的紧急情况(在同一住院期间进行手术)[55]。在该队列中,超过 64.5% 的患者接受了 emer-gent / 手术修复,住院死亡率与 24.8% 的历史结果一致,尽管在过去二十年中死亡率没有显著的时间变化。重要的是,作者证实预后较差,心脏骤停和重度 LV 功能不全的急性表现分别与 47.4% 和 31.1% 的住院死亡率相关 [55]。尽管支持疗法在心源性休克中有显著改善,但其未影响二尖瓣手术的死亡率。此外,DMR 修复后的术后并发症仍然较为常见,26% 为急性肾损伤,8% 需要透析,15% 为房颤,22% 为感染,以及 8% 为脑血管意外 [55]。
需要谨慎解读证明 DMR 手术潜在获益的研究,因为大多数研究仅限于观察性研究,通常存在选择性偏倚,包括入选的患者具有更好的 LV 功能和更小的指数梗死 [16]。此外,尽管支持性治疗取得了一些进展,但未观察到死亡率的改善,术后并发症仍然频繁发生。除了一项研究 [52] 外,大多数研究都有固有偏倚,因为它们未能描述实施二尖瓣手术的环境,特别提出了选择偏倚的问题,因为手术被延迟至临床改善。最后,尽管心源性休克患者采用指南指导的药物治疗和干预后预后较差,但 FMR 在外科干预中的研究仍然很少。
# 经导管缘对缘修复:心源性休克中的新作用
由于 FMR 手术干预缺乏死亡率获益,因此开发了经导管干预来管理 FMR。里程碑试验证实了 TEER 在重度功能性和退行性二尖瓣返流情况下的安全性和有效性 [24-26],尤其是 COAPT 试验证实了 FMR 的生存获益。尽管 TEER 在 DMR 和 FMR 中均有证据,但其在心源性休克和 MR 背景中的效用仍不明确。尽管如此,2014 年至 2019 年,TEER 在美国越来越多地用作心源性休克和 MR 的治疗选择 [51&]。小型病例系列研究和观察性研究 [18,28,29,34-46] 已经显示了 TEER 作为心源性休克和显著 MR 患者挽救治疗的潜力(表 1)。考虑到胸外科医师协会评分较高 (> 15%)、INTERMACS 评分较低,并且依赖于暂时性机械循环支持(即,主动脉内气囊泵)和 / 或正性肌力药,该人群的手术风险通常无法接受 [5&,36]。
心源性休克和 MR 的 TEER 的住院死亡率低于预期,且围手术期并发症发生率较低。141 例患者的最大汇总患者水平分析证实了成功降低 MR 后 DMR 和 FMR 的手术安全性和有效性,院内死亡率降低 15.6%,心力衰竭住院率改善(图 1)[5&]。随后的登记分析和系统综述进一步证实了这一结果,TEER 成功后院内死亡率为 12-20%[31&,51&,56]。与该人群的历史住院死亡率(40% 为二尖瓣手术,60% 为保守治疗)相比 [16,31&],在治疗选择有限的队列中,TEER 似乎是一种有前景的挽救治疗,可改善住院和短期临床预后。尽管住院死亡率绝对下降,但一项登记分析显示,仅 33% 的患者在心源性休克入院后出院回家,突出了该重症人群的长期恢复过程 [51&]。
几个手术优势支持 TEER 作为 SCAI C-E 期心源性休克和 MR 的挽救治疗。具体而言,无需心肺转流术和显著较低的并发症特征可能超过通过手术修复实现的较好的 MR 减少。既往研究表明,与手术相比,TEER 显著降低了术后重大并发症(MI、卒中、心包填塞、再次干预、需要肾脏替代治疗的急性肾损伤、脓毒症或输血的复合终点)[30&]。最后,先前已证实 TEER 可改善 FMR 的死亡率 [24],FMR 是一个在手术人群中证据有限的队列。所有这些因素使得 TEER 在心源性休克患者中成为一种有吸引力的新兴疗法。
尽管如此,尽管短期死亡率有希望改善,但接受 TEER 的心源性休克患者在出院后继续发生不良事件,成功 TEER 后 1 年死亡率估计为 50%[5&&,31&,51&]。成功植入 TEER 后,1 年死亡率降至 39.7%,而未成功植入器械的患者则为 69.2%[5&&]。1 年时的高死亡率可能反映了基线时慢性肾病、慢性肺病、外周动脉疾病、2 型糖尿病和基础心肌病患病率较高的合并症队列 [5&&,31&]。在存活的患者中,随访时观察到纽约心脏病协会 (NYHA) 分级和生活质量显著改善。尽管需要对现有数据进行谨慎解释,但 TEER 似乎是一种有前景的假设生成干预,可以考虑作为心脏移植或心室辅助装置的桥接或辅助治疗 [31&]。在最初住院后 - 需要启动正在进行的积极治疗,以继续降低长期死亡率。

图 1. 在成功降低二尖瓣返流等级后,心源性休克和二尖瓣返流患者中经导管缘对缘修复对住院死亡率和心力衰竭住院率的影响。在行经导管边缘修复的患者中,按器械成功率对住院死亡率的累积发生率以及 90 天死亡率和因心力衰竭住院的复合发生率进行分层。经允许后复制 Jung et al.[5&&].
相反,尽管 TEER 的短期结果令人满意,但仍有几个问题尚未得到解答。观察性研究未阐明从入院到植入 TEER 的最佳时间线。Martinez-Gomez 等人 [31&] 估计入院至植入的中位时间为 22 天 [四分位距 (IQR)= 9-45 天],这可能是由于在机械循环支持和正性肌力药 / 血管加压药治疗的患者稳定后进行了 TEER。可以推测,在初步稳定后,仍有一个心源性休克患者队列,该队列因二尖瓣显著返流而存在持续性向后衰竭,TEER 将促进肺充血减轻,并允许正性肌力药物戒断 [57]。尚不清楚重度二尖瓣返流是否是心源性休克的主要介质或结果。此外,该组显示了脱离心脏和 / 或呼吸支持的中位时间为 2 天(IQR = 1-4 天)[31&]。尽管 TEER 似乎显示了住院和短期临床获益,但仍需要在该领域进行更多研究,以确定 TEER 之前的最佳患者特征、临床表现、血流动力学参数和自入院的时间,以充分了解在心源性休克和二尖瓣返流中 TEER 使该队列获益的人群和机制。
# 未来的方向
如观察性研究 [5&&,30&&,31&,51&] 所示,在有显著 MR 的心源性休克背景中使用 TEER 可能与死亡率获益相关。需要随机化试验来证实这些观察结果,并确定 MR 作为一种 bonafide 治疗靶标。将在一项 TEER 和医疗管理 (CAPITAL-MINOS) 的多中心随机对照试验中,以住院全因死亡率为主要预后,比较 TEER 和医疗管理 (CAPITAL-MINOS) 在严重二尖瓣反流 (3 +) 和心源性休克(SCAI C 期或 D 期)患者中的安全性和有效性。本研究结果待定,当前文献证明了 TEER 与该队列中短期生存期之间的相关性。
# 结论
心源性休克伴明显二尖瓣返流提示预后不良,治疗选择有限。在本综述中,我们强调了 TEER 在心源性休克和二尖瓣返流中的证据,因为其在技术上可行,并且与住院和短期临床预后的改善相关。观察性研究强调了 TEER 作为挽救治疗的潜力 - 尽管,未来的随机对照试验重点关注 TEER 相对于医疗管理的潜在获益。
# REFERENCES
DETAILS
- Van Diepen S, Katz JN, Albert NM, et al. Contemporary management of cardiogenic shock: a scientific statement from the American Heart Association. Circulation 2017; 136:e232-e268.
2[■]. Samsky MD, Morrow DA, Proudfoot AG, et al. Cardiogenic shock after acute myocardial infarction. JAMA 2021; 326:1840.
Recent review highlighting trends in acute myocardial infarction (AMI) complicated by cardiogenic shock.
Jung RG, Di Santo P, Mathew R, et al. Implications of myocardial infarction on management and outcome in cardiogenic shock. J Am Heart Assoc 2021; 10:e021570.
Thiele H, Akin I, Sandri M, et al. PCI strategies in patients with acute myocardial infarction and cardiogenic shock. N Engl J Med 2017; 377:2419-2432.
5[■][■]. Jung RG, Simard T, Kovach C, et al. Transcatheter mitral valve repair in cardiogenic shock and mitral regurgitation: a patient-level, multicenter analysis. JACC Cardiovasc Interv 2021; 14:1-11.
Comprehensive patient-level analysis showing the utility of transcatheter edge-to-edge repair (TEER) in cardiogenic shock and mitral regurgitation.
Thiele H, Ohman EM, de Waha-Thiele S, et al. Management of cardiogenic shock complicating myocardial infarction: an update. Eur Heart J 2019; 40:2671-2683.
Russo JJ, Aleksova N, Pitcher I, et al. Left ventricular unloading during extracorporeal membrane oxygenation in patients with cardiogenic shock. J Am Coll Cardiol 2019; 73:654-662.
Harjola VP, Lassus J, Sionis A, et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. Eur J Heart Fail 2015; 17:501-509.
9[■]. Mathew R, Di Santo P, Jung RG, et al. Milrinone as compared with dobutamine in the treatment of cardiogenic shock. N Engl J Med 2021; 385:516-525.
Trial highlighting difference in inotrope in cardiogenic shock.
10[■]. Di Santo P, Mathew R, Jung RG, et al. Impact of baseline beta-blocker use on inotrope response and clinical outcomes in cardiogenic shock: a subgroup analysis of the DOREMI trial. Crit Care 2021; 25:289.
Prognostic role of beta-blocker on clinical outcomes in cardiogenic shock.
- Benjamin EJ, Blaha MJ, Chiuve SE, et al. Heart disease and stroke statistics-2017 update: a report from the American Heart Association. Circulation 2017; 135:e146-e603.
12[■]. Berg DD, Bohula EA, Morrow DA. Epidemiology and causes of cardiogenic shock. Curr Opin Crit Care 2021; 27:401-408.
Recent review on trends in cardiogenic shock.
Hochman JS, Sleeper LA, Webb JG, et al. Early revascularization and long-term survival in cardiogenic shock complicating acute myocardial infarction. JAMA 2006; 295:2511-2515.
Hochman JS, Sleeper LA, Webb JG, et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. N Engl J Med 1999; 341:625-634.
Feistritzer H-J, Thiele H, Desch S. Cardiogenic shock: role of invasive cardiology. Curr Opin Crit Care 2020; 26:398-402.
Thompson CR, Buller CE, Sleeper LA, et al. Cardiogenic shock due to acute severe mitral regurgitation complicating acute myocardial infarction: a report from the SHOCK Trial Registry. SHould we use emergently revascularize Occluded Coronaries in cardiogenic shocK? J Am Coll Cardiol 2000; 36:1104-1109.
Thiele H, Ohman EM, Desch S, et al. Management of cardiogenic shock. Eur Heart J 2015; 36:1223-1230.
Flint K, Brieke A, Wiktor D, Carroll J. Percutaneous edge-to-edge mitral valve repair may rescue select patients in cardiogenic shock: findings from a single center case series. Catheter Cardiovasc Interv 2019; 94:E82-E87.
Rob D, Belohlavek J. The mechanical support of cardiogenic shock. Curr Opin Crit Care 2021; 27:440-446.
Stout KK, Verrier ED. Acute valvular regurgitation. Circulation 2009; 119:3232-3241.
Messika-Zeitoun D, Hibbert B, Chan V. 'Primary' percutaneous mitral valve repair in patients with acute myocardial infarction: is it ready for primetime? Eur Heart J 2021; 43:651-653.
Tavakoli R, Weber A, Brunner-La Rocca H, et al. Results of surgery for irreversible moderate to severe mitral valve regurgitation secondary to myocardial infarction. Eur J Cardiothorac Surg 2002; 21:818-824.
Asgar AW, Mack MJ, Stone GW. Secondary mitral regurgitation in heart failure: pathophysiology, prognosis, and therapeutic considerations. J Am Coll Cardiol 2015; 65:1231-1248.
Stone GW, Lindenfeld J, Abraham WT, et al. Transcatheter mitral-valve repair in patients with heart failure. N Engl J Med 2018; 379:2307-2318.
Feldman T, Foster E, Glower DD, et al. Percutaneous repair or surgery for mitral regurgitation. N Engl J Med 2011; 364:1395-1406.
Obadia JF, Messika-Zeitoun D, Leurent G, et al. Percutaneous repair or medical treatment for secondary mitral regurgitation. N Engl J Med 2018; 379:2297-2306.
Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS guidelines for the management of valvular heart disease. Eur Heart J 2017; 38:2739-2791.
Pleger ST, Chorianopoulos E, Krumsdorf U, et al. Percutaneous edge-to-edge repair of mitral regurgitation as a bail-out strategy in critically ill patients. J Invasive Cardiol 2013; 25:69-72.
Turyan Medvedovsky A, Tonchev I, Tahiroglu I, et al. MitraClip therapy in critically ill patients with severe functional mitral regurgitation and refractory heart failure. Struct Heart 2019; 3:296-301.
30[■][■]. Haberman D, Estevez-Loureiro R, Benito-Gonzalez T, et al. Conservative, surgical, and percutaneous treatment for mitral regurgitation shortly after acute myocardial infarction. Eur Heart J 2021; 43:641-650.
Comparison of surgery versus TEER versus medical management in cardiogenic shock following AMI.
31[■]. Martinez-Gomez E, McInerney A, Tirado-Conte G, et al. Percutaneous mitral valve repair with MitraClip device in hemodynamically unstable patients: a systematic review. Catheter Cardiovasc Interv 2021; 98:E617-E625.
Systematic review of TEER in cardiogenic shock and mitral regurgitation.
Baran DA, Grines CL, Bailey S, et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock: This document was endorsed by the American College of Cardiology (ACC), the American Heart Association (AHA), the Society of Critical Care Medicine (SCCM), and the Society of Thoracic Surgeons (STS) in April. Catheter Cardiovasc Interv 2019; 94:29-37.
Naidu SS, Baran DA, Jentzer JC, et al. SCAI SHOCK stage classification expert consensus update: a review and incorporation of validation studies. J Soc Cardiovasc Angiogr Interv 2022; 1:100008.
Adamo M, Barbanti M, Curello S, et al. Effectiveness of MitraClip therapy in patients with refractory heart failure. J Interv Cardiol 2015; 28:61-68.
Adamo M, Curello S, Chiari E, et al. Percutaneous edge-to-edge mitral valve repair for the treatment of acute mitral regurgitation complicating myocardial infarction: a single centre experience. Int J Cardiol 2017; 234:53-57.
Chan V, Messika-Zeitoun D, Labinaz M, et al. Percutaneous mitral repair as salvage therapy in patients with mitral regurgitation and refractory cardiogenic shock. Circ Cardiovasc Interv 2019; 12:e008435.
Di Prima AL, Covello DR, Franco A, et al. Do patients undergoing MitraClip implantation require routine ICU admission? J Cardiothorac Vasc Anesth 2014; 28:1479-1483.
Eliaz R, Turyan A, Beeri R, Shuvy M. Utilization of intra-aortic balloon pump to allow MitraClip procedure in patients with noncoapting mitral valve leaflets: a case series. Eur Heart J Case Rep 2019; 3:01.
Estevez-Loureiro R, Arzamendi D, Freixa X, et al. Percutaneous mitral valve repair for acute mitral regurgitation after an acute myocardial infarction. J Am Coll Cardiol 2015; 66:91-92.
Kesler M, Seeger J, Wohrle J, et al. Intra-aortic balloon counterpulsation pump in heart failure patients during MitraClip implantation: a propensity-score matched analysis. Cathet Cardiovasc Interv 2018; 92:1433-1438.
Samuel Del Castillo Garcia D, Carlos Minguito Carazo D, Tomas Benito Gonzalez D, et al. Outcomes following urgent percutaneous mitral valve repair: a single center observational study. Eur Heart JAcute Cardiovasc Care 2019; 8: (Suppl 1): 15-17.
Taramasso M, Denti P, Cioni M, et al. Percutaneous mitral valve repair in high-risk patients: single center experience. EuroIntervention 2012; N:N188.
Berardini A, Biagini E, Saia F, et al. Percutaneous mitral valve repair: the last chance for symptoms improvement in advanced refractory chronic heart failure? Int J Cardiol 2017; 228:191-197.
Buzzatti N, Taramasso M, Cioni M, et al. Mitraclip therapy in idiopathic vs ischemic dilated cardiomyopathy, a single center experience. J Am Coll Cardiol 2013; 1:B213.
Haberman D, Taramasso M, Czarnecki A, et al. Salvage MitraClip in severe secondary mitral regurgitation complicating acute myocardial infarction: data from a multicentre international study. Eur J Heart Fail 2019; 21:1161-1164.
Kovach CP, Bell S, Kataruka A, et al. Outcomes of urgent/emergent transcatheter mitral valve repair (MitraClip): a single center experience. Cathet Cardiovasc Interv 2021; 97:E402-E410.
Engstrom AE, Vis MM, Bouma BJ, et al. Mitral regurgitation is an independent predictor of 1-year mortality in ST-elevation myocardial infarction patients presenting in cardiogenic shock on admission. Acute Card Care 2010; 12:51-57.
Pierard LA, Carabello BA. Ischaemic mitral regurgitation: pathophysiology, outcomes and the conundrum of treatment. Eur Heart J 2010; 31:2996-3005.
Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014; 63:e57-e185.
Falasconi G, Melillo F, Pannone L, et al. Use of edge-to-edge percutaneous mitral valve repair for severe mitral regurgitation in cardiogenic shock: a multicenter observational experience (MITRA-SHOCK study). Catheter Cardiovasc Interv 2021; 98:E163-E170.
51[■]. Tang GHL, Estevez-Loureiro R, Yu Y, et al. Survival following edge-to-edge transcatheter mitral valve repair in patients with cardiogenic shock: a nationwide analysis. J Am Heart Assoc 2021; 10:e019882.
Registry analysis of TEER in cardiogenic shock.
Lorusso R, Gelsomino S, De Cicco G, et al. Mitral valve surgery in emergency for severe acute regurgitation: analysis of postoperative results from a multicentre study. Eur J Cardiothorac Surg 2008; 33:573-582.
Calafiore AM, Iaco AL, Gallina S, et al. Surgical treatment of functional mitral regurgitation. Int J Cardiol 2013; 166:559-571.
Milano CA, Daneshmand MA, Rankin JS, et al. Survival prognosis and surgical management of ischemic mitral regurgitation. Ann Thorac Surg 2008; 86:735-744.
Massimi G, Ronco D, De Bonis M, et al. Surgical treatment for postinfarction papillary muscle rupture: a multicentre study. Eur J Cardiothoracic Surg 2021; 61:469-476.
Farwati M, Saad AM, Abushouk AI, et al. Short-term outcomes following urgent transcatheter edge-to-edge repair with MitraClip in cardiogenic shock: a population-based analysis. JACC Cardiovasc Interv 2021; 14:2077-2078.
Lurz P, Besler C. Mitral regurgitation in cardiogenic shock. JACC Cardiovasc Interv 2021; 14:12-14.
# 机械循环支持治疗心源性休克
综述目的
心源性休克是一种以继发于心输出量减少的终末器官灌注不足为特征的疾病,与实质性死亡率相关。心源性休克的主要治疗方法是逆转基础病因,同时给予血管活性药物(血管加压药和正性肌力药)支持治疗。尽管采用了这些措施仍继续恶化的患者可能需要机械循环支持 (MCS)。在此,我们对可用于 MCS 的器械及其相关获益和风险进行了审查。
近期结果
尽管在全球范围内的使用越来越多,但很少有随机证据支持在心源性休克中常规使用任何特定 MCS 器械。主动脉内球囊反搏的一项大型随机试验未显示死亡率的短期或长期改善。仅在小型随机试验中评价了协助左心室卸载的 TandemHeart 和 Impella 器械,这些试验显示不良事件增加,而死亡率未改善。最后,静脉 - 动脉体外膜肺氧合(提供循环和呼吸支持),目前正在大型随机化临床试验中进行评价。
总结
MCS 在心源性休克中的各种器械可用,但常规使用没有高质量的随机证据支持。考虑到启动 MCS 所需的资源,这些治疗应仅限于具有心脏护理经验的中心,未来的研究应重点关注这些器械在临床实践中的作用(如果有)。
关键词
心源性休克、体外膜肺氧合、impella、主动脉内球囊反搏、机械循环支持
# 要点
・心源性休克与发病率和死亡率较高相关,对于药物治疗无效的患者,可以使用临时机械循环支持 (MCS) 装置。包括主动脉内球囊反搏 (IABP)、Tandem Heart、Impella 和静脉 - 动脉体外膜肺氧合 (VA-ECMO)。
・这些器械不会逆转心源性休克的潜在病因,因此可作为恢复、持久支持或心脏移植的桥梁。与这些器械相关的成本和资源利用率很高。
・目前,虽然有几项正在进行的随机试验有望提供更多的信息,但尚无随机证据支持使用这些器械。
・鉴于缺乏支持其疗效的证据,以及相关的成本和资源使用,未来的研究应侧重于这些器械在心源性休克管理中应发挥什么作用(如果有),尤其是在资源可能有限的情况下(如 COVID-19 大流行)。
# 引言
心源性休克定义为低心输出量状态,导致临床和生化终末器官灌注不足 [1,2]。心源性休克最常继发于心肌梗死(占所有心源性休克病例的 50%),但也可能由于各种其他原因而发生,包括扩张型心肌病、心肌炎、感染性休克或药物中毒 [3,4]。心源性休克患者可采用心血管造影和介入学会 (SCAI) 分类系统进行分类,根据低灌注程度和对支持的反应对患者进行风险分层 [5&,6]。SCAI 严重程度增加表明死亡可能性更高,D 级和 E 级患者的死亡率分别为 40% 和 67%[7]。
尽管总体发生率降低,但心源性休克的死亡率在过去几十年中保持相对稳定 [8-10],这可能与缺乏有效的治疗相关 [1]。治疗的重点是逆转基础病因。在继发于心肌梗死的心源性休克患者中,已证实早期对靶动脉进行血运重建可改善死亡率 [11,12]。除此之外,心源性休克的管理在很大程度上着重于支持性治疗,主要通过使用血管加压药和正性肌力药物。尽管去甲肾上腺素似乎是心源性休克中最有效的血管加压素 [13,14],但除左西孟旦外,支持使用任何特定正性肌力药物的数据有限 [15,16&&],左西孟旦在低严重程度休克患者中显示出一定疗效 [17]。因此,尽管采用了常规治疗,但患者可能进展为更严重的休克状态,并考虑暂时性机械循环支持 (MCS),包括主动脉内球囊反搏 (IABP)、TandemHeart (LivaNova PLC,London,UK)、Impella (Abiomed Inc.,Danvers,MA,USA) 和静脉动脉体外膜氧合 (VA-ECMO),其提供循环支持,并被认为是康复、持久性支持或心脏移植的桥梁 [18]。这些装置通过各种生理机制提供心脏 - 循环支持,最终寻求改善全身灌注,并可能减少 β- 肾上腺素能药物的危害。因此,其用途已在全球范围内扩展。在本文中,我们简要回顾了这些临时器械、它们的功能以及支持它们使用的证据,特别关注争议和未来研究的重要问题。
# 适应症和组织
目前,提供暂时性 MCS 适应症和时间指导的现有数据有限 [19,20]。这些器械的大多数随机试验都是小型的 [21,22],观察性研究有固有的局限性 [23]。然而,普遍的共识是,MCS 的使用应仅限于具有先进心脏功能的中心(理想情况下包括持久 MCS 和心脏移植)[24]。欧洲心脏病学会 (ESC) 建议由多学科休克团队制定启动暂时性 MCS 的决策 [25],尽管目前仅有观察性数据将这些团队的使用与患者预后改善相关联 [26,27]。
在患者选择方面,ESC 和美国心脏协会 (AHA) 的指南建议仅在真正的心源性休克患者中考虑 MCS(即,有组织灌注不良证据的患者),并且由于临时 MCS 器械的侵入性较小,应首选临时 MCS 器械,尤其是在重症患者中 [20,25]。未提及严格的选择标准,未指明相对于其他支持措施(即血管加压药和正性肌力药物)的最佳时机,强调了未来需要研究与接受暂时性 MCS 治疗心源性休克患者预后相关的预后因素。最后,应该注意的是,这些器械本身都不能逆转心源性休克的病因,因此仅应将其视为支持方法,直至恢复,或作为持久支持或心脏移植的过渡。
# 当前可用器械
表 1 列出了暂时性 MCS 最常用的市售器械,以及功能描述、适应症和最常见的并发症。
# 主动脉内球囊反搏泵
IABP 是全球用于心源性休克的最旧和最常见的临时 MCS 装置 [28]。IABP 经皮插入,通常通过股动脉插入。它由一个圆柱形聚氨酯球囊组成,位于降主动脉,距离左锁骨下动脉远端约 1-2 cm。其在心脏舒张(反搏)期间使用氦气扩张球囊,并在心脏收缩期间主动回缩球囊。与其他形式的 MCS 不同,通常使用肝素全身抗凝,但并非必须。值得注意的是,虽然 IABP 不会直接增加心输出量,但它确实对心源性休克有一些有益的影响。心脏舒张期间球囊膨胀导致冠状动脉灌注增加。心脏收缩时球囊回缩降低了左心室后负荷,降低了心肌需氧量,增加了心肌供氧。
表 1. 最常用的暂时性机械循环支持 (MCS) 形式、功能、适应症和最常见的并发症
| 器械 | 主动脉内球囊反搏 (IABP) | 串联心脏 | Impella | 静脉动脉体外膜肺氧合 (VA-ECMO) |
|---|---|---|---|---|
| 插入部位 | 股动脉 | 股静脉 | 股动脉(经皮)或腋窝 / 锁骨下动脉(手术切开) | 股静脉或颈静脉 |
| 目的地地址 | 近端降主动脉(左锁骨下动脉起点下方) | 左心房(通过从右心房的房间隔穿刺) | 穿过主动脉瓣和左心室内 | 腔静脉(下腔或上腔) |
| 功能描述 | 心脏舒张(反搏)期间膨胀,心脏收缩期间放气的球囊导管 | 从左心房引流血液并将其回输至股动脉的体外离心泵 | 从左心室抽取血液并将其排入升主动脉的微轴向泵 | 通过引流导管去除缺氧血液,通过膜氧合器进行气体交换,并将含氧血返回至中心(最常见的是股动脉)动脉 |
| 心源性休克的适应症 | 左心室衰竭 | 左心室衰竭;双心室衰竭 | 左心室衰竭;双心室衰竭 | 左心室衰竭;右心室衰竭;双心室衰竭;心脏骤停 |
| 全身抗凝治疗 | 通常使用,但可能避免 | 是 | 是 | 是 |
| 并发症 | 插入部位(感染、出血性血管穿孔)、夹层、肢体缺血 | 插入部位(感染、出血、血管穿孔)、动静脉瘘、血栓栓塞、肢体缺血 | 插入部位(感染、出血、血管穿孔)、溶血、肢体缺血 | 插入部位(感染、出血、血管穿孔)、颅内出血、缺血性卒中、肢体缺血、脓毒症、溶血 |
在用于心源性休克的所有临时 MCS 器械中,IABP 的研究最多。初始队列研究和登记研究发现,使用 IABP 可改善患者预后 [29],使人们对其获益持乐观态度,并扩大使用 IABP,尤其是在美国 [30]。然而,当在 IABP-SHOCK II 随机试验中展开时,使用 IABP 未改善继发于心肌梗死的心源性休克患者的 30 天、1 年或 6 年死亡率 [31-33]。该试验对常规 IABP 使用的获益提出了实质性的质疑,考虑到该器械相关的成本和资源利用,这一点尤为重要 [34]。因此,ESC 指南建议反对在心肌梗死继发性心源性休克患者中常规使用 IABP [35]。使用 IABP 是否能使特定患者人群获益(与其他形式的暂时性 MCS 相比,或完全不使用 MCS 的策略)仍是未来研究的一个重要领域。特别是,IABP-SHOCK II 试验排除了继发于机械原因的心源性休克患者(例如室间隔缺损、乳头肌破裂)和无心肌梗死的患者 [31]。尚不清楚这些人群是否可能从 IABP 使用中获益。
# TandemHeart
TandemHeart 是一种经皮心室辅助装置 (VAD)[36]。它由体外离心连续流泵组成,将血液从左心房排出,并泵入股动脉。TandemHeart 经股静脉插入右心房,穿过房间隔进入左心房。房间隔导管从左心房中抽出含氧血,并将其送回体外循环中的股动脉。因此,(含氧)血液大部分绕过左心室,降低心脏充盈压。这通常会导致心输出量和全身平均动脉压增加。仅在两项小型随机试验中对 TandemHeart 进行了评价,这两项试验共纳入 83 例患者 [21,37]。这些试验的确显示 TandemHeart 的血流动力学和代谢预后改善(与 IABP 相比),但以患者为中心的预后无任何改善。TandemHeart 的并发症发生率也较高,包括大出血和肢体缺血。
# Impella
Impella 是一种血管内微轴流泵,同样基于导管 [38]。经股动脉获得入路,Impella 穿过主动脉瓣放置在左心室内。微轴泵将左心室的血液泵出并将其泵入主动脉,以减轻左心室负荷并增加心输出量。与其他形式的 MCS 一样,Impella 的使用大幅增加,尤其是在美国,Impella 用于高风险经皮冠状动脉介入治疗,以及心源性休克 [39]。Impella 的成本和资源利用率很高 [40]。尽管如此,有限的证据支持 Impella 在改善患者导向预后方面的疗效,尤其是在心源性休克患者中。
观察性数据库研究尽管受到残余混杂因素的限制,但并未显示使用 Impella 与预后改善之间存在关联,实际上可能证实了危害证据 [41,42&]。两项小型随机试验在心源性休克患者中比较了 Impella 与 IABP,共计 73 例患者 [43,44]。这些试验均未显示使用 Impella 后以患者为中心的预后改善,这在随后的荟萃分析中得到证实 [22]。所有研究进一步表明,Impella 的并发症发生率高于 IABP。即将开展的 DanGer Shock 试验将是研究 Impella 在心源性休克中疗效的最大试验,计划招募 360 例患者 [45]。总之,目前的数据不支持 Impella 用于心源性休克,但可能有亚组患者从这种方法中获益。
# 静脉动脉体外膜肺氧合
与本综述中讨论的其他形式的 MCS 不同,VA-ECMO 是一种体外生命支持形式,可提供心脏和呼吸支持 [46]。尽管存在多种潜在结构,但 VA-ECMO 需要将引流导管插入中心静脉(通常是股静脉),以将缺氧血液从循环中排出(图 1)。然后将缺氧血泵入膜式氧合器,进行氧合和二氧化碳清除。含氧血通常返回至股动脉,在此逆流至主动脉。插管最好使用经皮技术,并发症比开放性手术方法更少 [47]。
与其他形式的 MCS 相似,全球范围内越来越多地使用 VA-ECMO 作为康复或移植的桥接 [48,49]。体外生命支持组织收集的数据报告了接受 VA-ECMO 治疗的患者死亡率改善 [50],人群研究表明,VA-ECMO 住院后存活下来的绝大多数患者 5 年后仍然存活 [51]。此外,虽然 VA-ECMO 的使用成本较高且资源密集,但幸存者出院后可能很少产生费用 [51]。较高的死亡率和资源利用率凸显了为 VA-ECMO 适当选择患者的重要性 [52]。已经提出了多种预后量表,包括 VA-ECMO 后生存 (SAVE) 评分 [53]。尽管外部验证 SAVE 评分的尝试结果不一致 [54,55],但该评分的各个组成部分(例如,年龄、心源性休克的病因、肾衰竭的存在、机械通气的持续时间)可用于估计 VA-ECMO 在心源性休克个体患者中的获益。
迄今为止,大多数支持使用 VA-ECMO 治疗 MCS 的数据来自观察性数据集。这些队列研究的大多数表明,与无 MCS 相比,在心源性休克中使用 VA-ECMO 与短期死亡率改善相关 [46,55,56]。随后的荟萃分析也证实了这一点 [23]。

图 1. 可用于体外心肺复苏 (ECPR) 的静脉 - 动脉体外膜肺氧合回路描述。从股静脉排出缺氧血液(蓝色),通过膜式氧合器泵入,在此处进行气体交换。然后,含氧血(红色)返回股动脉和体循环。图片改编自 Abrams D,Combes A,Brodie D. Extracorporeal Membrane Oxygenation in Cardiopulmonary Disease in Adults。美国心脏病杂志。2014;63:2769-2778.
然而,这些观察性研究受到混杂因素的限制。在 42 例继发于心肌梗死的心源性休克患者中实施的一项小型随机试验显示,与未实施 MCS 相比,VA-ECMO 带来了获益趋势,但该试验样本量太小,无法检测到死亡率的统计学显著改善 [57]。
在三项正在进行或即将进行的大型随机试验中检测 VA-ECMO 对心源性休克的疗效:EUROSHOCK (NCT03813134)、ECLS-shock (NCT03637205) 和 ANCHOR (NCT04184635)。这些试验将提供关于 VA-ECMO 风险和潜在获益的重要见解。然而,目前尚不清楚 VA-ECMO 与其他形式的 MCS(如 IABP、TandemHeart 和 Impella)相比的性能,这是未来工作的重要途径。此外,接受 VA-ECMO 的患者通常会出现心脏后负荷增加,可能会从左心室卸载方法中获益 [58]。因此,确定 VA-ECMO 联合 IABP 或 Impella 与单独使用相比是否可改善预后具有特殊意义。
最后,与其他形式的 MCS 一样,VA-ECMO 与心源性休克患者的重要并发症相关 [59],包括下肢缺血、骨筋膜室综合征或截肢;大出血、缺血性或出血性卒中和急性肾损伤。VA-ECMO 在心源性休克中的潜在获益是否超过这些已知并发症,将需要仔细审查随机临床试验的结果。
值得注意的是,VA-ECMO 也可以在心脏骤停期间启动,这被称为体外心肺复苏 (ECPR)[60]。尽管对 ECPR 的详细讨论超出了本综述的范围,但它仍然是一个活跃的研究领域,来自前瞻性数据集 [61] 的支持性证据,以及一项小型随机化试验 [62]。
# 伦理和资源影响
尽管 MCS 器械的应用前景在治疗心源性休克的新型方法方面产生了实质性的推动,但我们的综述证实,支持这些器械在这种情况下疗效的高水平证据相当有限。此外,我们还表明,使用这些器械需要大量资源和成本 [40,51]。这些因素引起了与使用 MCS 相关的重要考虑,尤其是在 2019 年冠状病毒病 (COVID-19) 大流行的情况下。
通常被认为具有 MCS 的心源性休克患者人群通常是最危重的(SCAI 分类 D-E),因此具有显著的住院死亡风险。通常在很短的时间内做出有关使用 MCS 的决定,并且对患者的预后了解不完全。用于 MCS 启动和管理的资源包括器械本身,以及与基础设施(例如,手术室、心导管插入术、重症监护室)和人员配备(例如,医生、护士、呼吸治疗师、灌注师)相关的费用。由于这些器械通常用于具有高级心脏能力的中心,提供 MCS 的费用可能来自其他护理领域(例如,由于专用手术室和灌注师)的手术费用。因此,需要优先选择 MCS 的最佳候选者,并且提供 MCS 不仅应基于候选者存活至出院的可能性,还应基于出院后的生活质量 [63]。这一点尤为重要,因为接受体外生命支持的患者很难停止维持生命治疗,因为患者通常可人为维持生命,且家人可能不清楚不良预后 [64]。姑息治疗和伦理学专家的参与在这些情况下可能特别有用 [65]。
由于各种原因,COVID-19 大流行对提供 MCS 提出了独特的挑战 [66]。首先,SARS-CoV-2 感染本身可能导致心脏并发症,包括心肌炎、心力衰竭和肺栓塞 [67,68]。这些情况均可能导致心源性休克,因此增加了对晚期治疗(如 MCS)的需求。目前,缺乏数据来帮助确定哪些 COVID-19 患者可能从 MCS 中获益最大,尤其是在伴随呼吸衰竭的情况下。其次,COVID-19 给全球的医疗保健系统造成了巨大的负担,尤其是重症监护 [69]。因此,提供需要大量资源和工作人员支持(例如 MCS)的重症监护干预措施的能力已经受损。尤其是在 COVID-19 继发难治性呼吸衰竭的治疗中,对体外生命支持的需求大幅增加 [70-73]。因此,资源有限可能需要在开始 MCS 治疗时更具选择性,并将这种治疗保留给最有可能获益的患者。或许现在比以往任何时候都更应该包括与 MCS 相关的决策,应该包括多学科团队,共同目标是利用现有资源优化全系统的结果。
# 结论
心源性休克的死亡风险较高,除心肌缺血情况下的血运重建外,治疗在很大程度上是支持性的。对于继续恶化的患者,可以使用 MCS 器械。这些器械包括 IABP、TandemHeart、Impella 和 VA-ECMO。每种器械都有相关的潜在优点和缺点,但是目前没有随机证据支持在难治性心源性休克的病例中常规使用任何器械。因此,这些器械的使用应仅限于能够提供先进心脏护理的专科中心。最后,这些器械应在相对于个体患者潜在获益的可用资源的背景下使用,并且在资源受限的情况下,例如在 COVID-19 流行期间,其使用可能受到限制。
# REFERENCES
DETAILS
Thiele H, Ohman EM, de Waha-Thiele S, et al. Management of cardiogenic shock complicating myocardial infarction: an update. Eur Heart J 2019; 40:2671-2683.
van Diepen S, Katz JN, Albert NM, et al. Contemporary management of cardiogenic shock: a scientific statement from the American Heart Association. Circulation 2017; 136:e232-e268.
Berg DD, Bohula EA, van Diepen S, et al. Epidemiology of shock in contemporary cardiac intensive care units. Circ Cardiovasc Qual Outcomes 2019; 12:e005618.
Harjola VP, Lassus J, Sionis A, et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. Eur J Heart Fail 2015; 17:501-509.
5[■][■]. Baran DA, Grines CL, Bailey S, et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock: This document was endorsed by the American College of Cardiology (ACC), the American Heart Association (AHA), the Society of Critical Care Medicine (SCCM), and the Society of Thoracic Surgeons (STS) in April. Catheter Cardiovasc Interv 2019; 94:29-37.
The initial SCAI classification system for risk-stratification and prognostication of patients with cardiogenic shock.
Naidu SS, Baran DA, Jentzer JC, et al. SCAI SHOCK Stage Classification Expert Consensus Update: A Review and Incorporation of Validation Studies: This statement was endorsed by the American College of Cardiology (ACC), American College of Emergency Physicians (ACEP), American Heart Association (AHA), European Society of Cardiology (ESC) Association for Acute Cardiovascular Care (ACVC), International Society for Heart and Lung Transplantation (ISHLT), Society of Critical Care Medicine (SCCM), and Society of Thoracic Surgeons (STS) in December 2021. J Am Coll Cardiol 2022; 79:933-946.
Jentzer JC, van Diepen S, Barsness GW, et al. Cardiogenic shock classification to predict mortality in the cardiac intensive care unit. J Am Coll Cardiol 2019; 74:2117-2128.
Goldberg RJ, Samad NA, Yarzebski J, et al. Temporal trends in cardiogenic shock complicating acute myocardial infarction. N Engl J Med 1999; 340:1162-1168.
Jeger RV, Radovanovic D, Hunziker PR, et al. Ten-year trends in the incidence and treatment of cardiogenic shock. Ann Intern Med 2008; 149:618-626.
Aissaoui N, Puymirat E, Delmas C, et al. Trends in cardiogenic shock complicating acute myocardial infarction. Eur J Heart Fail 2020; 22:664-672.
Hochman JS, Sleeper LA, Webb JG, et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med 1999; 341:625-634.
Thiele H, Akin I, Sandri M, et al. PCI strategies in patients with acute myocardial infarction and cardiogenic shock. N Engl J Med 2017; 377:2419-2432.
De Backer D, Biston P, Devriendt J, et al. Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med 2010; 362:779-789.
Levy B, Clere-Jehl R, Legras A, et al. Epinephrine versus norepinephrine for cardiogenic shock after acute myocardial infarction. J Am Coll Cardiol 2018; 72:173-182.
Mathew R, Visintini SM, Ramirez FD, et al. Efficacy of milrinone and dobutamine in low cardiac output states: systematic review and meta-analysis. Clin Investig Med 2019; 42:E26-32.
16[■][■]. Mathew R, Di Santo P, Jung RG, et al. Milrinone as compared with dobutamine in the treatment of cardiogenic shock. N Engl J Med 2021; 385:516-525.
Only randomized trial of inotropes in patients with SCAI C or higher level of shock, which did not demonstrate a difference in mortality with milrinone over dobutamine.
Koster G, Wetterslev J, Gluud C, et al. Effects of levosimendan for low cardiac output syndrome in critically ill patients: systematic review with meta-analysis and trial sequential analysis. Intensive Care Med 2015; 41:203-221.
Combes A, Price S, Slutsky AS, Brodie D. Temporary circulatory support for cardiogenic shock. Lancet 2020; 396:199-212.
Levy B, Bastien O, Karim B, et al. Experts' recommendations for the management of adult patients with cardiogenic shock. Ann Intensive Care 2015; 5:52.
Peura JL, Colvin-Adams M, Francis GS, et al. Recommendations for the use of mechanical circulatory support: device strategies and patient selection: a scientific statement from the American Heart Association. Circulation 2012; 126:2648-2667.
Burkhoff D, Cohen H, Brunckhorst C, O'Neill WW. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. Am Heart J 2006; 152: 469.e1-8.
Thiele H, Jobs A, Ouweneel DM, et al. Percutaneous short-term active mechanical support devices in cardiogenic shock: a systematic review and collaborative meta-analysis of randomized trials. Eur Heart J 2017; 38:3523-3531.
Ouweneel DM, Schotborgh JV, Limpens J, et al. Extracorporeal life support during cardiac arrest and cardiogenic shock: a systematic review and meta-analysis. Intensive Care Med 2016; 42:1922-1934.
Abrams D, Garan AR, Abdelbary A, et al. Position paper for the organization of ECMO programs for cardiac failure in adults. Intensive Care Med 2018; 44:717-729.
Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail 2016; 18:891-975.
Taleb I, Koliopoulou AG, Tandar A, et al. Shock team approach in refractory cardiogenic shock requiring short-term mechanical circulatory support: a proof of concept. Circulation 2019; 140:98-100.
Tehrani BN, Truesdell AG, Sherwood MW, et al. Standardized team-based care for cardiogenic shock. J Am Coll Cardiol 2019; 73:1659-1669.
Moulopoulos SD, Topaz S, Kolff WJ. Diastolic balloon pumping (with carbon dioxide) in the aorta--a mechanical assistance to the failing circulation. Am Heart J 1962; 63:669-675.
Unverzagt S, Buerke M, de Waha A, et al. Intra-aortic balloon pump counterpulsation (IABP) for myocardial infarction complicated by cardiogenic shock. Cochrane Database Syst Rev 2015; 2015:Cd007398.
Kolte D, Khera S, Aronow WS, et al. Trends in incidence, management, and outcomes of cardiogenic shock complicating ST-elevation myocardial infarction in the United States. J Am Heart Assoc 2014; 3:e000590.
Thiele H, Zeymer U, Neumann FJ, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med 2012; 367:1287-1296.
Thiele H, Zeymer U, Neumann FJ, et al. Intra-aortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock (IABP-SHOCK II): final 12 month results of a randomised, open-label trial. Lancet 2013; 382:1638-1645.
Thiele H, Zeymer U, Thelemann N, et al. Intraaortic balloon pump in cardiogenic shock complicating acute myocardial infarction: long-term 6-year outcome of the randomized IABP-SHOCK II Trial. Circulation 2018.
Schuster A, Faulkner M, Zeymer U, et al. Economic implications of intra-aortic balloon support for myocardial infarction with cardiogenic shock: an analysis from the IABP-SHOCK II-trial. Clin Res Cardiol 2015; 104:566-573.
Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2018; 39:119-177.
Kar B, Gregoric ID, Basra SS, et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. J Am Coll Cardiol 2011; 57:688-696.
Thiele H, Sick P, Boudriot E, et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. Eur Heart J 2005; 26:1276-1283.
Chera HH, Nagar M, Chang NL, et al. Overview of Impella and mechanical devices in cardiogenic shock. Expert Rev Med Dev 2018; 15:293-299.
Amin AP, Spertus JA, Curtis JP, et al. The evolving landscape of impella use in the United States among patients undergoing percutaneous coronary intervention with mechanical circulatory support. Circulation 2020; 141:273-284.
Fernando SM, Qureshi D, Tanuseputro P, et al. Long-term mortality and costs following use of Impella(R) for mechanical circulatory support: a population-based cohort study. Can J Anaesth 2020; 67:1728-1737.
Schrage B, Ibrahim K, Loehn T, et al. Impella support for acute myocardial infarction complicated by cardiogenic shock. Circulation 2019; 139:1249-1258.
42[■]. Dhruva SS, Ross JS, Mortazavi BJ, et al. Association of use of an intravascular microaxial left ventricular assist device vs intra-aortic balloon pump with in-hospital mortality and major bleeding among patients with acute myocardial infarction complicated by cardiogenic shock. JAMA 2020; 323:734-745.
Seyfarth M, Sibbing D, Bauer I, et al. A randomized clinical trial to evaluate the safety and efficacy of a percutaneous left ventricular assist device versus intra-aortic balloon pumping for treatment of cardiogenic shock caused by myocardial infarction. J Am Coll Cardiol 2008; 52:1584-1588.
Ouweneel DM, Eriksen E, Sjauw KD, et al. Percutaneous mechanical circulatory support versus intra-aortic balloon pump in cardiogenic shock after acute myocardial infarction. J Am Coll Cardiol 2017; 69:278-287.
Udesen NJ, Moller JE, Lindholm MG, et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. Am Heart J 2019; 214:60-68.
Combes A, Leprince P, Luyt CE, et al. Outcomes and long-term quality-of-life of patients supported by extracorporeal membrane oxygenation for refractory cardiogenic shock. Crit Care Med 2008; 36:1404-1411.
Danial P, Hajage D, Nguyen LS, et al. Percutaneous versus surgical femoro-femoral veno-arterial ECMO: a propensity score matched study. Intensive Care Med 2018; 44:2153-2161.
Brodie D, Slutsky AS, Combes A. Extracorporeal life support for adults with respiratory failure and related indications: a review. JAMA 2019; 322:557-568.
Karagiannidis C, Brodie D, Strassmann S, et al. Extracorporeal membrane oxygenation: evolving epidemiology and mortality. Intensive Care Med 2016; 42:889-896.
Thiagarajan RR, Barbaro RP, Rycus PT, et al. Extracorporeal life support organization registry international report. Asaio j 2017; 63:60-67.
Fernando SM, Qureshi D, Tanuseputro P, et al. Mortality and costs following extracorporeal membrane oxygenation in critically ill adults: a population-based cohort study. Intensive Care Med 2019; 45:1580-1589.
Aissaoui N, Luyt CE, Leprince P, et al. Predictors of successful extracorporeal membrane oxygenation (ECMO) weaning after assistance for refractory cardiogenic shock. Intensive Care Med 2011; 37:1738-1745.
Schmidt M, Burrell A, Roberts L, et al. Predicting survival after ECMO for refractory cardiogenic shock: the survival after veno-arterial-ECMO (SAVE)-score. Eur Heart J 2015; 36:2246-2256.
Chen WC, Huang KY, Yao CW, et al. The modified SAVE score: predicting survival using urgent veno-arterial extracorporeal membrane oxygenation within 24 h of arrival at the emergency department. Crit Care 2016; 20:336.
Muller G, Flecher E, Lebreton G, et al. The ENCOURAGE mortality risk score and analysis of long-term outcomes after VA-ECMO for acute myocardial infarction with cardiogenic shock. Intensive Care Med 2016; 42:370-378.
Sheu JJ, Tsai TH, Lee FY, et al. Early extracorporeal membrane oxygenator-assisted primary percutaneous coronary intervention improved 30-day clinical outcomes in patients with ST-segment elevation myocardial infarction complicated with profound cardiogenic shock. Crit Care Med 2010; 38:1810-1817.
Brunner S, Guenther SPW, Lackermair K, et al. Extracorporeal life support in cardiogenic shock complicating acute myocardial infarction. J Am Coll Cardiol 2019; 73:2355-2357.
Russo JJ, Aleksova N, Pitcher I, et al. Left ventricular unloading during extracorporeal membrane oxygenation in patients with cardiogenic shock. J Am Coll Cardiol 2019; 73:654-662.
Cheng R, Hachamovitch R, Kittleson M, et al. Complications of extracorporeal membrane oxygenation for treatment of cardiogenic shock and cardiac arrest: a meta-analysis of 1,866 adult patients. Ann Thorac Surg 2014; 97:610-616.
Abrams D, MacLaren G, Lorusso R, et al. Extracorporeal cardiopulmonary resuscitation in adults: evidence and implications. Intensive Care Med 2022; 48:1-15.
Bartos JA, Grunau B, Carlson C, et al. Improved survival with extracorporeal cardiopulmonary resuscitation despite progressive metabolic derangement associated with prolonged resuscitation. Circulation 2020; 141:877-886.
Yannopoulos D, Bartos J, Raveendran G, et al. Advanced reperfusion strategies for patients with out-of-hospital cardiac arrest and refractory ventricular fibrillation (ARREST): a phase 2, single centre, open-label, randomised controlled trial. Lancet 2020; 396:1807-1816.
Brodie D, Curtis JR, Vincent JL, et al. Treatment limitations in the era of ECMO. Lancet Respir Med 2017; 5:769-770.
Abrams DC, Prager K, Blinderman CD, et al. Ethical dilemmas encountered with the use of extracorporeal membrane oxygenation in adults. Chest 2014; 145:876-882.
Bein T, Brodie D. Understanding ethical decisions for patients on extracorporeal life support. Intensive Care Med 2017; 43:1510-1511.
Supady A, Badulak J, Evans L, et al. Should we ration extracorporeal membrane oxygenation during the COVID-19 pandemic? Lancet Respir Med 2021; 9:326-328.
Driggin E, Madhavan MV, Bikdeli B, et al. Cardiovascular considerations for patients, healthcare workers, and health systems during the COVID-19 pandemic. J Am Coll Cardiol 2020; 75:2352-2371.
Pham DT, Toeg H, De Paulis R, Atluri P. Establishment and management of mechanical circulatory support during the COVID-19 Pandemic. Circulation 2020; 142:10-13.
Karagiannidis C, Mostert C, Hentschker C, et al. Case characteristics, resource use, and outcomes of 10 021 patients with COVID-19 admitted to 920 German hospitals: an observational study. Lancet Respir Med 2020; 8:853-862.
Ramanathan K, Antognini D, Combes A, et al. Planning and provision of ECMO services for severe ARDS during the COVID-19 pandemic and other outbreaks of emerging infectious diseases. Lancet Respir Med 2020; 8:518-526.
Barbaro RP, MacLaren G, Boonstra PS, et al. Extracorporeal membrane oxygenation support in COVID-19: an international cohort study of the Extracorporeal Life Support Organization registry. Lancet 2020; 396:1071-1078.
Ramanathan K, Shekar K, Ling RR, et al. Extracorporeal membrane oxygenation for COVID-19: a systematic review and meta-analysis. Crit Care 2021; 25:211.
Barbaro RP, MacLaren G, Boonstra PS, et al. Extracorporeal membrane oxygenation for COVID-19: evolving outcomes from the international Extracorporeal Life Support Organization Registry. Lancet 2021; 398:1230-1238.
# 心源性休克预后:替代终点的作用
综述目的
早期血运重建、侵入性血流动力学特征和开始临时机械循环支持 (MCS) 均已成为心源性休克 (CS) 管理的常规组成部分。尽管在临床实践中不断取得进展,但患者选择和治疗开始的时机仍是实现 CS 预后持续改善的重要障碍。通过治疗算法的开发,近期标准化 CS 管理的努力在很大程度上依赖于替代终点来驱动治疗决策。本综述旨在对临床试验常用的替代终点和 CS 管理算法的证据基础进行综述。
近期结果
来自观察性和随机化队列的近期出版物已证实替代终点在对 CS 患者进行风险分层中的效用。尤其是,使用肺动脉导管指导 MCS 启动和撤机的侵入性血流动力学、预示即将发生终末器官衰竭的生化标志物以及结合了多个血流动力学和实验室参数的临床风险评分已证实具有预测 CS 患者预后的能力。
总结
尽管还需要进一步的验证,但多个临床、血流动力学和生化标志物已证实可作为 CS 的替代终点,这无疑将帮助医生做出临床决策。
关键词
心源性休克、血流动力学、乳酸盐、预后、替代终点
# 要点
・临床、血流动力学和生化参数已被确定为心源性休克预后的替代终点。
・替代标志物识别的效用不仅限于简单的风险预测,还包括在临床决策范围内。
・未来的研究必须结合我们对心源性休克表型异质性的理解,采用更精细的方法来管理这些独特的患者队列。
# 引言
在过去的二十年中,管理心源性休克 (CS) 患者的治疗策略发生了相当大的变化。如今,早期血运重建、侵入性血流动力学特征和开始临时机械循环支持 (MCS) 是 CS 管理的常规组成部分;但是,这些仅代表医生在治疗 CS 患者时面临的临床决策的一部分 [1-3]。为了简化临床决策并降低不同中心 CS 管理的变异性,临床指南和 CS 管理算法在很大程度上依赖于临床、血流动力学和生化替代终点来驱动治疗建议 [1-5]。
与临床预后不同,替代终点对患者或临床医生没有内在意义。相反,替代终点的效用在于其预测临床预后的能力 [6]。为此,常规使用替代终点不仅用于协助临床实践决策,还用于提高进行临床试验的效率。随着替代终点越来越多地用于指导 Cs 患者的治疗决策,这些终点能够可靠地预测临床预后的有效性变得越来越重要。
在整个综述中,我们将检查一系列临床变量,这些变量被确定为 CS 预后的重要标志物。这些变量包括与临床试验和观察性研究中 CS 预后相关的替代终点,以及确定的治疗目标(包括一系列临床和实验室特征)。其中许多预后也被纳入更大的临床风险预测模型中。在此,我们将对临床试验中最常用的预后和 CS 管理算法的证据基础进行深入审查。
# 血流动力学参数
尽管在 ESCAPE 试验中,在研究者未能证实患者预后改善后,肺动脉导管 (PAC) 的使用减少 [7],但从本研究中排除 CS 患者后,无法将这些结果外推至 CS 人群。事实上,最近的研究一致证实了有创血流动力学监测在 CS 护理中的效用,尤其是在接受 MCS 器械治疗的患者中。(表 1A)在专门检查 CS 侵入性血流动力学评估的第一项研究中,入院期间使用 PAC 与调整后的短期和长期死亡率降低相关;然而,这种影响仅见于无急性冠脉综合征 (ACS) 的患者 [8]。同样,在 IQ 登记研究中超过 13000 例患者的检查中,接受血流动力学监测的患者的生存率显著高于未接受监测的患者 (63% vs 49%)[9]。随后一项采用大型多中心心源性休克工作组 (CSWG) 登记的研究证实,在急性心肌梗死 (AMI) 和心力衰竭 (HF) 相关 CS 中,早期使用 PAC(在 MCS 启动前)与所有阶段 CS 严重程度的住院死亡率降低相关 [10]。这些结果得到了近期一项荟萃分析的支持,该荟萃分析纳入了 19 项观察性研究,并确定在 CS 中使用 PAC 与出院生存率改善 (RR 0.77;95% CI 0.64-0.91) 以及最长可用随访时间 (RR 0.72;95% CI 0.60-0.87) 相关,尽管证据质量较低 [11]。观察到的 PAC 在 CS 中的获益可能源于改善对不良预后高风险患者的识别、指导选择定制的药物治疗和更好地知情 MCS 决策。
除了一般有创血流动力学的效用,许多个体参数已被用于 CS 的风险预测(表 1B 和表 2A)。CardShock 登记研究确定,左心室射血分数 (LVEF) 降低是所有 CS 患者住院期间死亡的独立风险因素 [12]。在 HF-CS 患者中,孤立的 LV 和双心室充血也与心脏替代治疗的使用增加相关 - 包括耐用心室辅助装置和心脏移植 [13&]。此外,在一个当代丹麦队列中,观察到需要血运重建的 AMI-CS 和主要 LV 功能不全患者的 30 天死亡率高于 LVEF 保持且主要累及右心室 (RV) 的患者,尽管呈现的血流动力学和代谢特征相当 [14]。
RV 功能障碍的多个指标也与 CS 的不良预后相关。在所有具有 CS 和 HF-CS 的患者中,右心房压力 (RAP) 升高与住院死亡率升高独立相关 [13&,15,16]。同样,在 CSWG 分析中,较高的右心房 / 肺毛细血管楔压 (RA/PCWP) 比值与所有形式 CS 的住院死亡率增加相关;然而,较低的肺动脉搏动指数 (PAPI) 和右心室每搏作功指数 (RVSWI) 仅与 HF-CS 亚组中死亡率增加显著相关 [16]。RV 功能障碍在 AMI-CS 中的独立预后作用不太明显。SHOCK 试验登记采用复合指标(中心静脉压 (CVP) 升高、CVP/PCWP 比值升高、PAPI 降低和 RVSWI 降低)定义 AMI-CS 患者的 RV 功能障碍;在该队列中,38% 的患者存在 RV 功能障碍,但与 30 天或 6 个月死亡率无关 [17]。相反,在荷兰 AMI-CS 队列中,在血运重建 24h 内确定的 RV 功能障碍超声心动图指标 (TAPSE < 1.4 cm) 与 30 天、1 年和 4 年死亡率升高相关;但是,在同时存在 LV 功能障碍的患者中,与死亡率升高的相关性最明显 [18]。有必要进行进一步研究,以明确哪种 RV 功能障碍指标最可靠地预测 CS 的短期和长期预后。
表 1. 心源性休克的替代预后:研究特征。
| 研究,年 | 设计 | 人群 | 样本量 | 替代标志物 | 预后 | 结果 | 结论 |
|---|---|---|---|---|---|---|---|
| A. 肺动脉导管 (PAC) 分析 | |||||||
| Garan,2020[10] | 回顾性 | CS | 1,414ADHF-CS:712 ADHF-CS:920 | PAC 使用 | 住院死亡率 | 住院死亡率:使用 PAC vs 不使用 PAC(调整后 OR 1.57,95% CI 1.06-2.33;P < 0.001) | 完全血流动力学特征与住院死亡率降低相关。 |
| Rossello, 2017[8] | 前瞻性 | CS | 129 | PAC 使用 | 30 天死亡率或长期死亡率 | 30 天死亡率:使用 PAC vs 无 (HR 0.55,95% CI 0.35-0.86;P = 0.008) 长期死亡率:使用 PAC vs 无 (HR 0.63,95% CI 0.41-0.97;P = 0.035) 亚组分析:在无 ACS 的 CS 中观察到相关性 (P—0.01),但在 ACS 中不 | 使用 PAC 与 CS 住院和长期死亡率降低相关,但仅在亚组分析的非 ACS 人群中保持显著性。 |
| B. 血流动力学参数 | |||||||
| Harjola, 2015[12] | 前瞻性 | CS | 219 | LVEF;收缩压 | 住院死亡率 | LVEF(每降低 1%):OR 1.06,95% CI 1.02--1.09,P—0.001 sBP(每降低 1 mmHg):OR 1.03,95% CI 1.02-1.09,P―0.001 | LVEF 降低和收缩压降低与住院死亡风险增加相关。 |
| Hernandez-Montfort,2021[13&] | 前瞻性 | ADHF-CS | 712 | RAP;HR;MAP;双心室充血;孤立性 LV 充血 | 院内死亡,原生心脏存活 (NHS),心脏替代治疗 | 所有指标:死亡 vs 心脏替代 vs NHSRAP (17.5vs 13.3 vs 12.4 mmHg,P < 0.001) HR(95.5 vs 93.3 vs 88.9 次 / 分,P―0.01)MAP (69.9 vs 75.3 vs 75.2 mmHg,P < 0.001) 双心室充血 (42.2 vs 32.5 vs 28.2%,P < 0.001) LV 充血 (8.9 vs 20.6 vs 18.4%,P < 0.001) | RAP 和 HR 升高,MAP 降低,双心室或 LV 充血均与院内死亡率升高相关。双心室和 LV 充血也与自体心脏存活率降低相关。 |
| Josiassen, 2020[14] | 回顾性研究 | AMI-CS | 1716 | LV 衰竭与 RV 衰竭 | 30 天死亡率 | LVvs RV 衰竭:35% vs 50% 死亡率,P―0.004 RV HR:0.61,95% CI 0.41--0.92,P—0.01 | AMI-CS 和 LV 为主的衰竭患者 30 天死亡率高于 RV 为主的患者 |
| Thayer,2020 [15] | 回顾性 | CS | AMI-CS:494 | RAP;LV,rv 和 BiV 充血 | 住院死亡率 | RAP:存活者 13.7 mmHg vs 非存活者 16.0 mmHg (P 0.002) 调整的死亡率比值比:双心室充血 vs LV 充血:OR 2.4 (95% CI 1.4--3.7) RV 充血:OR 1.06 (95% CI 1.03-1.08) | RAP 升高、双心室和 RV 充血与住院死亡率升高相关。 |
| Jain,2021[16] | 回顾性 | cs | 1414 | RAP;RA/PCWP;PAPi;RVSWI | 住院死亡率 | 非存活者 vs 存活者:RAP 升高 (P < 0.001),RA/PCWP (P < 0.001),PAPi 降低 (P < 0.001),RVSWI (P = 0.002) HFvs ACS:RA/PCWP 降低 (0.58 vs 0.66,P = 0.001),PAPi (2.71 vs 1.78,P < 0.001) 和 RVSWI (5.70 g-m/m2 vs 4.66 g-m/m2,P < 0.001) 亚组:PAPi 和 RVSWI 与 HF-CS (P < 0.001,P = 0.008) 而不是 ACS-CS 中的死亡率相关。 | RAP、RAP/PCWP 升高和 RVSWI、PAPi 降低与 CS 住院死亡率相关。PAPi 和 RVSWI 仅与 HF 亚组中的死亡率相关。 |
| Lala,2017[17] | 回顾性 | AMI-CS | 397 | 复合指标 RVD:CVP、CV/PCWP、PAPi、RVSWI | 30 天和 6 个月死亡率 | RVD 与 30 天或 6 个月死亡率之间没有显著相关性 (P = 0.1) 。 | 就流行病学而言,AMI-CS 的死亡率与 RVD 没有相关性。 |
| SHOCK 试验注册,2004 [19] | 前瞻性 | AMI-CS | 541 | CPO,CPI | 住院死亡率 | 死亡率:CPO:校正后 OR 0.60 (95% CI 0.44-0.83;P―0.002)*CPI:校正后 OR 0.65 (95% CI 0.480.87;P―0.004)* 如果 CPO > 0.53 W,则生存概率为 71% | CPI、CPO 和 LVSWI 均为 AMI-CS 住院死亡率的独立预测因素。 |
| Mendoza,2007[20] | 回顾性 | 需要 PAC 的急性心脏疾病 | 349 | CPO,CO | 住院死亡率 | 死亡率:CPO:OR 0.63,95% CI 0.43--0.91,P—0.01 CO:OR 1.05,95% CI 0.75--1.48,P—0.78 | CPO 与因 PAC 入住 ICU 的急性心脏病患者的住院死亡率相关。 |
| Torgerson,009[21] | 回顾性 | CS | 119 | CI,CPI | 28 天死亡率 | 死亡率:CI 时间积分 (l/m2/h):P=0.01 CPI 时间积分 (W/m2*min/h):P=0.01 | CI 和 CPI 下降与 CS 组 28 天死亡率增加相关。 |
| Parlow,2021[22&] | 随机对照试验 | CS | 192 | MAP | 复合终点:院内全因死亡,心脏骤停复苏,需要心脏移植或机械循环支持,非致死性心肌梗死,短暂性脑缺血发作或卒中,或开始肾脏替代治疗 | 主要预后:低 MAP:aRR 0.70;95% CI 0.53-0.92;P = 0.01 死亡率:低 MAP:aRR 0.56;95% CI 0.40--0.79;P < 0.01 | 低 MAP 与 CS 中较高的主要预后复合终点不良心血管事件相关。 |
| Basir,2021[23] | 前瞻性 | AMI-CS | 300 | 血管加压素需求 | 院内生存率 | 存活率:血管加压素使用:(OR 0.22,95% CI 0.06-0.79,P = 0.02) | 血管加压素使用与 AMI-CS 住院死亡率增加相关。 |
| C. 实验室参数 | |||||||
| Harjola,2015[12] | 前瞻性 | CS | 219 | 乳酸盐 | 住院死亡率 | 乳酸盐(每 mmol/L):OR 1.4,95% CI 1.2-1.6,P < 0.001 | 乳酸盐升高与住院死亡率风险升高相关。 |
| Hernandez-Montfort,2021[13&] | 前瞻性 | ADHF-CS | 712 | 乳酸盐;Cr;AST | 院内死亡,天然心脏存活 (NHS),心脏替代治疗 | 所有指标:死亡 vs 心脏替代 vs NHSLactate (4.9 vs 3.6 vs 2.4 mmol/L,P < 0.001) Cr (2.2 vs 1.8 vs 1.7 mg/dL,P < 0.001) AST (878 vs 258vs 326 U/L,P = 0.03) | 乳酸盐、Cr 和 AST 升高均与院内死亡率增加相关。 |
| Fuernau,2020[24&&] | 随机对照试验 | AMI-CS | 671 | 乳酸盐 | 30 天死亡率 | 死亡率:8h 乳酸盐 > 3.2:HR 3.62,95% CI 2.834.64,P<0.001,基线乳酸盐> 5:HR2.48,95% CI 2-3.09,P<0.001 | 8h 乳酸盐 > 3.1 mmol/L 和基线乳酸盐 > 5,预测 30 天死亡率升高。 |
| Marbach,2021[25] | 系统性审查 | CS | 1562 | 乳酸盐清除率 | 存活者与非存活者之间乳酸盐清除率的合并平均差异 | 存活者 vs 非存活者:6-8 h27.9%(95% CI 14.1%-41.7%,P < 0.001) 24 h 时 17.3%(95% CI 11.6%-23.1%,P < 0.001) | 乳酸盐清除率降低与 CS 死亡率增加相关。 |
| Marbach,2022[26&] | 随机对照试验 | CS | 142 | 乳酸盐清除率 | 住院死亡率 | 生存率:8h 的完全乳酸清除率:OR 2.47,95% CI 1.09-5.55,P = 0.03 24h 的完全乳酸清除率:OR 5.44,95% CI 2.14-13.8,P = 0.01 | 完全乳酸清除率是 CS 患者住院期间生存率的一个强有力的独立预测因素。 |
| Kataja,2017[27] | 前瞻性 | CS | 211 | 葡萄糖 | 住院死亡率 | 死亡率:葡萄糖 > 16 mmol/L:OR 3.7,95% CI 1.19--11.7,P = 0.02 | 重度高血糖与住院死亡率增加相关。 |
| Poss,2017[28] | 随机对照试验 | AMI-CS | 480 | 葡萄糖、肌酐、乳酸盐 | 30 天死亡率 | 死亡率:葡萄糖 > 10.6 mmol/L:HR 1.48 (1.10-2.01),P = 0.01 Cr > 1.5 mg/dL:HR 1.57 (1.17-2.11),P = 0.003 乳酸盐 > 5 mmol/L:HR 1.98 (1.47-2.66),P < 0.0001 | 葡萄糖、肌酐和动脉乳酸盐升高与 AMI-CS 住院死亡率升高相关。 |
| Ceglarek,2021[29] | 随机对照试验 | AMI-CS | 458 | CLIP 评分(胱抑素 C、乳酸盐、白介素 - 6 和氨基末端 B 型利钠肽前体) | 30 天死亡率 | 死亡率:C - 统计:0.82,95% CI 0.78--0.86 | CLIP 评分越高,30 天死亡率越高。 |
| Rueda,2019[30] | 前瞻性 | CS | 97 | CS4P 评分:肝型脂肪酸结合蛋白、β2 - 微球蛋白、果糖 - 二磷酸醛缩酶 B 和 SerpinG1 | 90 天死亡率 | 死亡率:AUC 为 0.83 (95% CI 0.74-0.89) | CS4P 评分越高,CS 的 90 天死亡率越高。 |
| D. 机械循环支持 | |||||||
| Hernandez-Montfort,2021[13&] | 前瞻性 | ADHF-CS | 712 | AMCS 设备数量 | 院内死亡率,纯心脏存活率 (NHS),心脏替代治疗 | 死亡 vs. 心脏替代 vs. NHS >1 个 MCS 器械:50 vs 33.7 vs 16.3% ≤1 个 MCS 器械:21.9 vs 39.6 vs 38.5%,组间 P<0.001 | >1 个 MCS 器械使用预示院内死亡率和心脏替代治疗更高。 |
| Basir,2017[37] | 回顾性 | AMI-CS | 287 | PCI 前后 MCS 对比 | 住院死亡率 | 死亡率:PCI 前 MCS 为 54% vs PCI 后 MCS 为 65%(OR 0.49,95% CI 0.24-0.98;P = 0.04) 开始 CS 至 MCS:存活者 1.3 vs 非存活者 2.8h(P = 0.03) | 存活者开始 MCS 的时间显著早于非存活者。PCI 前接受 MCS 是生存率的独立预测因素。 |
| O’Neill,2018[9] | 前瞻性 | AMI-CS | 15,259 | 放置 Impella 的时间 | 解释生存率 | 死亡率:Impella PCI 术前 41% vs Impella PCI 术后 48%(P<0.001) 高容量中心(每年 > 4 次器械植入):56% vs 51%,P<0.001。 | PCI 前放置 Impella 的 AMI-CS 患者,其解释生存率高于接受 Impella 作为挽救治疗的患者。高容量中心的 AMI-CS 死亡率较低。 |
表 2. 心源性休克的替代标志物:血流动力学和生化参数。
| 替代标志物 | CS 类型 | 预后相关性 |
|---|---|---|
| A. 血流动力学参数 | ||
| ↓LVEF [12,13 和] | 所有 CS、HF-CS、AMI-CS | ↑院内死亡率,心脏替代治疗,30 天死亡率 |
| ↑RAP [13 和,15,16] | 所有 CS、HF-CS | ↑院内死亡率 |
| ↑RA/PCWP 比值 [16] | 所有 CS | ↑院内死亡率 |
| ↓CPO,CI[19-21] | 所有 CS | ↑院内死亡率,28 天死亡率 |
| ↓MAP [13 和,22 和] | 所有 CS、HF-CS | ↑院内死亡、复合院内死亡、复苏心脏骤停、MCS、非致死性 MI、TIA / 卒中和 RRT |
| ↑HR[13&] | HF-CS | ↑院内死亡率 |
| B. 实验室参数 | ||
| ↑乳酸盐(> 2 mmol/L [12],> 5 mmol/L [24&&],↓清除率 [25,26&&]) | 所有 CS,AMI-CS | ↑院内死亡率,30 天死亡率 |
| ↑葡萄糖 (> 10.6 mmol/L [27],> 16 mmol/L [28]) | 所有 CS,AMI-CS | ↑院内死亡率,30 天死亡率 |
| ↑肌酐 (> 1.5 mg/dL [28],> 1.57 mg/dL [13&]) | AMI-CS | ↑院内死亡率,30 天死亡率 |
| ↑尿素氮 [13 和] | HF-CS | ↑院内死亡率 |
| ↑AST [13 和] | HF-CS | ↑院内死亡率 |
| ↑CLIP 评分:乳酸盐、胱抑素 C NT-proBNP 和 IL-6 [29] | AMI-CS | ↑30 天死亡率 |
| ↑蛋白质组学 (CS4P) 评分:肝型脂肪酸结合蛋白、β-2 - 微球蛋白、果糖 - 二磷酸醛缩酶 B 和舍平 G1 [30] | 所有 CS、AMI-CS | ↑90 天死亡率 |
| C. 临床分类系统 | ||
| SCAI 分期 [13&,15,31,33--36] | 所有 CS、HF-CS、AMI-CS | ↑住院期间死亡率、30 天死亡率、5 年死亡率 |
| IABP - 休克 II [28] | AMI-CS | ↑30 天死亡率 |
| CardShock 评分 [12] | AMI-CS,非 AMI CS | ↑院内死亡率 |
若干心输出量和全身血流动力学指标与 CS 的生存率相关。在 SHOCK 登记研究和 2007 年检查接受 PAC 的重症心脏病患者的一项单中心研究中,心输出量 (CPO) 与住院死亡率增加相关 [19,20]。同样,因 CS 进入 ICU 24h 内的心脏指数和心脏功率指数下降与 28 天死亡率增加相关 [21]。然而,这些关联尚未在更多同时代的队列中重复。生命体征也可用于预测 CS 风险。在 CSWG HF-CS 队列中,平均动脉压 (MAP) 降低和心率 (HR) 加快均与住院死亡率增加相关 [13&];此外,在最近的 DOREMI 子研究中,需要血管加压素支持的 CS 患者的 MAP 降低与复合预后发生率增加相关,包括住院死亡率、复苏停搏、使用 MCS、非致死性 MI、TIA / 卒中和肾脏替代治疗 [22&]。作为更间接的全身灌注指标,不依赖于 CPO,血管加压素需求的增加本身也与 AMI-CS 住院死亡率的增加相关 [23]。
# 实验室参数
许多生化参数已被确定为 CS 预后的重要替代标志物(表 1 C 和表 2B)。最广泛接受的常规风险标志物为血清乳酸盐,它是组织灌注不足和器官功能障碍的标志物;但是,用于确定升高风险的临界值存在变异性。CardShock 登记研究纳入了 ACS 和非 ACS CS 患者,确定了 7 个用于早期预测住院死亡率的变量;其中,乳酸盐水平大于 2 mmol/L 可独立预测全因住院死亡率 [12]。在一项入选 AMI-CS 患者的 IABP-SHOCK II 试验的子研究中,动脉乳酸盐值大于 5 mmol/L 与 30 天死亡率独立相关 [24&&]。考虑到 CS 期间器官灌注的变化,乳酸盐水平随时间升高的模式和进展可能比单次入院时更重要。为此,许多研究反而检查了 CS 中乳酸盐清除率(定义为特定时间范围内乳酸盐降低的百分比)的预后意义。最近的一项荟萃分析发现,在同种异体 CS 队列中,存活者 6-8h 和 24h 的乳酸盐清除率显著高于非存活者 [25]。在 DOREMI 试验的子研究中也发现了类似的结果,在所有时间点,存活者的乳酸盐正常化率高于非存活者,包括早在随机分配后 4h [26&&]。
影响 CS 风险的其他重要常规生化参数包括血糖、肌酐和肝酶。高血糖被确定为 IABP-SHOCK II(临界值 > 10.6 mmol/L)和 CardShock (> 16.0 mmol/L) 队列中 CS 死亡率的独立预测因素 [27,28]。同样,在许多队列中,肾功能降低被确定为预后不良的标志物,包括 IABP-SHOCK II (Cr > 1.5 mg/dL) 和 CSWG(Cr > 1.57 mg/dL,BUN 升高)[13&,28]。最后,在 CSWG 登记研究评价的 HF-CS 队列中,肝功能障碍(通过天冬氨酸转氨酶评估)与住院死亡率直接相关 [15]。
除了标准的生化指标外,最近检查 CS 预后替代实验室指标的研究还包括神经激素和炎症参数。最近,CULPRIT-SHOCK 试验的分析表明,30 天死亡率的 4 个最强的生物标志物预测因子包括先前确定的乳酸盐,以及胱抑素 C(肾功能不全的另一个标志物),NT-proBNP 和白介素 - 6。这 4 个生物标志物包括一种新型的,生物标志物 - 仅 CLIP 风险评分,在 IABP-SHOCK II 患者人群中进行了外部验证 [29]。此外,开发了综合蛋白质组学风险评分来预测 90 天 CS 死亡率,确定肝型脂肪酸结合蛋白、β-2 - 微球蛋白、果糖 - 二磷酸醛缩酶 B 和 serpin G1 为重要的预后标志物。这四种蛋白(现已整合入 CS4P 评分,在 CardShock 队列中得到验证)反映了多器官功能障碍以及全身炎症 [30]。随着有关这些非介入性炎症和神经激素标志物预后影响的进一步证据的积累,这些参数的测量可能成为 CS 评估和管理的标准实践。
# 临床分类
已经开发了许多临床分类和风险评分(包括上述审查的血流动力学和实验室参数),以评估 CS 的预后。SCAI 分类系统于 2019 年建立,并已得到众多心脏病学和重症监护组织的认可 [31]。SCAI 分类利用床旁临床结果(即,容量状态、灌注)、生化标志物(即,乳酸盐、肌酐)以及侵入性和非侵入性血流动力学评估,将患者分为 5 个 CS 阶段,从 “风险患者” 至 “极端患者”。在 HF 相关队列 [13&,32]、AMI 相关队列 [33] 和同种异体 CS 队列 [15,34-36] 中,SCAI 分期在预测短期和长期死亡率方面已得到验证。使用 IABP-SHOCK II 队列开发了 AMI-CS 特定的另一个风险评分;该评分纳入 6 个临床变量(年龄、既往卒中、葡萄糖、肌酐、乳酸盐和血运重建后 TIMI 评分),将患者分为代表低风险、中等风险和高风险的 3 类。IABP-SHOCK II 评分显示的高风险与短期死亡率增加相对应 [28]。同样,CardShock 风险评分采用了一组相似的临床和人口统计学变量(年龄、既往 CABG、既往 MI、ACS 病因性休克、意识模糊、sBP、乳酸盐和 LVEF),将患者分为低风险组、中等风险组和高风险组;该评分在 ACS 和非 ACS CS 人群中作为住院死亡率的预测因子得到了验证 [12](表 2 C)。随着死亡率的更多独立预测因素的出现,CS 临床分期将需要演变,以包括标准临床因素之外的风险预测因素的多样性,并确定不良预后的最重要促成因素。
# 机械循环支持
越来越多地使用先进的治疗方法和治疗算法进行 CS 管理,使得风险预测的范围已超出上述临床分类方案。随着 MCS 在 CS 中的作用扩大,对 MCS 的需求(和利用)本身已被用作预后的标志物(表 1D)。
回溯到 20 世纪 50 年代,当心肺旁路允许进行开放心脏手术时,在过去的十年中,随着经皮轴流装置的开发,MCS 的进步在 CS 临床管理的不断发展的策略中发挥了中心作用。最近的研究对不同疾病严重程度组的预后提供了新的见解,同时也突出了不同机构 MCS 实践的变异性。特别是,最近已证实 MCS 启动的时间(前期 vs 挽救治疗)与 CS 预后相关。
Basir 及其同事使用基于全球导管的心室辅助装置 (cVAD) 登记研究,研究了 MCS 在 AMI-CS 患者中的使用。与 PCI 后接受 MCS 的患者相比,在 PCI 前接受 MCS 的患者出院时的生存率更高 (46% vs 35%)。该研究进一步突出了及时启动 MCS 的重要性,证实了当装置从休克开始放置不到 90 min 与休克开始后超过 4 h 相比,生存率显著提高 (68% vs 26%)[37]。同样,在一项对美国 AMI-CS 患者质量改善 (IQ) 登记的审查中,这些患者在尝试血运重建前接受了一线 Impella 置入。使用 MCS 器械作为 AMI-CS 的一线治疗的生存率为 59%,而用作挽救策略时为 52%[9]。虽然这些结果来自观察性队列,但即将进行的随机 RECOVER IV 试验将评价以下假设:与 MCS 相比,PCI 前 MCS 可改善 AMI-CS 作为挽救治疗的预后;此外,DanGer Shock 试验旨在成为第一项具有充分把握度的前瞻性研究,以检查 Impella CP 尤其在 AMICS 环境中的使用 [38]。同样,EURO SHOCK 研究正在进行中,对 AMICS 中 VA 体外膜肺氧合 (ECMO) 进行前瞻性评估 [39],REVERSE 研究还将评估在 CS 中,VA ECMO 联合预先 LV 通气策略的效用 [40]。
已证实,恢复充分灌注和纠正代谢紊乱的必要 MCS 装置的程度是 CS 患者预后的重要考虑因素。CSWG 登记研究根据数量支持器械检查了 HF-CS 患者的预后,独立于血管活性药物的使用。在需要一种以上装置的患者中,最常见的预后是死亡 (50.0%),其次是心脏替代治疗 (HRT,33.7%),只有少数患者出院时归类为自体心脏存活 (NHS,16.3%)。这些预后比使用 1 种或更少 MCS 器械的患者更差,其中更少死亡 (21.9%),更多患者出院时使用 NHS (38.5%)[13&]。
最后,随着 MCS 在 CS 管理中的作用不断增强,必须考虑置入和维护这些器械的机构经验的重要性。研究了机构使用 Impella 器械的经验对 CS 死亡率的影响;高容量中心(每年植入 4 次以上器械)的 AMI-CS 患者的生存率显著高于低容量中心(每年植入 4 次以下器械)[9]。因此,随着 CS 先进疗法的作用的扩展,启动时间、对多种支持器械的需求和中心特定的经验程度可能在预测和确定后续预后中发挥重要作用。
# 结论
如综述所述,许多临床、血流动力学和实验室参数已被确定为 CS 预后的替代标志物;这些独立预测因素随后被纳入许多风险评分和分类系统。此外,MCS 的同时使用和实施时机已被用于告知预后。但是,未来研究仍有许多途径。尽管这些参数已在 AMI 和 HF 相关 CS 中进行了单独研究和验证,但近期文献强调了 CS 的异质性超出了基础病因。使用机器学习方法在两个多中心队列中,确定了 3 种独立的 CS 表型,每种均有不同的临床表现和与死亡率的特定相关性:“非充血 (I)”、“心肾 (II)” 和 “心脏代谢 (III)”[41]。同样,最近一项在 CS 患者中检查全身炎症反应 (SIRS) 患病率的研究确定,SIRS 的存在预示着除 SCAI 分期预测外,死亡风险增加 [42]。随着我们对 CS 异质性的深入理解,我们也必须对影响不同表型队列风险的临床参数有更深入的了解。
替代标记物识别的效用延伸到临床决策范围的风险预测之外。CS 管理的许多算法结合了临床分期和替代标志物,以指导护理水平,包括 ICU 置入的适当性、侵入性血流动力学监测和 MCS 启动 [1,4,43]。如上所述,在更多颗粒表型队列中增加对影响 CS 预后因素的理解可能有助于更复杂的个体化决策算法,其中包括病因学、特定血流动力学模式以及相关的炎症、代谢和器官相关的紊乱。
# REFERENCES
DETAILS
Tehrani BN, Truesdell AG, Sherwood MW, et al. Standardized team-based care for cardiogenic shock. J Am Coll Cardiol 2019; 73:1659-1669.
Tehrani BN, Truesdell AG, Psotka MA, et al. A standardized and comprehensive approach to the management of cardiogenic shock. JACC Heart Fail 2020; 8:879-891.
Basir MB, Kapur NK, Patel K, et al. National Cardiogenic Shock Initiative Investigators. Improved outcomes associated with the use of shock protocols: updates from the national cardiogenic shock initiative. Catheter Cardiovasc Interv 2019; 93:1173-1183.
van Diepen Sean, Katz Jason N, Albert Nancy M, et al. Contemporary management of cardiogenic shock: a scientific statement from the American Heart Association. Circulation 2017; 136:e232-e268.
Chioncel O, Parissis J, Mebazaa A, et al. Epidemiology, pathophysiology and contemporary management of cardiogenic shock - a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2020; 22:1315-1341.
Kemp R, Prasad V. Surrogate endpoints in oncology: when are they acceptable for regulatory and clinical decisions, and are they currently overused? BMC Medicine 2017; 15 (1):134.
The ESCAPE Investigators and ESCAPE Study Coordinators*. Evaluation Study of Congestive Heart Failure and Pulmonary Artery Catheterization EffectivenessThe ESCAPE Trial. JAMA 2005; 294:1625-1633.
Rossello X, Vila M, Rivas-Lasarte M, et al. Impact of pulmonary artery catheter use on short- and long-term mortality in patients with cardiogenic shock. Cardiology 2017; 136:61-69.
O'Neill WW, Grines C, Schreiber T, et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. Am Heart J 2018; 202:33-38.
Garan AR, Kanwar M, Thayer KL, et al. Complete hemodynamic profiling with pulmonary artery catheters in cardiogenic shock is associated with lower in-hospital mortality. JACC Heart Fail 2020; 8:903-913.
Chow JY, Vadakken ME, Whitlock RP, et al. Pulmonary artery catheterization in patients with cardiogenic shock: a systematic review and meta-analysis. Can J Anaesth 2021; 68:1611-1629.
Harjola V-P, Lassus J, Sionis A, et al. CardShock Study Investigators, GREAT network. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. Eur J Heart Fail 2015; 17:501-509.
13[■]. Hernandez-Montfort Jaime, Sinha Shashank S., Thayer Katherine L., et al. Clinical outcomes associated with acute mechanical circulatory support utilization in heart failure related cardiogenic shock. Circ Heart Fail. 2021; 14:e007924.
In the latest report from the CSWG, a prospective registry of outcomes in patients with cardiogenic shock, elevated lactate, creatinine, and liver function enzymes were all associated with increased in-hospital mortality.
Josiassen J, Helgestad OKL, Moller JE, et al. Cardiogenic shock due to predominantly right ventricular failure complicating acute myocardial infarction. Eur Heart J Acute Cardiovasc Care 2021; 10:33-39.
Thayer KL, Zweck E, Ayouty M, et al. Invasive hemodynamic assessment and classification of in-hospital mortality risk among patients with cardiogenic shock. Circ Heart Fail 2020; 13:e007099.
Jain P, Thayer KL, Abraham J, et al. Right ventricular dysfunction is common and identifies patients at risk of dying in cardiogenic shock. J Card Fail 2021; 27:1061-1072.
Lala A, Guo Y, Xu J, et al. Right ventricular dysfunction in acute myocardial infarction complicated by cardiogenic shock: a hemodynamic analysis of the Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock (SHOCK) Trial and Registry. J Card Fail 2018; 24:148-156.
Engstrom AE, Vis MM, Bouma BJ, et al. Right ventricular dysfunction is an independent predictor for mortality in ST-elevation myocardial infarction patients presenting with cardiogenic shock on admission. Eur J Heart Fail 2010; 12:276-282.
Fincke R, Hochman JS, Lowe AM, et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: a report from the SHOCK trial registry. J Am Coll Cardiol 2004; 44:340-348.
Mendoza DD, Cooper HA, Panza JA. Cardiac power output predicts mortality across a broad spectrum of patients with acute cardiac disease. Am Heart J 2007; 153:366-370.
Torgersen C, Schmittinger CA, Wagner S, et al. Hemodynamic variables and mortality in cardiogenic shock: a retrospective cohort study. Crit Care 2009; 13:R157.
22[■]. Parlow S, Di Santo P, Mathew R, et al. CAPITAL DOREMI investigators. The association between mean arterial pressure and outcomes in patients with cardiogenic shock: insights from the DOREMI trial. Eur Heart J Acute Cardiovasc Care 2021; 10:712-720.
In a recent substudy of the DOREMI trial investigators demonstrated a direct correlation between low MAP and a higher incidence of the primary composite outcome.
- Basir MB, Lemor A, Gorgis S, et al. National Cardiogenic Shock Initiative Investigators. Vasopressors independently associated with mortality in acute myocardial infarction and cardiogenic shock. Catheter Cardiovasc Interv 2022; 99 (3): doi:10.1002/ccd.29895.
24[■][■]. Fuernau G, Desch S, Waha-Thiele S, et al. Arterial lactate in cardiogenic shock: prognostic value of clearance versus single values. JACC Cardiovasc Interv 2020; 13:2208-2216.
In a substudy of the IABP SHOCK II trial, absolute lactate levels > 3 mmol/L at 8 h after treatment initiation was an independent predictor of mortality
- Marbach JA, Stone S, Schwartz B, et al. Lactate clearance is associated with improved survival in cardiogenic shock: a systematic review and meta-analysis of prognostic factor studies. J Card Fail 2021; 27:1082-1089.
26[■][■]. Marbach JA, Di Santo P, Kapur NK, et al. Lactate clearance as a surrogate for mortality in cardiogenic shock: Insights from the DOREMI Trial. J Am Heart Assoc 2022; 11:e023322doi: 10.1161/JAHA.121.023322.
In this analysis of the randomized DOREMI cohort, a higher proportion of survivors had complete lactate clearance at all time points measured when compared to nonsurvivors, providing further data to support lactate clearance as a surrogate for survival in cardiogenic shock
Kataja A, Tarvasmaki T, Lassus J, et al. The association of admission blood glucose level with the clinical picture and prognosis in cardiogenic shock - results from the CardShock Study. Int J Cardiol 2017; 226:48-52.
Poss J, Koster J, Fuernau G, et al. Risk stratification for patients in cardiogenic shock after acute myocardial infarction. J Am Coll Cardiol 2017; 69:1913-1920.
Ceglarek U, Schellong P, Rosolowski M, et al. The novel cystatin C, lactate, interleukin-6, and N-terminal pro-B-type natriuretic peptide (CLIP)-based mortality risk score in cardiogenic shock after acute myocardial infarction. Eur Heart J 2021; 42:2344-2352.
Rueda F, Borras E, Garcia-Garcia C, et al. Protein-based cardiogenic shock patient classifier. Eur Heart J 2019; 40:2684-2694.
Naidu SS, Baran DA, Jentzer JC, et al. SCAI SHOCK stage classification expert consensus update: a review and incorporation of validation studies. J Am Coll Cardiol 2022; 79:933-946.
Jentzer JC, Baran DA, van Diepen S, et al. Admission Society for Cardiovascular Angiography and Intervention shock stage stratifies postdischarge mortality risk in cardiac intensive care unit patients. Am Heart J 2020; 219:37-46.
Hanson ID, Tagami T, Mando R, et al. National Cardiogenic Shock Investigators. SCAI shock classification in acute myocardial infarction: Insights from the National Cardiogenic Shock Initiative. Catheter Cardiovasc Interv 2020; 96:1137-1142.
Schrage B, Dabboura S, Yan I, et al. Application of the SCAI classification in a cohort of patients with cardiogenic shock. Catheter Cardiovasc Interv 2020; 96:E213-E219.
Jentzer JC, van Diepen S, Barsness GW, et al. Cardiogenic shock classification to predict mortality in the cardiac intensive care unit. J Am Coll Cardiol 2019; 74:2117-2128.
Jentzer Jacob C, Burstein Barry, Van Diepen Sean, et al. Defining shock and preshock for mortality risk stratification in cardiac intensive care unit patients. Circ Heart Fail 2021; 14:e007678.
Basir MB, Schreiber TL, Grines CL, et al. Effect of early initiation of mechanical circulatory support on survival in cardiogenic shock. Am J Cardiol 2017; 119:845-851.
Udesen NJ, Moller JE, Lindholm MG, et al. DanGer Shock Investigators. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. Am Heart J 2019; 214:60-68.
Banning AS, Adriaenssens T, Berry C, et al. Collaborators. Veno-arterial extracorporeal membrane oxygenation (ECMO) in patients with cardiogenic shock: rationale and design of the randomised, multicentre, open-label EURO SHOCK trial. EuroIntervention 2021; 16:e1227-e1236.
Ibrahim M, Acker MA, Szeto W, et al. Proposal for a trial of early left ventricular venting during venoarterial extracorporeal membrane oxygenation for cardiogenic shock. JTCVS Open 2021; 8:393-400.
Zweck E, Thayer KL, Helgestad OKL, et al. Phenotyping Cardiogenic Shock. J Am Heart Assoc 2021; 10:e020085.
Jentzer JC, Lawler PR, van Diepen S, et al. Systemic inflammatory response syndrome is associated with increased mortality across the spectrum of shock severity in cardiac intensive care patients. Circ Cardiovasc Qual Outcomes 2020; 13:e006956.
Henry Timothy D, Tomey Matthew I, Tamis-Holland Jacqueline E, et al. Invasive management of acute myocardial infarction complicated by cardiogenic shock: a scientific statement from the American Heart Association. Circulation 2021; 143:e815-e829. doi: 10.1161/CIR.0000000000000959.
# 心脏重症监护室的人员配备模式
综述目的
现代心脏重症监护室 (CICU) 已经演变为一个关心危重患者的高强度病房。尽管发生了这种转变,但这些专业单位的人员配备模式和组织结构的变化最近才开始应对这些挑战。我们描述了最新的证据,这些证据将为未来的 CICU 人员配备模式提供信息。
近期结果
在美国,大多数 CICU 是开放的,而不是封闭式病房,但是最近的数据表明,转变为封闭式人员配备模式与死亡率下降相关。在封闭式 CICU 中,这些死亡率下降在最危重人群中最明显,例如机械循环支持、心脏骤停和呼吸衰竭患者。此外,一项研究显示,转为心脏重症监护医生 (CICU) 可降低死亡率。最后,最近建立了 CICU 的多学科流程化救治团队,尤其是 “休克团队”,可能降低该特殊患病患者人群的死亡率。
总结
尽管数据的优势表明,使用一个封闭的重症监护医生工作人员组成的 CICU 模型可改善预后,但仍需要进一步的多中心研究来更好地确定当代 CICU 理想的人员配备模型。
关键词
心脏重症监护室、ICU 人员配备模式、心脏重症监护、心源性休克团队
# 要点
・随着 CICU 人群的复杂化,对重症监护治疗和管理的需求增加。
・从开放转入封闭式 CICU 已被证明与较低的死亡率相关。
・重症监护医生参与 CICU 患者的护理,尤其是呼吸衰竭患者,与死亡率降低相关。
・多学科 “休克小组” 与改善心源性休克患者的临床预后相关。
# 引言
20 世纪 60 年代首次描述,建立了冠心病监护病房 (CCU),以识别和治疗急性心肌梗死 (AMI) 后危及生命的心律失常 [1]。20 世纪 80 年代,CCU 成立近 25 年后,Lee 描述了 AMI 患者以及不断增长的心力衰竭 (HF) 人群的 “根本转变” 治疗模式 [2]。他将这一演变病房恰当地称为心脏重症监护室 (CICU),并要求为冠状动脉观察和重症监护患者建立单独的病房。他的预测已被证明具有令人难以置信的预见性,因为目前大多数无并发症的 AMI 都在标准医院病房接受治疗,而伴有急慢性心血管疾病的重症患者则在 CICU 接受治疗。
2010 年 Katz 等人评估了超过 29,000 例患者,详细说明了不断变化的患者特征和杜克大学 CICU 的入院诊断 [3]。ST 段抬高型心肌梗死的入院减少并不奇怪,而非 ST 段抬高型心肌梗死增加。然而,非心脏合并症和诊断显著增加,尤其是脓毒症、急性肾损伤和呼吸衰竭 (P < 0.001)。截至 2013 年,超过 50% 的医疗保险受益人入住 CICU 用于主要非心脏诊断 [4]。重要的是,因非心脏诊断入院的患者住院死亡率较高,需要更关键的治疗相关程序和治疗。最近,重症心脏病学试验网络 (CCCTN) 登记研究的里程碑式出版物报告:目前入住 CICU 的主要适应症是呼吸功能不全 (26.7%),其次是休克(21.1%,包括心源性和混合性)[5]。
尤其与该心源性休克问题相关的是,过去几十年中,CICU 中的休克发生了几项重要变化。从历史上看,CICU 中休克的主要形式是 AMI [6]。北美近期报告显示休克人群发生变化,与失代偿 HF 相关的混合性休克和休克比例增加 [7&]。此外,机械循环支持装置 (MCS) 也有所扩展 [8],不同中心之间的使用存在很大差异 [9]。
患者和诊断复杂性的不断增加引发了不断增长的心脏重症监护领域的诞生、人员配备模式的演变以及专用培训路径的形成。这些变化和不断变化的复杂性的一个关键组成部分是对关键治疗相关治疗的培训和专业知识的需求,这在心血管研究基金中并不常见 [10]。2012 年,美国心脏协会 (AHA) 发布了一份科学声明,详细说明了上述 CICU 患者人群的变化以及现代 CICU 对新人员配备和培训模式的需求 [11]。欧洲心脏病学会也给出了类似的建议,以反映欧洲特有的变化和人员配备 [12]。
在本综述中,我们将讨论当前 CICU 人员配备的现有证据、新的人员配备模型以及多学科 “休克小组” 的最新证据。值得注意的是,重要的是要指出,本审查中讨论的现有证据包括主要来自北美以及 “1 级” icu 的数据。如上文提到的 2012 年 AHA 科学声明中的定义以及类似于创伤中心层级 [11],1 级 CICU 主要是大型、三级护理中心,护理病情最严重的心血管患者,拥有最先进的技术和器械,通常有重症监护和手术资源可用。尽管讨论的证据可能与这些中心有关,但低强度 CICU 的理想人员配备模式可能不同。
# 其他 ICUS 的员工证据和定义
尽管复杂性不断增加 [5,13&],但大多数 CICU 的组织结构和护理提供并未发生改变以应对这些挑战(图 1)。诚然,许多美国 CICU 的人员配备模式滞后于过去几十年其他 ICU 所做的许多变化。尽管我们的综述特别关注 CICU,但重要的是简要提及驱动 CICU 变化的证据和定义。首先,“开放” 指的是 ICU,当患者在 CICU 时,各种提供者可以承认并作为主要提供者。相比之下,“封闭” 通常指由专门的提供者和团队照顾入住 CICU 的所有患者的病房。虽然这一术语在历史上曾在文献中使用过,但重要的是要注意,这些定义很简单,可能无法完全描述所有的 ICU 人员配备模式。此外,有些人不同意 “封闭” 一词,因为它没有强调 ICU 护理的团队基础部分或通常了解患者及其护理目标的纵向提供者的输入 [14]。早在 20 世纪 90 年代,观察性研究已经表明,在内科和外科 ICU 中,死亡率、ICU 和住院时间、感染并发症和资源利用均减少 [15-18]。同样,内科和外科 ICU 中的大多数证据表明,与非重症监护病房工作人员相比,重症监护病房的医生预后得到改善 [19]。这两种人员配备策略为不断增长的 CICU 人员配备模式数据奠定了框架。
# 心脏重症监护病房中的开放与封闭式模式
在 2012 年一项主要由学术医学中心 ICU 主任参与的调查中,55% 报告了封闭式 CICU 人员配备模式。在接受调查的患者中,52.9% 的患者强烈同意 “封闭式病房比开放病房提供更好和更一致的患者护理”,而仅 0.8% 的患者强烈不同意 [20]。这些结果与 2015 年至 2016 年由 AHA 申办的调查形成对比,后者发现美国的大多数 CICU 为开放病房 (74.2%)[21]。但是,按三级学术中心分层时,开放单位的比例下降至 62.6%。这些差异可能反映了后一份报告中接受调查的社区医院比例较大。尽管如此,大多数美国医院和至少一半的学术医学中心都有开放的 CICU 人员配备模式。

图 1. 心脏重症监护室复杂性和人员配备模型的演变和关键事件。
与其他内科和外科 ICU 的大量证据不同,只有三项回顾性、单中心研究描述了 CICU 中开放与封闭模型的影响(表 1)。2017 年 Katz 等人报告称,从开放 CICU 转移到封闭式 CICU 后,CICU 和住院死亡率均无差异。但是,他们的研究仅纳入了 670 例患者,可能不足以检测死亡率的差异。然而,他们确实报告了在封闭式病房的 CICU 住院时间更短,以及调查的护士和学员之间更好的沟通、教育和合作 [22]。
表 1. 关于心脏重症监护室人员配备和组织结构的观察性研究特征。
| 研究 a | 年 | 研究规模 | 比较 | 主要预后 |
|---|---|---|---|---|
| 开放式与封闭式 | ||||
| Katz,[22] | 2017 | 670 | 开放式与封闭式 | 死亡率无差异。降低 LOS,在封闭式病房中进行实习 / 护士沟通。 |
| Miller,[23&&] | 2021 | 3,996 | 开放式与封闭式 | 降低封闭式病房的 CICU 和住院死亡率 LOS 或成本无差异。 |
| Sims,[24&&] | 2021 | 3,348 | 由心力衰竭专家组成的单位 | 封闭式病房的 CICU 死亡率和 LOS 降低。在封闭病房中 MCS 患者的死亡率较低。 |
| 重症监护医生 | ||||
| Na,[28] | 2016 | 2,431 | 心脏重症监护医生组成的开放与封闭式 | 封闭式降低了 CICU 死亡率和住院死亡率。LOS 或再入院无差异。 |
| Kapoor,[29] | 2017 | 363 | 对所有 MV 患者进行前后强制性重症监护医生会诊 | 降低 CICU 和医院 LOS,MV 持续时间和封闭式病房的死亡率。 |
a 均为单中心研究
CICU,心脏重症监护病房;MV,机械通气;US,美国;LOS,住院时间;MCS,机械循环支持
最近,我们在耶鲁大学纽黑文医院对 CICU 封闭式前后进行了类似的分析,包括近 4000 例独特的患者。人员配备期间的人口统计学和合并症相似,但封闭式(更现代)病房的疾病严重程度更高。多变量调整后,我们发现与开放病房相比,封闭式病房的住院率(比值比 [OR] 0.69;95% 置信区间 [CI]:0.53-0.90,P = 0.007)和 CICU 死亡率 (OR 0.70;95% CI:0.52-0.94,P = 0.02) 均较低。在亚组分析中,心脏骤停和呼吸功能不全(定义为入住 CICU 主要是因为无创或有创通气)患者在封闭式病房的住院死亡率较低。然而,因心源性休克入院的患者之间无差异。最后,我们未发现两组之间的 CICU 住院时间或总通货膨胀调整住院费用存在差异(两组,P > 0.05)[23&&]。
最近的另一项 3000 例患者的研究分析了由 HF 专家组成的开放 CICU 模型向封闭式 CICU 模型的转变。他们同样发现,在本研究中,通过急性生理学和慢性健康状况评分 (APACHE) II 和简化急性生理学评分 (SAPS) II 评分评估的疾病严重程度评分在更现代的时期更高 (P < 0.001)。尽管增加了灵敏度,但他们报告称与开放病房相比,入住封闭式 / HF 专业人员病房的患者的未调整 CICU 死亡率更低(6.4% 与 8.5%;绝对风险降低 2.1%,95% CI:0.14.0%,P = 0.01)[24&],多变量调整后这种情况持续存在。
后两项研究中确定的死亡率降低机制可能是多因素的,不太可能是 CICU 人群所独有的。从历史上看,开放 CICU 主要治疗无需晚期治疗的无并发症 AMI 和 HF。在这种模式中,主要提供者并不总是存在于 CICU 甚至医院。虽然该模型对于该患者人群并非不合理,但由专门的提供者负责整个病房的护理和分类,直观地应该能在高敏度 CICU 提供更好的结果。尽管已经提出了许多潜在机制 [18,25-27],Katz 等人发现改善了团队成员之间的沟通和协作 [22],这可能是护理病情日益危重的 CICU 人群时改善预后的重要驱动因素。
# 心脏重症监护病房中的重症监护医师人员配备模式
在之前提到的 2012 年 ICU 学术主任调查中,O’Malley et al. 发现只有 11.4% 的 CICU 报告所有患者均涉及到重症监护医生,只有 31.7% 的机械通气患者涉及到重症监护医生,46.3% 的受访者可以咨询重症监护医生。超过 80% 的受访者强烈或有点同意需要进行重症监护培训的心脏病专家 [20]。尽管上述调查人群和设计存在差异,但 AHA 申办的调查在不到 4 年后进行,报告超过 50% 的 CICU 包括定期重症监护医生参与 [21]。在同一时期内,经双重培训的心脏重症监护医生在 CICU 的使用率显著增加,从 4.0% 增加至 14.7%[21]。
最近的两项研究调查了重症监护医生(无论是联合模式还是由双重培训的心脏重症监护医生组成)的参与是否对 CICU 的预后有影响(表 1)。在韩国进行的第一项研究评价了从开放的一般心脏病学人员模式转变为封闭的心脏重症监护人员模式前后的死亡率相关性 [28]。心脏重症监护医师对每例患者进行日间四舍五入,并在夜间通过电话联系。在心脏重症监护医生员工模型中,CICU 死亡率从 8.9% 降至 4.1%(P < 0.001)。此外,在心脏重症监护模型中,住院死亡率同样较低,并且结果在倾向匹配后持续存在。他们发现死亡率下降是由心血管和非心血管死亡原因减少所致。此外,Na et al. 报告了一些最危重患者的死亡率显著降低,如需要静脉 - 动脉体外膜氧合的患者 (P = 0.001)。
虽然双重培训的心脏重症监护医师的技能集可能提供特别的优势,特别是对于 1 级或三级护理 CICU,但双重培训的医生数量有限,使得目前在许多中心这种人员配备模式不现实。或者,在许多中心,由心脏病专家和重症监护医生组成的标准化咨询或联合管理人员配备模式可能更现实。2017 年,美国一家学术性三级医疗中心的报告发现,对于所有需要接受有创机械通气的患者,从开放会诊转为强制性重症监护室会诊后,CICU 和住院时间、CICU 费用以及无呼吸机天数均减少 [29]。开放模型的未调整死亡率为 35.2%,共同管理模型为 26.4%(P = 0.085)。在调整 APACHE II 评分后,他们发现联合管理模式中的死亡率统计学显著性降低 (OR 0.40;95% CI:0.24-0.65,P < 0.001)。如前所述,目前呼吸功能不全是入住 CICU 的主要指征,并且与预后特别差相关 [5,3033]。如这两项研究所证实的,我们认为重症监护医生参与 CICU 呼吸功能不全患者的护理是降低 CICU 总死亡率的原因之一。虽然在心脏病学研究员期间暴露于无创和有创机械通气,但对于主要关注 CICU 职业的新学员来说,教育水平和专业教学还不够。
# 心原性休克团队
考虑到 MCS 技术的增长和 CICU 中休克的复杂性,许多中心成立了多学科心源性休克团队以改善及时的医疗决策和管理(图 2)[34]。最近几项单中心、小型研究报告了在创建休克团队后死亡率下降(表 2)[35-37]。最近,一项来自 CCCTN 登记的多中心观察性研究比较了有和无休克治疗组的医院,发现在有专门休克治疗组的中心,CICU 风险校正死亡率较低 (OR 0.72;95% CI:0.55-0.94;P = 0.016)[38&&]。尽管这些结果很有前景,但改善预后的病因尚不完全清楚,尤其是考虑到过去 20 年来缺乏已证实可降低心源性休克患者死亡率的疗法。依据方案实施救治的流程和多学科团队协作可能会导致更快、更适当的治疗(例如,MCS 器械类型)。但是,鉴于现有研究缺乏标准化方案和团队结构,尚不清楚改善预后的机制。还需要注意的是,这些研究包括 1 级中心,可能不会转化或推广至所有机构或用于 CICU 人员配备模型。考虑到高效的休克团队所需的资源以及不清楚休克团队的哪些组成与预后改善相关,需要随机对照试验数据来确认这些观察结果。

图 2. 心源性休克模型团队的多学科组成部分。
表 2. 包含对照组的多学科心源性休克团队研究。
| 研究 | 年 | 研究规模 | 比较 | 主要预后 |
|---|---|---|---|---|
| Tehrani 等人 [35] | 2019 | 204 | 休克团队开发前后 | 制定团队标准化方案降低心源性休克 30 天死亡率 |
| Taleb 等人 **[36] | 2019 | 244 | 休克团队开发前后 开始休克治疗后住院和 30 天死亡率降低休克 - 支持时间无差异 | |
| Lee 等人 **[37] | 2020 | 100 | 休克团队开发前后 住院期间中位 LOS、30 天生存率或住院期间死亡率无差异。休克团队队列的中位 8 个月死亡率较低 | |
| Papolos 等人 [38&&] a | 2021 | 1,242 | 1 级 b 有休克团队与无休克团队的 CICU | 休克团队中心的 CICU 死亡率较低 |
一项多中心研究。
b 2012 年美国心脏协会科学声明中定义的 1 级心脏重症监护室 [11]
LOS,住院时间;CICU,心脏重症监护室;IABP,主动脉内球囊反搏;MCS,机械循环支持。
# 新型心脏强化治疗装置工作人员模型
尽管大多数中心继续分开覆盖心脏病学和心胸外科 ICU (CTICU),一些已经开发了综合心血管重症监护模式。在马萨诸塞州总医院 (MGH),为 CICU、CTICU 和休克团队的工作人员提供多学科心脏中心 ICU (HCICU) 模式。MGH HCICU 团队由来自不同培训背景(包括心脏病学、心脏麻醉学、心脏手术和急诊医学)的 15 名心脏重症医师组成。该团队全天候参与两台设备以及电击团队的内部工作。重症监护医生与先进的医疗服务提供者以及通过 HCICU 轮转的住院医生和其他医生合作。虽然大多数中心一般仅由心脏病专家或仅由重症监护医生组成,但是该模式的一个关键差异是多专业团队,其提供 24/7 的内部覆盖。
鉴于接受过 HF 培训的双重培训的心脏重症监护医生和心脏病专家的关键技能组的数量有限,一些人建议在 HF 高级培训年内加入重症监护选择。虽然额外的选购品无资格获得重症监护的委员会认证,但可以创建培训路径给予 “心脏重症监护的区别”,这将节省一年的培训,并有助于平衡缺乏双重培训的心脏重症监护医生,同时使这些提供者做好主要护理 CICU 和 CTICU 患者的准备 [39&]。
# 结论
现代 CICU 的患者复杂性、合并症和入院病例组合发生了变化。尽管有这些变化,但人员配备模式的演变有限。迄今为止,美国大多数 CICU 开放。然而,最近几项研究表明,在转换为一个封闭单位后预后有所改善。配备重症监护医生,尤其是需要机械通气的患者,也可能与预后改善相关。虽然这是一个日益壮大的领域,但双重培训的心脏重症监护医生相对较少。因此,我们需要制定应对这些挑战的策略以及更稳健的多中心研究,以更好地定义当代 CICU 理想的人员配备模式。
# REFERENCES
DETAILS
Julian DG. Treatment of cardiac arrest in acute myocardial ischaemia and infarction. Lancet 1961; 2:840-844.
Lee TH, Goldman L. The coronary care unit turns 25: historical trends and future directions. Ann Intern Med 1988; 108:887-894.
Katz JN, Shah BR, Volz EM, et al. Evolution of the coronary care unit: clinical characteristics and temporal trends in healthcare delivery and outcomes. Crit Care Med 2010; 38:375-381.
Sinha SS, Sjoding MW, Sukul D, et al. Changes in primary noncardiac diagnoses over time among elderly cardiac intensive care unit patients in the United States. Circ Cardiovasc Qual Outcomes 2017; 10:e003616.
Bohula EA, Katz JN, van Diepen S, et al. Demographics, care patterns, and outcomes of patients admitted to cardiac intensive care units: The Critical Care Cardiology Trials Network Prospective North American Multicenter Registry of Cardiac Critical Illness. JAMA Cardiol 2019.
Harjola VP, Lassus J, Sionis A, et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. Eur J Heart Fail 2015; 17:501-509.
7[■]. Berg DD, Bohula EA, van Diepen S, et al. Epidemiology of shock in contemporary cardiac intensive care units. Circ Cardiovasc Qual Outcomes 2019; 12:e005618.
This study detailed the changing epidemiology of shock in the CICU.
Miller PE, Solomon MA, McAreavey D. Advanced percutaneous mechanical circulatory support devices for cardiogenic shock. Crit Care Med 2017; 45:1922-1929.
Berg DD, Barnett CF, Kenigsberg BB, et al. Clinical practice patterns in temporary mechanical circulatory support for shock in the Critical Care Cardiology Trials Network (CCCTN) Registry. Circ Heart Fail 2019; 12:e006635.
Miller PE, Kenigsberg BB, Wiley BM. Cardiac critical care: training pathways and transition to early career. J Am Coll Cardiol 2019; 73:1726-1730.
Morrow DA, Fang JC, Fintel DJ, et al. Evolution of critical care cardiology: transformation of the cardiovascular intensive care unit and the emerging need for new medical staffing and training models: a scientific statement from the American Heart Association. Circulation 2012; 126:1408-1428.
Bonnefoy-Cudraz E, Bueno H, Casella G, et al. Editor's Choice - Acute Cardiovascular Care Association Position Paper on Intensive Cardiovascular Care Units: An update on their definition, structure, organisation and function. Eur Heart J Acute Cardiovasc Care 2018; 7:80-95.
13[■]. Miller PE, Thomas A, Breen TJ, et al. Prevalence of non-cardiac multimorbidity in patients admitted to two cardiac intensive care units and their association with mortality. Am J Med 2020; 134:653-661.
This study detailed how noncardiac multimorbidity in the CICU is assocation with increased mortality, length of stay, and increased critical care therapies.
Pronovost PJ, Holzmueller CG, Clattenburg L, et al. Team care: beyond open and closed intensive care units. Curr Opin Crit Care 2006; 12:604-608.
van der Sluis FJ, Slagt C, Liebman B, et al. The impact of open versus closed format ICU admission practices on the outcome of high risk surgical patients: a cohort analysis. BMC Surg 2011; 4:928-935.
Carson SS, Stocking C, Podsadecki T, et al. Effects of organizational change in the medical intensive care unit of a teaching hospital: a comparison of 'open' and 'closed' formats. JAMA 1996; 276:322-328.
Ghorra S, Reinert SE, Cioffi W, et al. Analysis of the effect of conversion from open to closed surgical intensive care unit. Ann Surg 1999; 229:163-171.
El-Kersh K, Guardiola J, Cavallazzi R, et al. Open and closed models of intensive care unit have different influences on infectious complications in a tertiary care center: a retrospective data analysis. Am J Infect Control 2016; 44:1744-1746.
Pronovost PJ, Angus DC, Dorman T, et al. Physician staffing patterns and clinical outcomes in critically ill patients: a systematic review. JAMA 2002; 288:2151-2162.
O'Malley RG, Olenchock B, Bohula-May E, et al. Organization and staffing practices in US cardiac intensive care units: a survey on behalf of the American Heart Association Writing Group on the Evolution of Critical Care Cardiology. Eur Heart J Acute Cardiovasc Care 2013; 2:3-8.
van Diepen S, Fordyce CB, Wegermann ZK, et al. Organizational structure, staffing, resources, and educational initiatives in cardiac intensive care units in the United States: An American Heart Association Acute Cardiac Care Committee and American College of Cardiology Critical Care Cardiology Working Group Cross-Sectional Survey. Circ Cardiovasc Qual Outcomes 2017; 10:e003864.
Katz JN, Lishmanov A, van Diepen S, et al. Length of stay, mortality, cost, and perceptions of care associated with transition from an open to closed staffing model in the cardiac intensive care unit. Crit Pathw Cardiol 2017; 16:62-70.
23[■][■]. Miller PE, Chouairi F, Thomas A, et al. Transition from an open to closed staffing model in the cardiac intensive care unit improves clinical outcomes. J Am Heart Assoc 2021; 10:e018182.
This was the first CICU study to show a reduction in mortality after transition from an open to closed unit.
24[■][■]. Sims DB, Kim Y, Kalininskiy A, et al. Full-time cardiac intensive care unit staffing by heart failure specialists and its association with mortality rates. J Card Fail 2021; 28:394-402.
This study confirmed that a closed CICU is associated with a decreased mortality, but is unique because it described a novel CICU model that was staffed entirely by heart failure specialists.
Multz AS, Chalfin DB, Samson IM, et al. A 'closed' medical intensive care unit (MICU) improves resource utilization when compared with an 'open' MICU. Am J Respir Crit Care Med 1998; 157 (5 Pt 1):1468-1473.
Treggiari MM, Martin DP, Yanez ND, et al. Effect of intensive care unit organizational model and structure on outcomes in patients with acute lung injury. Am J Respir Crit Care Med 2007; 176:685-690.
Haut ER, Sicoutris CP, Meredith DM, et al. Improved nurse job satisfaction and job retention with the transition from a 'mandatory consultation' model to a 'semiclosed' surgical intensive care unit: a 1-year prospective evaluation. Crit Care Med 2006; 34:387-395.
Na SJ, Chung CR, Jeon K, et al. Association between presence of a cardiac intensivist and mortality in an adult cardiac care unit. J Am Coll Cardiol 2016; 68:2637-2648.
Kapoor K, Verceles AC, Netzer G, et al. A collaborative cardiologist-intensivist management model improves cardiac intensive care unit outcomes. J Am Coll Cardiol 2017; 70:1422-1423.
Alviar CL, Miller PE, McAreavey D, et al. Positive pressure ventilation in the cardiac intensive care unit. J Am Coll Cardiol 2018; 72:1532-1553.
Metkus TS, Miller PE, Alviar CL, et al. Advanced respiratory support in the contemporary cardiac ICU. Crit Care Explor 2020; 2:e0182.
Miller PE, van Diepen S, Ahmad T. Acute decompensated heart failure complicated by respiratory failure. Circ Heart Fail 2019; 12:e006013.
Miller PE, Van Diepen S, Metkus TS, et al. Association between Respiratory Failure and Clinical Outcomes in Patients with Acute Heart Failure: Analysis of 5 Pooled Clinical Trials. J Card Fail 2021; 27:602-606.
Moghaddam N, van Diepen S, So D, et al. Cardiogenic shock teams and centres: a contemporary review of multidisciplinary care for cardiogenic shock. ESC Heart Fail 2021; 8:988-998.
Tehrani BN, Truesdell AG, Sherwood MW, et al. Standardized team-based care for cardiogenic shock. J Am Coll Cardiol 2019; 73:1659-1669.
Taleb I, Koliopoulou AG, Tandar A, et al. Shock team approach in refractory cardiogenic shock requiring short-term mechanical circulatory support: a proof of concept. Circulation 2019; 140:98-100.
Lee F, Hutson JH, Boodhwani M, et al. Multidisciplinary code shock team in cardiogenic shock: A Canadian Centre Experience. CJC Open 2020; 2:249-257.
38[■][■]. Papolos AI, Kenigsberg BB, Berg DD, et al. Management and outcomes of cardiogenic shock in cardiac ICUs with versus without shock teams. J Am Coll Cardiol 2021; 78:1309-1317.
This was the first multicenter study to shown an associated between dedicated shock teams and lower mortality for patients with cardiogenic shock.
39[■]. Carnicelli PA, Blumer V, Genovese L, et al. The road not yet traveled: distinction in critical care cardiology through the advanced heart failure and transplant cardiology training pathway. J Card Fail 2022; 28:339-342.
