 呼吸链
呼吸链
# 呼吸链
# 一、线粒体功能与氧化呼吸链
线粒体是真核细胞中最重要的细胞器之一,主要是由蛋白质构成,其内含有完整的遗传体系及多种参与生物活动的酶类,既是产生 ATP 的主要场所,又携带遗传信息。线粒体是进行氧化代谢的部位,是糖类、脂肪和氨基酸最终氧化释放能量的场所,线粒体负责的最终氧化的共同途径是三羧酸循环与氧化磷酸化,该途径有赖于氧化呼吸链的参与。传递链上的各种酶均存在于其内膜上,可催化生物底物的氧化与 ATP 的合成,参与生物能量的转化。氧化呼吸链是由存在于细胞内的递氢体和递电子体按照一定的顺序排列组成的连续反应体系,由 NADH (复合物 1)、琥珀酸氧化还原酶 (复合物 Ⅱ)、细胞色素 C 氧化还原酶 (复合物 Ⅲ)、细胞色素 C 还原酶 (复合物 Ⅳ) 和 ATP 合成酶 (复合物 V) 5 个复合物组。营养物质的代谢就是利用氧化呼吸链电子传递过程通过氧化磷酸化作用生成能量物质 ATP 的过。线粒体对各种损伤均较为敏感,其功能状态对细胞存活、凋亡与坏死的调控非常重要,线粒体功能由其内膜的通透性以及氧化呼吸链的完整性决定。例如细胞色素 aa3 是复合物 Ⅳ 的主要成分,呼吸链损伤时它的缺失将导致酶活性的丧失,进而直接影响线粒体功能。可以通过检测线粒体呼吸控制率、线粒体 ATP 生成率以及线粒体膜离子通道的开放状态等指标来评价线粒体呼吸链的功能。
# 二、线粒体损伤与氧化应激
机体内的氧气 90% 以上被线粒体中的呼吸链酶系所消耗,氧气作为机体必需的物质也有其利弊:一者,氧不仅作为呼吸链电子传递的受体,同时也参与氧化磷酸化反应生成能量物质 ATP, 维持细胞的能量代谢;二者,氧自由基等有害物质的生成造成细胞损伤,导致其凋亡或死亡。机体通过自身的调节维持体内的氧化系统和抗氧化系统处于相对平衡状态,即使有自由基的产生,也会被抗氧化系统所清除,因此不会对细胞造成明显的损伤。然而机体在受到外界生物、化学及物理有害因素的影响下,内源性及外源性的刺激使机体代谢异常,组织细胞内短时间产生了大量的自由基超出了抗氧化系统的清除能力,机体则处于氧化应激状态。正常细胞中电子传递链的电子漏以及细胞中被损伤的电子传递链是产生自由基的主要途径。氧化呼吸链与氧自由基产生的部位接近,因此最易受氧自由基攻击,引起损伤。有研究表明,氧自由基可导致细胞生物膜脂质过氧化,直接中断呼吸链的电子传递,引起线粒体功能障碍,尤其是阻碍氧化磷酸化反应,ATP 生成受到影响,使钙通道失活,Ca2 + 内流增多,激活磷脂酶,使膜磷脂分解,膜通透性增加及跨膜电位发生改变,导致细胞功能障碍。线粒体内膜损伤后细胞色素 C 释放到胞浆,使参与氧化呼吸链电子传递的酶活性丧失,加重了 ATP 的合成障碍,Ca2 + 内流进一步增加,又造成了氧自由基的生成增多,形成 “恶性循环”,造成线粒体呼吸功能及能量代谢衰竭,与此同时相关凋亡因子被激活,引起细胞毒性,导致细胞凋亡甚至死亡,疾病因此产生。有研究认为,在病理情况下,线粒体复合物 Ⅲ 的损伤是活性氧的主要来源。也有研究显示,呼吸链复合物 Ⅰ 最容易受氧自由基攻击。也有学者认为,线粒体呼吸链不受损伤的情况下,复合物 Ⅳ 可将氧自由基转化为水,反之其损伤时电子传递链的完整性被破坏,阻碍氧自由基的转化,中断呼吸链电子传递及氧化磷酸化,导致氧自由基的滞留与增多,细胞损伤加重。
# 三、硫化氢与氧化应激硫化氢
在体内,1/3 以气体硫化氢形式存在,2/3 以硫氢化钠形式存在,两种形式共同存在形成一种动态平衡,维持体内硫化氢含量在正常生理水平。研究显示,硫化氢可调节细胞凋亡,然而根据其浓度高低的不同,其作用也截然不同。高浓度硫化氢具有细胞毒性,可抑制细胞线粒体呼吸功能,从而造成细胞死亡;而低浓度的硫化氢则可抑制细胞凋亡。有研究表明,硫化氢在抑制炎性介质的产生、抑制细胞氧化和衰老、清除衰老细胞、保护氧化损伤等方面有明显的作用。机体在严重创伤后,不可避免的发生组织细胞缺血缺氧,大量组织坏死以及机体明显的炎症反应,弓起脂质过氧化物以及氧自由基大量生成,导致细胞及线粒体功能障碍。研究显示,在硫化氢合成酶系的表达下,内源性硫化氢产生的代谢产物,在机体的生理和病理过程中发挥了重要的调节作用,抑制体内非特异性免疫细胞产生肿瘤坏死因子 - a, 减少自由基产物丙二醛的产生,减轻机体的炎症反应,改善机体的氧化应激状态,维持机体内氧化系统与抗氧化系统的动态平衡,减轻了细胞与线粒体损伤,维持细胞的能量代谢。李毅研究显示重度烧伤大鼠血清中硫化氢含量与各脏器中胱硫醚 -γ- 裂解酶 (CSE) 转化率均显著降低,得出 H2S/CSE 体系参与烧伤急性期病理生理过程的结论。
# 四、硫化氢与线粒体氧化呼吸链损伤
硫化氢在线粒体损伤后有保护氧化呼吸链完整性,稳定细胞色素 C 活性及氧化磷酸化反应的作用,进而保证 ATP 的合成。罗鑫等采用过氧化氢处理视网膜神经节,破坏线粒体结构和功能。通过硫化氢处理后发现其有维持线粒体形态和功能,阻止细胞色素 C 从线粒体内外流的作用,最终减轻过氧化氢对视网膜神经节细胞的氧化应激损伤。他发现在视网膜缺血再灌注前采用硫化氢干预处理,可以明显减少线粒体内细胞色素 C 释放,稳定氧化呼吸链电子传递过程,减少细胞凋亡。刘军杰等采用硫氢化钠干预高肺血流性肺动脉高压大鼠后与未干预大鼠对比发现,肺动脉组织线粒体膜的肿胀有所减轻,线粒体活力有所恢复,并且肺动脉平滑肌细胞线粒体 ATP 酶、超氧化物歧化酶和谷胱甘肽过氧化物酶的活性增强,线粒体脂质过氧化产物丙二醛水平降低,说明线粒体的氧化呼吸链电子传递活力有所恢复,在硫化氢的保护作用下肺动脉高压对线粒体的损伤明显减轻。刘芳等研究发现,采用硫氢化钠处理急性心肌缺血大鼠后与未处理大鼠对比,心肌线粒体膜肿胀明显减轻,线粒体活力有所恢复,心肌线粒体氧化磷酸化活性増强,线粒体脂质过氧化产物丙二醛水平明显降低,从而保证线粒体的氧化呼吸链完整性,心肌缺血损伤明显减轻,但给予胱硫醚 -γ- 裂解酶抑制剂后心肌线粒体膜肿胀加重,线粒体功能发生障碍,且线粒体中丙二醛含量升高,氧化磷酸化活性减弱,再次证明了外源性硫化氢对急性心肌缺血损伤时心肌线粒体有保护作用。张海峰等用硫氢化钠干预截肢创伤后大鼠发现,肺线粒体的呼吸功能明显改善,证实硫化氢通过保护线粒体氧化呼吸链的完整性来修复截肢创伤所致的肺损伤。杨春涛等发现外源性硫化氢具有对抗过氧化氢引起 PC12 细胞损伤作用,表现为减轻线粒体损伤,恢复线粒体氧化磷酸化功能,保护氧化呼吸链电子传递过程,降低活性氧的生成,从而提高细胞存活率。任重等研究证实,硫氢化钠能阻断氧化型低密度脂蛋白所致的内皮细胞线粒体膜电位的丢失,稳定线粒体呼吸功能,保护氧化呼吸链电子传递的完整性,从而保护内皮细胞,减少细胞凋亡。潘昊发现外源性硫化氢在心脏骤停及心肺复苏后可通过稳定脑组织细胞线粒体膜电位,恢复氧化呼吸链电子传递活力,改善线粒体氧化磷酸化功能,提高 ATP 产量,加强心肺复苏后脑组织细胞的能量供给,在一定程度上减轻了神经细胞的损伤。 综上所述,在各种因素导致线粒体损伤时,硫化氢不仅能够通过减少活性氧的生成也能通过其抗炎作用,恢复线粒体呼吸链电子传递活力,促进氧化磷酸化反应及 ATP 的生成,进而保证细胞内各种生理活动的高效进行,提高细胞存活率,降低细胞凋亡率。然而硫化氢对线粒体损伤影响的相关研究尚未涉及表皮细胞。表皮细胞在烧创伤等创面愈合的过程中占据着相当重要的地位,在硫化氢对不同种类细胞线粒体氧化呼吸链影响的研究基础上,笔者认为硫化氢对表皮细胞线粒体损伤亦有不同程度的影响,需进一步探究硫化氢在烧创伤及其创面愈合过程中的作用,完善其作用机制。
# 呼吸链与氧化磷酸化
糖酵解和三羧酸循环放出的能量,多数储存在还原辅酶中,仅有少部分以底物水平磷酸化的方式直接形成 ATP。还原辅酶中的能量需要通过氧化磷酸化过程合成 ATP,才能被利用。
还原辅酶上的电子如果传递给电负性更强(氧化还原电位更高)的物质,可以放出能量,差值越大,放能越多。但如果直接传递到氧,会因一次放出过多能量而导致反应过于剧烈,无法控制。
所以需氧生物采用一系列氧化还原电位介于二者之间的电子载体,构成一个梯度适当的传递链,让这个过程逐步进行。这样既有利于控制,又可提高利用效率。这一系列由电子载体构成的,从 NADH 或 FADH2 向氧传递电子的系统就叫做呼吸链(respiratory chain)或电子传递链(electron transport chain)。原核细胞的呼吸链位于质膜上,真核细胞则位于线粒体内膜上。
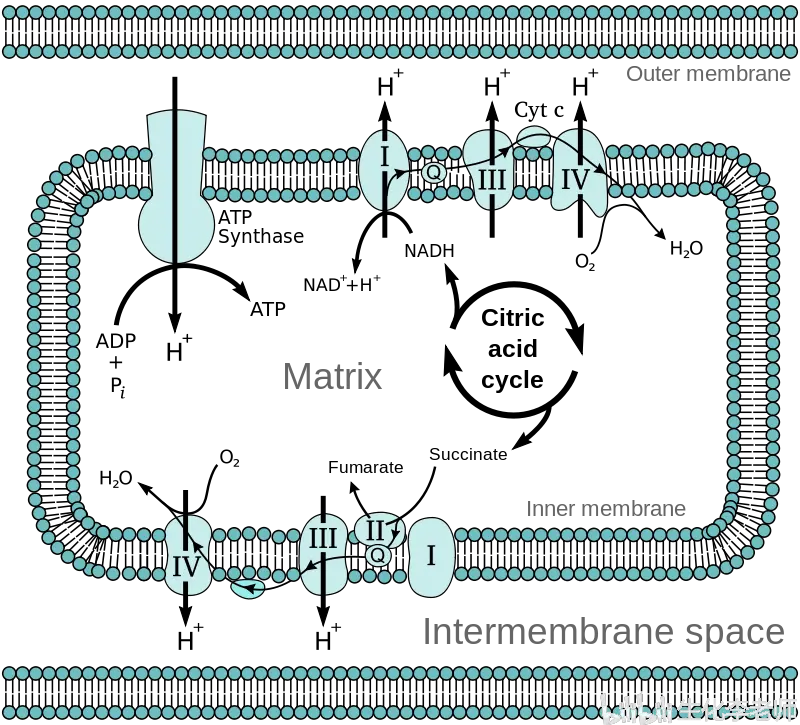
还原辅酶通过呼吸链再氧化的过程称为电子传递过程。辅酶运载的氢以质子形式脱下,电子则沿呼吸链转移到分子氧,形成离子型氧,再与质子结合生成水。放出的能量则使 ADP 和磷酸生成 ATP。电子传递和 ATP 形成的偶联机制称为氧化磷酸化(oxidative phosphorylation)。
还原辅酶的电子逐步传递到氧,是氧化;ADP 生成 ATP 是磷酸化。这两个过程偶联在一起,以电子传递的能量推动 ATP 合成,所以称为氧化磷酸化。与此相对应,生物体通过其它高能化合物的基团转移来合成 ATP,称为底物水平磷酸化。绿色植物通过光合作用,利用光能合成 ATP,称为光合磷酸化。
在葡萄糖的分解代谢中,一分子葡萄糖共生成 10 个 NADH 和 2 个 FADH2,其标准生成自由能是 613 千卡,而在燃烧时可放出 686 千卡热量,即 90%贮存在还原型辅酶中。呼吸链使这些能量逐步释放,有利于形成 ATP 和维持跨膜电势。
呼吸链包含 15 种以上组分,主要由 4 种酶复合体和 2 种可移动电子载体构成。其中复合体 Ⅰ、Ⅱ、Ⅲ、Ⅳ、辅酶 Q 和细胞色素 C 的数量比为 1:2:3:7:63:9。
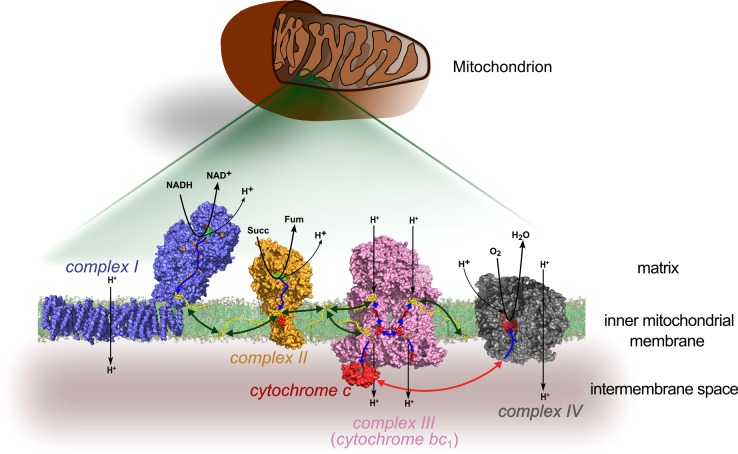
呼吸链的构成,引自 Physiol Rev. 2015 Jan; 95 (1): 219–243.
复合体 Ⅰ 是 NADH:辅酶 Q 氧化还原酶复合体,由 NADH 脱氢酶(一种以 FMN 为辅基的黄素蛋白)和一系列铁硫蛋白(铁 — 硫中心)组成。它从 NADH 得到两个电子,经铁硫蛋白传递给辅酶 Q。铁硫蛋白中铁的价态变化使电子从 FMNH2 转移到辅酶 Q。
电子从复合体 Ⅰ 传递到辅酶 Q 是一个放能过程,每传递一对电子可以将 4 个质子泵到线粒体的内膜与外膜之间,从而建立起跨膜质子梯度。线粒体就是利用这个质子梯度来推动 ATP 的合成,这是化学渗透学说的基本要点。
关于质子转位的详细过程,有不同的理论,有的认为是一次完成4个质子的易位,有的认为是分两次进行的。目前根据对原核生物线粒体复合物 Ⅰ 晶体结构的研究,以及其它相关证据,认为复合体 Ⅰ 的几个亚基在线粒体内膜上形成4个质子通道。电子由FMN通过铁硫簇传递到辅酶Q,会引起质子通道的构象变化,最终完成质子易位。
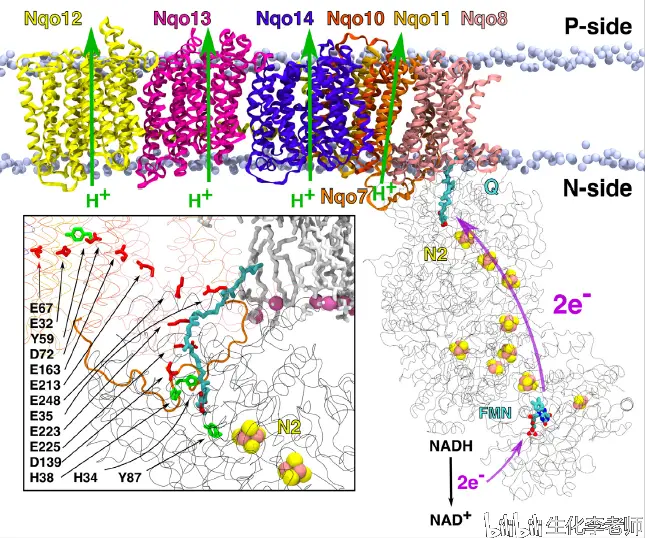
一对电子从复合体 Ⅰ 传递到辅酶 Q,泵出 4 个质子。引自 BBA-Bioenergetics 1859 (2018)
复合体 Ⅱ 就是三羧酸循环中的琥珀酸脱氢酶,含有 FAD 辅基和铁硫蛋白,将从琥珀酸得到的电子传递给辅酶 Q。复合体 Ⅱ 的能量变化较小,不能推动质子易位,所以 FADH2 产生的 ATP 比 NADH 少一个。
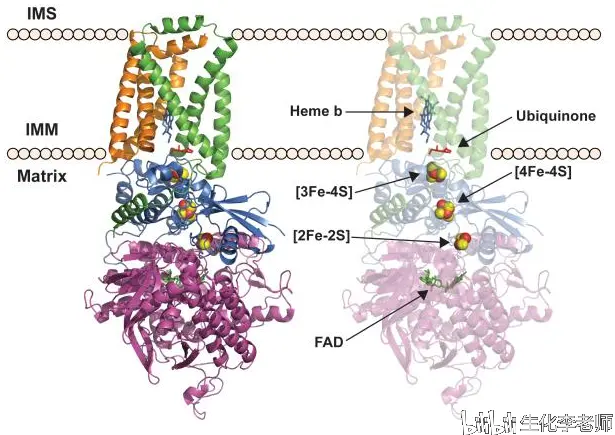
猪琥珀酸脱氢酶定位于线粒体内膜。引自 Crit Rev Biochem Mol Biol. 2015 Mar-Apr;50 (2):168-180.
