 危重儿童常用镇静镇痛评估方法
危重儿童常用镇静镇痛评估方法
# 危重儿童常用镇静镇痛评估方法
在 PICU 很多诊疗方法都可能为患儿带来疼痛或非疼痛相关的应激反应,几乎自感受到疼痛的第一时间开始,机体就快速出现各种反应,包括植物神经反应 (心率增快、血压升高、氧耗和二氧化碳排除增加) 和激素水平改变 (儿茶酚胺、胰高血糖素、皮质醇、醛固酮分泌增加,胰岛素分泌减少),如果这些反应不被及时发现并处理,则可能对患儿造成不良影响。因此,适当的镇静镇痛治疗几乎是 PICU 的常规治疗手段。正确评估镇静及疼痛程度是镇静镇痛治疗的重要组成部分,可以准确评估治疗的有效性、正确区分疼痛或非疼痛相关的应激反应,从而指导临床医师在选择药物种类、决定药物剂量、疗程以及撤药和停药等方面做出正确的决策。评估不足或过度均可导致用药不当,随之而来的负面效应也会增加。成人 ICU 已经具备一些较为系统化的镇静和镇痛评估工具,而儿童则有所欠缺。一直以来,儿科医师尤其是 PICU 医师都在摸索并试图建立适宜儿童的镇静镇痛评估方法,并使之系统化;不仅能对疼痛程度、镇静和镇痛治疗效果做出评估,也可区分疼痛和非疼痛相关的应激反应[1]。在我国,仍有医务人员忽视患儿疼痛的现象,从而在生理和心理上加重了患儿的损害。本文将对 PICU 常用的镇静镇痛的评估方法进行综述。
1 镇痛评估
疼痛是人类生来即有的生命素质,是一种主观的、多层次的现象,生后即能体验许多不同类型的急性和慢性疼痛,疼痛甚至可以增加危重新生儿病死率。但直至上世纪 80 年代末,人们才开始接受婴儿能感受疼痛的事实;1987 年,荷兰阿姆斯特丹 Emma 儿童医院的 Tera Boelen 发表的随机临床试验证实,术后给予适当的镇痛有利于早产儿的恢复。当人们认知到疼痛对儿童的危害后,同时也意识到正确评估了解疼痛程度的重要性。因此,评估儿童疼痛的方法层出不穷,尤其着重于针对那些无法理解且言语表达受限的儿童的疼痛程度,并了解减轻或加重疼痛的原因。当前的一个主要难点是缺乏针对年幼儿童的适宜疼痛量表,目前尚无一种评分系统能对儿童的疼痛进行完全的评估;如果患儿有足够的能力,自主评估是金标准,但需要 4~5 岁以上方能采用,低龄儿童仍有赖于行为分析;此外,在急诊室内这类环境紧张的地方,7、8 岁以下儿童的疼痛自我评估也是不可靠的,他们很可能因理解不当而将其疼痛的程度无限放大。这也是 7 岁以下儿童需要使用疼痛行为量表的原因[1:1]。在 PICU,占相当比例的患儿为意识不清或是给予了一些特殊治疗如气管插管、气管切开等,故无法进行疼痛的自我评估;此外,对于婴幼儿而言,也很难自行表述疼痛的程度,仅能从行为 (如哭闹、躲避、激动、表情痛苦等) 和生理反应方面 (如心率增快、血压上升、肌张力增高或激素水平改变) 有所表现[2]。疼痛的评估应包括三个主要方面:主观的自我疼痛评估;通过观察和衡量行为反应进行分级;对生理反应进行分级。行为及表情的评估更适用于短期的急性疼痛,慢性疼痛则会很复杂,由于伴有疲劳、焦虑等多重情况,使评估难度增加。
1.1 自我评估法
1.1.1 数字疼痛分级法 (numeric rating scale,NRS)
由 11 个数字 (0~10) 组成,0 代表不痛,10 代表疼痛难忍;该方法需要患儿自己用这些数字来描述疼痛的强度。适于学龄期的年长儿童,很多学者均验证了该方法的可靠性和有效性[3]。
1.1.2 视觉模拟评分法 (visual analogue scale,VAS)
该方法与 NRS 类似,可用于无法发声但神志清楚的患儿。具体方法为在纸上画一条 100 mm 的直线,其两端定义为不痛和剧痛,让患儿在线上标出最接近自己疼痛程度的位置,以此来评估其疼痛强度 ^4。适用于学龄期儿童。
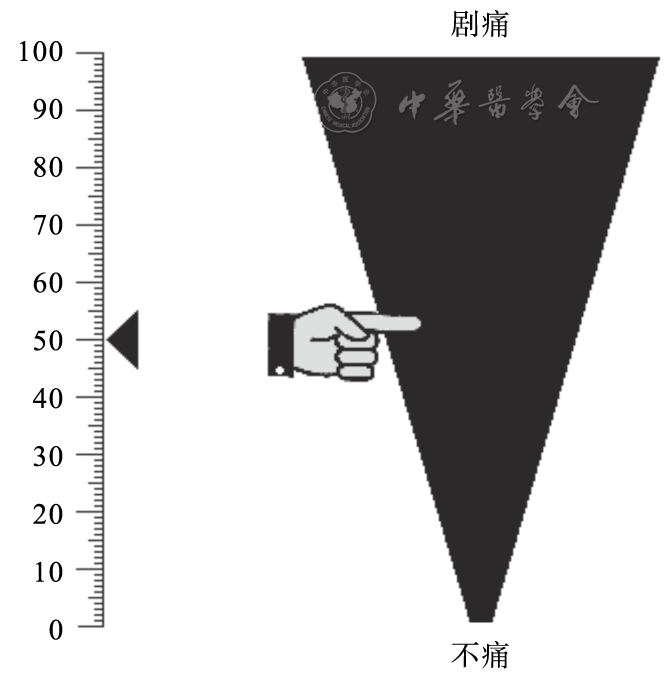
图 1 VAS 示意图
1.2 疼痛行为和生理反应分级
1.2.1 FLACC 量表
包括 5 个方面 (Face 表情、Legs 腿部运动、Activity 活动度、Cry 哭闹、Consolability 可安慰性),每一项得分 0~2 分,总分 10 分,得分越高,疼痛程度越重 ([表 1])。该量表首先用于 0~7 岁患儿术后疼痛的评估,现在多种场合均可使用,且可靠性较高[4]。有学者将其得分界定为 0~3 分为轻度疼痛或无痛,4~7 分为中度疼痛,8~10 分为剧烈疼痛。
表 1 FLACC 量表
| 项目 | 0 分 | 1 分 | 2 分 |
|---|---|---|---|
| 表情 (Face) | 微笑或无特殊表情 | 偶尔出现痛苦表情,皱眉,不愿交流 | 经常或持续出现下颚颤抖或紧咬下颚 |
| 腿部运动 (Leg) | 放松或保持平常的姿势 | 不安,紧张,维持于不舒服的姿势 | 踢腿或腿部拖动 |
| 活动度 (Activity) | 安静躺着,正常体位,或轻松活动 | 扭动,翻来覆去,紧张 | 身体痉挛,成弓形,僵硬 |
| 哭闹 (Cry) | 不哭 (清醒或睡眠中) | 呻吟,啜泣,偶尔诉痛 | 一直哭闹,尖叫,经常诉痛 |
| 可安慰性 (Consolability) | 满足,放松 | 偶尔抚摸拥抱和言语可安慰 | 难于安慰 |
1.2.2 面部表情疼痛量表 (faces pain scale,FPS)
该方法适用于婴幼儿。6 个水平排列的面部表情 (如微笑、皱眉、哭泣) 提示不同程度疼痛时的表情图,从不痛到疼痛难忍分别对应于 0~10 分 ([图 2])。医务人员可根据患儿面部表情与疼痛脸谱图进行比较并评估其程度,神志清楚的稍大儿童也可使用该量表做自我评估。与之类似的还有 Oucher 量表,该量表主要用于 3~7 岁的患儿;量表的左侧共有 10 种表情用于判断年长儿童的疼痛程度,右侧有 6 幅图片对应判断年幼儿的疼痛程度,由下往上疼痛程度逐渐加重。
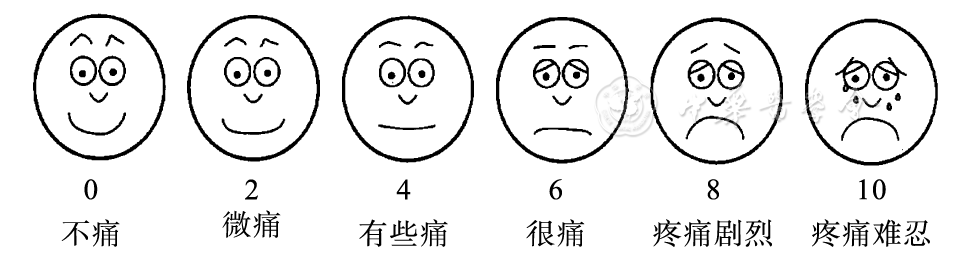
图 2 FPS 示意图
1.2.3 CRIES 评分法
适用于新生儿和婴儿术后疼痛评估。包含 5 项,每项得分 0~2 分,其中 1~3 分为轻度疼痛,4~6 分为中度疼痛,7~10 分为重度疼痛 ([表 2])。>3 分应进行镇痛治疗[5],[6]。有研究发现,CRIES 在术后第 1 个 24 小时与 VAS 结果相对应,是评估小婴儿术后疼痛的有效、可靠且相对客观的手段[6:1]。
表 2
CRIES 评分法
| 项目 | 0 分 | 1 分 | 2 分 |
|---|---|---|---|
| 啼哭 (Cry) | 无 | 高声 | 不可安抚 |
| SpO2>95% 时对 FiO2 的要求 (Requre FiO2 for SpO2>95%) | 无 | <30% | >30% |
| 生命体征变化 (与术前比较)(Increased vital signs) | HR,BP 无变化 | HR,BP 升高 < 20% | HR,BP 升高 > 20% |
| 表达 (Expression) | 无 | 做鬼脸,面部扭曲 | 咕哝 |
| 不能入睡 (Sleepless) | 无 | 间断性苏醒 | 经常苏醒 |
1.2.4 儿童疼痛观察量表 (pain observation scale for young children,POCIS)
POCIS 是 Boelen 和她的同事为病房护士对术后患儿进行疼痛评估所发明的一种简单易行的方法,1min 内即可完成评估,且适于急性和慢性疼痛。涉及指标包括临床医务工作者容易忽略的 7 种与疼痛相关的行为 —— 哭闹、觉醒状态、呼吸不规整、上肢震颤或手指运动、踢腿或抬腿、扭动或躯体震颤、面部表情。0 分为无疼痛,5~7 分为疼痛剧烈,记录后评估疼痛程度。Boelen-van der Loo 等[7]对 300 个耳鼻喉科小患儿实施了鼓膜置管术、腺样体扁桃体切除术后的疼痛进行了评估,结果显示 POCIS 可靠且有效,且观察者间信度可达到 75%~96%。
1.2.5 其他
客观疼痛量表 (objective pain scale) 用于 6 个月~3 岁患儿,主要评估其血流动力学和行为参数 (包括自主活动、激惹程度和面部表情),含 5 项指标,分值≥6 分需镇痛治疗。加拿大东安大略儿童医院评分法 (children′s hospital eastern Ontario pain scale,CHEOPS) 推荐用于 1~3 岁儿童,评估内容包括面部表情、儿童言语、躯干 / 身体运动、哭、触摸伤口、腿的位置等 6 项 (child verbal,facial expression,cry,torso/body motion,touching wound area,legs′ position),主要用于术后疼痛评估;分值=4 为无痛,分值=13 为最痛。儿童和婴儿术后疼痛量表 (children′s and infants′ postoperative pain scale,CHIPPS) 包括 5 个要素:哭闹、面部表情、躯体姿势、腿的姿势、不自主运动;每项得分为 0~2 分,总分得分为 0 分 (不痛)~10 分 (剧痛);其内部一致性 Cronbachs′α 值在幼儿为 0.92,婴儿为 0.96,评分者间信度系数为 0.93;疼痛时的 CHIPPS 分值均高于 4 分,敏感性和特异性分别为 0.92~0.96 和 0.74~0.95;因此有认为可以单独使用 CHIPPS 作为低龄组儿童术后的疼痛评估法[8]。
由于无法与医务人员进行有效沟通,小婴儿的疼痛常被曲解,常需要有经验的临床医护团队,甚至需借助父母的帮助。加拿大 Halifax 儿童医院在父母观察的基础上建立了一种可用于家中或医院内儿童疼痛的评估方法。由于患儿父母不能正确运用评估方法,而且对镇痛也缺乏足够的认识,因此父母容易低估一日手术后返家儿童的疼痛程度。父母术后疼痛评估 (parents′ postoperative pain measure,PPPM) 是基于 15 种行为表现而建立的,最初人们认为对 7~12 岁儿童而言,PPPM 非常接近于金标准 —— 自我描述;后来随着实践的增加,人们发现 PPPM 也适于 2~6 岁的儿童,尤其是那些疼痛但不焦虑的患儿,是一种敏感的并能指导镇痛治疗的评估方法。
疼痛评估的原则是当无法进行医患交流时,应着眼于对行为 (呻吟、尖叫、面部表情、与疼痛相关的身体运动、对医务人员的检查有无反应、人机是否合拍等) 和生理指标 (心率、血压、呼吸频率、周围氧饱和度、出汗、颅高压等) 的评估;但是这些反应又必须同机体的一些其他行为反应区分开来,如饥饿、口渴、焦虑或其他一些非疼痛所致症状。而且应当注意的是,随着患儿的疲劳,其对疼痛的反应会逐渐减弱,因此对慢性疼痛而言,仅依靠对疼痛反应程度的评分方法是不可信的。
2 镇静评估
镇静治疗是 PICU 常用的治疗手段,理想的镇静应是患儿舒适并处于睡眠状态,没有焦虑和疼痛,可顺利完成诊治,同时可以被唤醒。这种理想的镇静状态一直是 PICU 医师所追求的,应根据每位患儿不同病情制定其对应的理想镇静水平,并做定期评估。目前儿科临床镇静评分系统有多种,常用的方法包括 Ramsay 镇静量表、舒适度评分 (comfort score)、镇静躁动量表 (sedation agitation scale,SAS)、Richmond 躁动镇静量表 (Richmond agitation sedation scale,RASS)、脑电双频指数 (bispectral index,BIS) 等。
2.1 Ramsay 镇静量表 (Ramsay sedation scale,RSS)
RSS 是第一个用于评估患者镇静程度的量表,表格直观、使用方便。医务人员可在床边做出评估,并可动态评估,是使用最广泛的儿童镇静评估方法。根据如何唤醒患儿将镇静程度分为 6 级,其中 1 级为清醒,2~4 级可能是理想的临床镇静终点 ([表 3])。人工通气支持条件较高的患儿可能需要更深程度的镇静,RSS 可达 3~5 分。RSS 中的刺激方法是专门设计的,不得惊吓患儿;事实上 RSS 不会将患者完全唤醒至清醒状态,这样其睡眠模式不会被干扰。RSS 的缺陷是它有赖于患儿的反应能力,因此不适于使用神经肌肉阻滞剂的患儿;RSS 的 1 级并未对躁动程度进行进一步分级,而这有时非常重要,SAS 却注意到了这点;同时 6 级无反应也不能区分患儿是处于轻型的全身麻醉还是深昏迷。
表 3 Ramsay 镇静量表
| 分级 | 临床表述 |
|---|---|
| 1 | 焦虑躁动或烦躁不安,或二者同时存在 |
| 2 | 合作、安静、定向力良好、对机械通气耐受良好 |
| 3 | 只对指令有反应 |
| 4 | 对轻叩眉间或巨大声响刺激的反应敏捷 |
| 5 | 对轻叩眉间和巨大声响刺激的反应迟钝 |
| 6 | 患儿表现为无反应 |
2.2 舒适度量表 (comfort score) 和舒适度 - 行为量表 (comfort-behavior scale,Comfort-B Scale)
舒适度量表早期用于评估 PICU 机械通气患儿的舒适度 / 应激情况,是 PICU 应用最广泛的镇静评估方法,包括 8 个变量 (6 个行为变量:警醒,平静,肌张力,运动,表情紧张,呼吸反应;2 个生理学变量:心率,平均动脉压),每个变量 1~5 分,共 40 分。该量表被分为 3 级:8~16 分为深度镇静,17~26 分为轻度镇静,27~40 分为镇静不足,适用于各年龄段患儿,具有较高的内部一致性和评分者间信度,但评分相对复杂且费时。Franck 等[9]认为舒适度量表可作为足月新生儿心脏术后镇静镇痛的主要评估工具,较好地兼顾了行为和生理学两个方面;同时研究发现,舒适度量表和心率变异性的高频成分在术后第 1 个 48 h 内与阿片类药物剂量及血浆水平呈负相关,除去临床变量因素后,只有舒适度量表还存在显著差异,因此量表可对阿片类药物如吗啡血浆水平的巨大变异做出解释;此外作者还强调应使用舒适度量表的原始版本而非缩写版,以免降低了该量表的解释功能。但是也有学者发现,尽管心率和平均动脉压随时间的改变仍较为稳定,但这两项指标与 VAS 和舒适度量表中的行为变量的相关性较差;因此认为,可能舒适度 - 行为量表即可对镇静镇痛做出评估[10]。舒适度 - 行为量表是根据舒适度量表衍变而来,去除了心率和血压两项生理指标,每项得分 1~5 分,总分为 6~30 分。包括警醒,安静,身体运动,表情紧张,肌张力,呼吸反应 / 哭闹等 6 个方面,其中呼吸反应用于机械通气患儿,哭闹用于非机械通气患儿。舒适度 - 行为量表的功效已经在 PICU 得以验证[11]。Valkenburg 等[12]发现舒适度 - 行为量表对 0~3 岁的唐氏综合征患儿的疼痛评估也十分有效。我国上海交通大学的一项研究显示,舒适度 - 行为量表和 FLACC 量表对心脏术后患儿的镇静镇痛评估均有效且可靠;舒适度 - 行为量表在 13 分这个节点具有较好的敏感性 (86%) 和特异性 (83%),而 FLACC 量表则在 2 分这个节点上具有很好的敏感性 (98%) 和特异性 (88%)[13]。
2.3 脑电双频指数 (bispectral index,BIS)
BIS 是一种数字化脑电图监测方法,是评估 PICU 患儿的麻醉深度及镇静程度较好的工具。BIS 用 0~100 分来表示不同的脑电活动度,100 分表示患儿处于觉醒状态,40~60 分提示在全身麻醉的情况下足以抑制成人的觉醒;小于 40 分则提示深度镇静麻醉或昏迷状态,较为理想的镇静水平为 65~85 分。研究发现,同一镇静患者其左右脑之间的 BIS 存在差异,尤其是患者受刺激时改变明显[14]。有学者认为对 PICU 患儿而言,BIS 可能是识别和防止过度镇静的最有效方法之一[15]。
关于各种镇静评分系统的关系,有多种见解。有文献报道 Ramsay 镇静评分与 BIS 在危重患儿镇静评估中有较好的相关性[16],[17]。舒适度量表与 BIS 在轻中度镇静时相关性较好[14:1];但舒适度量表不能区分深度 (BIS 41~60) 和极深度 (BIS≤40) 镇静[18]。也有学者认为,对那些为完成影像学检查而接受苯巴比妥治疗的 Ramsay 评分为中重度镇静水平的儿童而言,BIS 的鉴别能力有限[19]。舒适度量表着眼于 PICU 患儿整体舒适度的评估,包括疼痛、精神痛苦和镇静情况等;而 BIS 则着眼于意识水平的评估。因此,患儿可能出现 BIS 得分较高,而舒适度量表却较低;反之一个深度镇静的患儿可能 BIS 得分较低,但仍能感受疼痛并在受刺激时出现激惹[14:2]。
2.4 Brussels 镇静量表 (Brussels sedation scale)
Brussels 镇静量表和 RSS 类似,但较 RSS 更为简单,且分级与镇静深度的关系正好与 RSS 相反 ([表 4])。研究显示,该量表有利于避免对机械通气患儿的过度镇静。
表 4 Brussels 镇静量表
| 分级 | 临床描述 |
|---|---|
| 1 | 不能唤醒 |
| 2 | 对疼痛刺激 (捏斜方肌) 有反应,但对声音刺激无反应 |
| 3 | 对声音刺激有反应 |
| 4 | 清醒而平静 |
| 5 | 兴奋 |
2.5 其他
SAS 共分为 7 级,其中第 7 级为危险躁动,4 级为安静合作,3 级为镇静,1 级为不能唤醒。RASS 从+4~-5 共分为 10 级,其中+4 级为极度狂躁,可有暴力行为;-5 级不能唤醒,对声音和物理刺激均无反应;0 级为清醒并平静的状态[20]。有学者对使用右旋美托咪啶镇静的机械通气患者进行镇静评估时发现,RASS 和 BIS 之间具有较好的相关性[21]。
3 小结
理想的镇静镇痛评估方法应该是耗时短、操作简便、可重复性好、具有较好的敏感性、特异性和评估者间信度,即使是在急诊室这种高强度、高压力的紧张环境中也能准确对患儿进行评估的方法。虽然现有的评估方法较多,但仍各有利弊,可靠性、有效性及敏感性均亟待完善,临床医护人员可根据不同的环境、病情、患儿特点等选择适宜的评估方法,甚至可以多种方法相结合指导治疗。
参考文献
Fournier-CharrièreE, TourniaireB, CarbajalR, et al. Evendol, a new behavioral pain scale for children ages 0 to 7 years in the emergency department:Design and validation[J]. Pain, 2012, 153(8):1573–1582. ↩︎ ↩︎
DorfmanTL, Sumamo SchellenbergE, RempelGR, et al. An evaluation of instruments for scoring physiological and behavioral cues of pain, non-pain related distress, and adequacy of analgesia and sedation in pediatric mechanically ventilated patients:A systematic review[J]. Int J Nurs Stud, 2013, Aug 26.[Epub ahead of print]. ↩︎
PuntilloK, PaseroC, LiD, et al. Evaluation of pain in ICU patients[J]. Chest, 2009, 135(4):1069–1074. ↩︎
MerkelSI, Voepel-LewisT, ShayevitzJR, et al. The FLACC:a behavioral scale for scoring post operative pain in young children[J]. Pediatr Nursing, 1997, 23(3):293–297. ↩︎
KrechelSW, BildnerJ. Cries:a new neonatal postoperative pain measurement score.Initial testing of validity and reliability[J]. Paediatr Anaesth, 1995, 5(1):53–61. ↩︎
McNairC, BallantyneK, DionneK, et al. Postoperative pain assessment in the neonatal intensive care unit[J]. Arch Dis Child Fetal Neonatal Ed, 2004, 89(6):537–541. ↩︎ ↩︎
Boelen-van der LooWJ, SchefferE, de HaanRJ, et al. Clinimetric evaluation of the pain observation scale for young children in children aged between 1 and 4 years after ear, nose, and throat surgery[J]. J Dev Behav Pediatr, 1999, 20(4):222–227. ↩︎
BüttnerW, FinkeW. Analysis of behavioural and physiological parameters for the assessment of postoperative analgesic demand in newborns, infants and young children:a comprehensive report on seven consecutive studies[J]. Paediatr Anaesth, 2000, 10(3):303–318. ↩︎
FranckLS, RidoutD, HowardR, et al. A comparison of pain measures in newborn infants after cardiac surgery[J]. Pain, 2011, 152(8):1758–1765. ↩︎
van DijkM, de BoeraJB, KootHM, et al. The reliability and validity of the COMFORT scale as a postoperative pain instrument in 0 to 3-year-old infants[J]. Pain, 2000, 84(2–3):367–377. ↩︎
LarsonGE, McKeeverS. Assessing the introduction of the COMFORT B pain assessment tool into the paediatric intensive care (PICU) environment[J]. Australian Crit Care, 2011, 24(1):77–78. ↩︎
ValkenburgAJ, BoerlageAA, IstaE, et al. The Comfort-Behavior scale is useful to assess pain and distress in 0-to 3-year-old children with Down syndrome[J]. Pain, 2011, 152(9):2059–2064. ↩︎
BaiJ, HsuL, TangY, et al. COMFORT behavior scale and the FLACC scale for pain assessment in Chinese children after cardiac surgery[J]. Pain Manag Nurs, 2012, 13(1):18–26. ↩︎
FroomSR, MalanCA, MecklenburghJS, et al. Bispectral Index asymmetry and COMFORT score in paediatric intensive care patients[J]. BJA, 2008, 100(5):690–696. ↩︎ ↩︎ ↩︎
CrainN, SlonimA, PollackMM. Assessing sedation in the pediatric intensive care unit by using BIS and the COMFORT scale[J]. Pediatr Crit Care Med, 2002, 3(1):11–14. ↩︎
BerkenboschJW, FichterCR, TobiasJD. The correlation of the bispectral index monitor with clinical sedation scores during mechanical ventilation in the paediatric intensive care unit[J]. Anesth Analg, 2002, 94(3):506–511. ↩︎
AnejaR, HeardAM, FletcherJE, et al. Sedation monitoring of children by the Bispectral Index in the paediatric intensive care unit[J]. Pediatr Crit Care Med, 2003, 4(1):60–64. ↩︎
TwiteMD, ZukJ, GrallaJ, et al. Correlation of the Bispectral Index Monitor with the COMFORT scale in the pediatric intensive care unit[J]. Pediatr Crit Care Med, 2005, 6(6):648–653. ↩︎
MasonKP, MichnaE, ZurakowskiD, et al. Value of bispectral index monitor in differentiating between moderate and deep Ramsay Sedation Scores in children[J]. Paediatr Anaesth, 2006, 16(12):1226–1231. ↩︎
许峰. 儿科重症监护病房患儿镇痛镇静疗效评估 [J]. 中华实用儿科临床杂志,2013, 28 (18):1370–1371. ↩︎
TurkmenA, AltanA, TurgutN, et al. The correlation between the Richmond agitation-sedation scale and bispectral index during dexmedetomidine sedation[J]. Eur J Anaesthesiol, 2006, 23(4):300–304. ↩︎
